Li-S电池与锂离子电池相比具有更高的理论容量(1 672 mA ·h/g)和理论比能量密度(2 600 W ·h/kg),因此作为一种大容量、低成本、环保的二次电池,近年来关于其的研究得到飞速发展,甚至有望取代锂离子电池[1-3]。然而Li-S电池涉及多电子转移电化学,其实际应用和商业化还需解决活性物质利用率低、容量衰减快、库仑效率低、循环稳定性差等问题[4-5]。究其原因主要有:(1)正极材料硫与放电产物Li2S、Li2S2之间的导电性差;(2)中间态多硫化锂Li2Sn容易溶解于电解液中,在阳极和阴极之间来回穿梭[6];(3)放电过程中硫阴极的显著体积膨胀(约为80%)缩短了Li-S电池的循环寿命[3]。为解决上述问题,研究者们提出了很多策略[7-12],如以石墨烯、氧化石墨烯、炭黑、碳纳米管、碳纤维、空心碳球等为基础,设计了大/中/微孔硫/碳结构作为复合材料的主体阴极材料。到目前为止被认为最有效的方法是将易于溶解的Li2Sn团簇捕获到具有较大孔洞结构的主体材料中,提高Li-S电池的循环寿命[13]。如介孔结构的TiO2球材料具有较大的孔体积,可在电池内部为电化学反应提供巨大的反应平台,并同时加快电子传输[14];S/V2O5复合材料能够促进离子的迁移,降低电极的电化学阻抗[15];CoS2/石墨烯复合材料中的CoS2不仅可以起到电催化剂的作用,还可以通过调节复合材料中CoS2的比例来改变电池的初始放电比容量[16-17]。
Janus MoSSe在实验室中的成功制备[18],引起了人们对“双面神”过渡金属二硫属化物(Janus TMD)极大的研究兴趣,因其夹层结构特殊,三明治结构的3个原子层分别由3种不同的原子组成,偶极矩诱导的内电场可将电子-空穴对分开,使其在场效应晶体管、超薄光电探测和发光器件中具有广泛的应用潜力[19]。Wang等[20]已证明Janus TMD是电催化剂析氢反应(HER)的高效催化剂,其边缘部位也具有HER活性。Xu等[21]研究了Te在Li-S电池中的锚定能力,发现Te可以有效地捕获锂离子液体。受以上研究的启发,鉴于二维Janus TMD结构(表面原子间距为3.404 Å)与石墨烯(C—C原子间距为1.420 Å)相比具有更大的孔洞结构,且Li-S电池充电时电化学反应和水电解析氢反应本质相似,本文选择Te、S、Co元素构建Janus TMD结构的CoSTe单层膜,利用第一性原理研究了该膜材料在Li-S电池电化学反应中的作用效果,以预判其可否成为Li-S电池的潜在锚固材料。
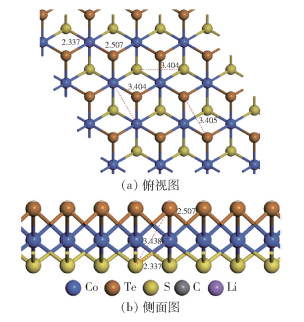
1 计算模型的稳定性及计算方法如图 1(a)、(b)所示,使用S、Te、Co各16个原子构建4×4×1的超晶胞CoSTe单层膜,沿Z轴方向将层上下均设置为10 Å,以消除镜像影响。计算该结构单原子形成能,计算公式为Ef =(ECoSTe-
|
图 1 CoSTe单层膜结构图 Fig.1 Structure diagram of a CoSTe monolayer |
|
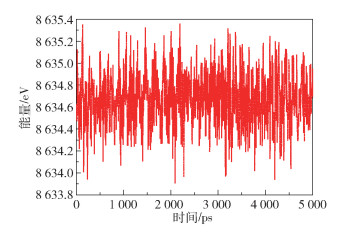
图 2 Janus CoSTe单层膜在298 K时热动力学总能量变化 Fig.2 Change in the total thermokinetic energy of a Janus CoSTe monolayer at 298 K |
密度泛函理论计算使用Cambridge Sequential Total Energy Package (CASTEP)完成[22],采用general gradient approximate(GGA)方法[23],交换关联函数选择Perdew-Burke-Ernzerhof (PBE)函数[24],几何结构优化采用Broyden-Fletcher-Goldfarb-Shanno (BFGS)算法[25];使用超软赝势描述电子-离子相互作用,具体电子组态分别为Te(5s2 5p4)、Co(4s2 3d7)、S (3s2 3p4),对过渡金属元素Co的d轨道使用Hub U(U=2.5 eV)校正[26],范德华远程弱相互作用校正选用Grimme(DFT-D3)方法[27],平面波能量截止设定为420 eV,结构优化的布里渊区积分采用以G点为中心的4×4×1 K点采样,所有能量计算中都采用8×8×1的K点采样。结构自洽优化收敛标准设置如下:最大位移5.0×10-4 nm,最大内应力收敛标准0.02 GPa,原子间的最大相互作用力0.01 eV/nm,结构的总体能量收敛小于5×10-6 eV每原子。
2 结果与分析 2.1 Li2Sn团簇在Janus CoSTe单层膜表面的吸附Janus CoSTe单层膜对Li2Sn的锚定能力主要通过计算吸附能来评价。由于Janus CoSTe单层膜的二面异质性,分别计算了S8和Li2Sn在两表面上的吸附能Eads,计算公式为Eads=Etotal-EJanus CoSTe-ELi2Sn,其中EJanus CoSTe、ELi2Sn分别代表吸附前Janus CoSTe单层膜最优结构和各种Li2Sn团簇的能量,Etotal代表吸附了Li2Sn团簇的Janus CoSTe单层膜最优结构系统的总能量。
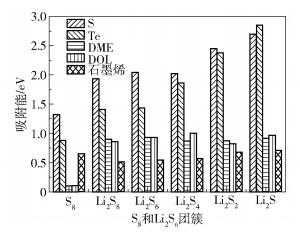
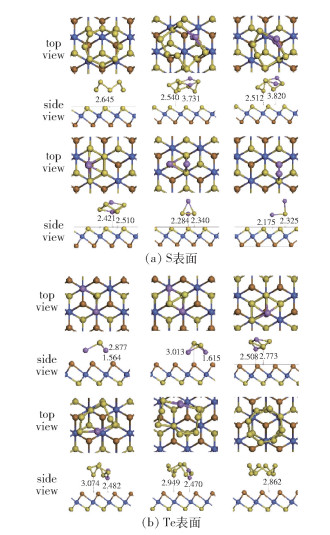
单层膜两表面计算的一些关键数据见表 1,吸附能计算结果如图 3所示,S、Te表面分别对S8及Li2Sn的最终吸附构型如图 4所示。可见与石墨烯、乙二醇二甲醚(DME)和1, 3-二氧戊环(DOL)的吸附能[28]相比,单层膜的两个表面对Li2Sn的吸附能力在作为锚定材料方面均有优势,值得注意的是单层膜的S和Te表面对S8的吸附能分别是电解液的13倍和8倍,因此充电时S8更易于在单层膜的S表面析出。
| 下载CSV 表 1 S/Te表面吸附构型关键参数 Table 1 Key parameters of the adsorption configuration at the S and Te surfaces |
|
图 3 S8和Li2Sn团簇在S/Te/石墨烯表面上与常用DME、DOL电解液的吸附能对比 Fig.3 The adsorption energies of S8 and Li2Sn clusters on S/Te/graphene surfaces compared with DME and DOL electrolytes |
|
图 4 Li2Sn团簇在Janus CoSTe单层膜表面的最终吸附构型 Fig.4 Final adsorption configuration of Li2Snclusters on the surface of a Janus CoSTe monolayer |
结合图 3、4和表 1数据进一步分析发现,在Li2Sn团簇从S8向Li2S变化过程中,团簇在S表面的吸附能从1.32 eV变化到2.70 eV,其中范德华力构成的吸附能Evdw从1.26 eV(占总吸附能的95%)减小到0.86 eV(占总吸附能的32%);团簇吸附前后Li-S键长变化量Δd从0.005 Å增加到0.165 Å,团簇中S原子到基底的最小吸附高度hS,min从2.645 Å减小到2.325 Å,Li原子到基底的最小吸附高度hLi,min从3.731 Å减小到2.175 Å。团簇在Te表面的吸附能从0.88 eV变化到2.85 eV,其中范德华力构成的吸附能Evdw从0.82 eV(占总吸附能的94%)减小到0.42 eV(占总吸附能的15%);Li2Sn团簇吸附前后Li-S键长变化Δd从0.018 Å增加到0.235 Å,团簇中S原子到基底的最小吸附高度hS,min从2.862 Å减小到2.627 Å,Li原子到基底的最小吸附高度hLi,min从2.470 Å减小到1.564 Å。以上数据的变化说明团簇分子与CoSTe单层膜两表面间的吸附机制有一定区别:高阶Li2Sn团簇在距离膜表面较远时,团簇在S表面的吸附强于Te表面,团簇中的S与膜表面上的S相似相溶,以范德华力为主的S—S之间的相互作用强于S—Te之间的物理吸附,因此对高阶Li2Sn团簇有较大的亲S性的表面吸附能;而随着Li2Sn团簇尺寸的减小,团簇与表面之间的距离减小,Li与表面间的化学键合作用逐渐增强,据元素周期表数据,S、Li、Te原子共价半径大小分别为1.02、1.34、1.35 Å,Li和Te半径相当,此时当团簇中的Li原子与表面吸附时Li-Te间的相互作用会强于Li-S,因此Te表面相较于S表面对低阶Li2Sn团簇有更大的亲Li性的化学吸附能。
2.2 Li2Sn团簇在Janus CoSTe单层膜表面的分解锚定材料另一个应评估的特性是锚定的Li2Sn能否稳定地吸附在Janus CoSTe单层膜上以防止其分解和溶解,为此计算了Li2Sn在Janus CoSTe两个表面上的吸附分解能[29]。计算方法是将稳定吸附了Li2Sn的Janus CoSTe膜系统总能量记为E0,其在Janus CoSTe表面上依次分解出2个Li原子至离S原子足够远的位置,在Janus CoSTe表面上形成Li+LiSn和Li+Li+Sn共吸附的稳定的最低能量结构,形成的系统总能量分别记为E1和E2,E1-E0和E2-E0即为吸附分解能。如图 5(a)和(b)给出了Li2S4在Janus CoSTe膜的Te表面分解的Li+LiS4和Li+Li+S4共吸附图。计算完整结构和分解结构之间的能量差异(E1-E0和E2-E0),可分别得到表面Li原子吸附依次分解能量。在吸附分解能方面,无论是S还是Te表面,所有分解结构都具有正的相对能量,说明Janus CoSTe膜上吸附完整的Li2Sn的稳定性高于分解后的稳定性,因此Li2Sn团簇的分解不太容易自发地在Janus CoSTe膜层上发生。Janus CoSTe单层膜的S和Te两个表面对高阶Li2Sn团簇的吸附分解能明显高于低阶Li2Sn,在S表面的吸附分解能略高于Te表面。结合表 2中的键长变化Δd发现,Li2Sn中的Δd越大,吸附分解能越小,说明高阶Li2Sn比低阶Li2Sn更难分解,Janus CoSTe膜的S表面能更好地抑制高阶Li2Sn团簇分解。
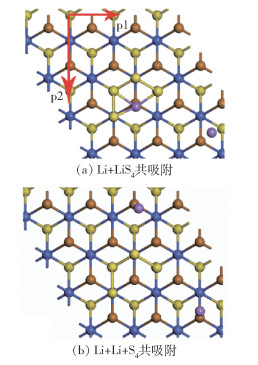
|
图 5 Li2S4在CoSTe膜表面分解时的共吸附图 Fig.5 Co-adsorption diagram of Li2S4 on the surface of a CoSTe film |
| 下载CSV 表 2 Janus CoSTe单层膜S/Te二面的吸附分解能 Table 2 Adsorption and decomposition energies at the S and Te surfaces of a Janus CoSTe monolayer |
Zhou等[30]提出锚固材料表面上的Li2S分解反应能垒与实验中测得的过电位高度相关,并且表面的脱锂反应动力学对Li-S电池的整体性能有重要影响,解离能垒越大,电池在初始充电电极激活时需要的活化能垒越高。因此计算Li2S中的Li原子在CoSTe单层膜S、Te及石墨烯表面上沿图 6(a)、(b)、(c)中紫色串珠所示解离路径变化时的解离能大小,比较结果如图 6(d)所示。Te、S表面上解离能垒最大分别为0.67、0.74 eV,均小于石墨烯表面的1.81 eV。结合表 1数据我们认为,Li2S中的Li原子在表面的解离过程中,解离能主要取决于Li2S中Li-S键断裂所需的能量和膜表面对Li原子的总吸附能之差,其中Li-S键断裂能随着Li原子逐渐远离S原子先增大后减小,与两原子的相互作用半径相关;而膜表面对Li原子的总吸附能则与Li距离表面基底高度、表面原子半径及其分布状况都相关,其中Li2S中Li原子在S、Te、石墨烯表面的吸附结构在解离前距离表面的高度分别为2.175、1.564、2.794 Å,S、Te、C、Li原子的共价半径分别为1.02、1.35、0.77、1.34 Å,因此各原子在其有效作用半径范围内,Te表面对Li2S中Li原子的吸附能力最强,最有利于Li-S键断裂,解离能垒最低,S表面的解离能垒次之;而在石墨烯表面,Li原子距离表面高度大于Li、C共价半径之和,超出化学相互作用范围,只有很小的物理吸附作用,此时解离能垒主要取决于Li-S键断裂所需能量,且由于石墨烯表面C原子分布较密集,Li原子在表面走完一个完整的结构周期后,Li2S中的Li-S键还未完全断裂,所以其表面解离能垒最高。
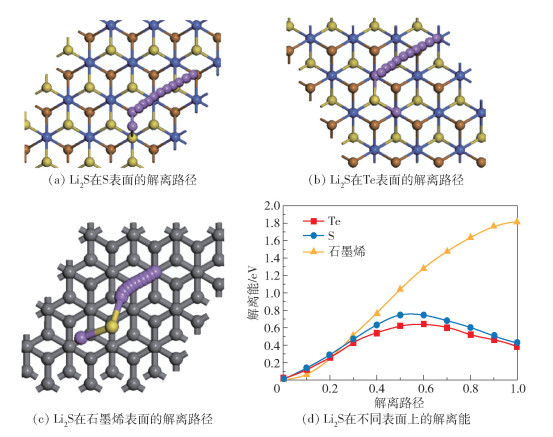
|
图 6 Li2S在不同表面上的解离路径和解离能 Fig.6 Dissociation paths and dissociation energies of Li2S on different surfaces |
Li2Sn团簇在锚固材料上的扩散对Li-S电池的实际性能起着重要作用。本文计算了Li2Sn(n=8,6,4,2,1)在CoSTe单层膜S、Te两表面上沿不同途径的扩散能垒,扩散途径如图 5(a)中的p1和p2所示。表面扩散计算采用最小能量路径(MEP)方法:首先用完整的线性/二次同步转变(LST/QST)方法搜索不同扩散路径中的过渡态,然后用微调弹性带(NEB)方法取多点定位计算其自由能[31]。Li2Sn团簇在表面上的扩散系数D可根据Arrhenius方程D=exp(-Ed/kBT)通过扩散能垒大小计算,其中Ed是计算得到的扩散能垒,kB是玻尔兹曼常数,T是环境温度。两表面上Li2Sn团簇的扩散能垒和沿不同路径的扩散系数比总结于表 3,可以看出,无论在S表面还是Te表面上,首先Li2Sn团簇分子越大,表面扩散难度越大,即高阶Li2Sn吸附在膜材料表面且不易于扩散,理论上有利于抑制高阶Li2Sn团簇溶解于电解液和发生“穿梭效应”;其次Li2Sn团簇沿不同路径的扩散难度也不同,在表面沿路径p2比p1更难扩散。Li2Sn团簇在表面的扩散有其微观上的“通道”,团簇越大通道效应越明显,如Te表面上Li2S8团簇的扩散系数比Dp2/Dp1达到3.58×106。相对而言Li原子在CoSTe单层膜不同表面上的扩散较自由。
| 下载CSV 表 3 Janus CoSTe单层膜上S/Te面沿不同路径扩散能垒及扩散系数比 Table 3 Diffusion energy barriers and diffusion coefficient ratio for S and Te surfaces along different paths on Janus CoSTe monolayers |
由于高导电性特别有利于充放电过程中的电化学活性,本文研究了Janus CoSTe单层膜的电子能带结构,结果如图 7(a)所示。能带带隙为0, 表示Janus CoSTe单层膜为金属特征。具体电荷态密度分布如图 7(b)所示,费米面附近的电子轨道被占据,这主要是由p电子和d电子作出的贡献。图 7(c)的Janus CoSTe单层膜电荷分波态密度(PDOS)更具体地表明了d电子主要来源于Co原子,p电子主要来源于Te和S原子,p、d电子之间有明显的轨道杂化。另外还计算了Janus CoSTe单层膜在吸附S8和Li2Sn团簇后的能带结构,图 7(d)、(e)给出了Li2Sn团簇在Janus CoSTe单层膜上吸附后的电荷总态密度图,可以看出吸附了S8和Li2Sn团簇的单层膜的电荷态密度除了数量上的微小变化,在费米面附近的电荷态密度分布形态基本不变,也即吸附了S8和Li2Sn团簇的单层膜的金属特性仍然可以很好地保持。因此,就导电性而言Janus CoSTe单层膜对于Li-S电池是很好的锚定材料。
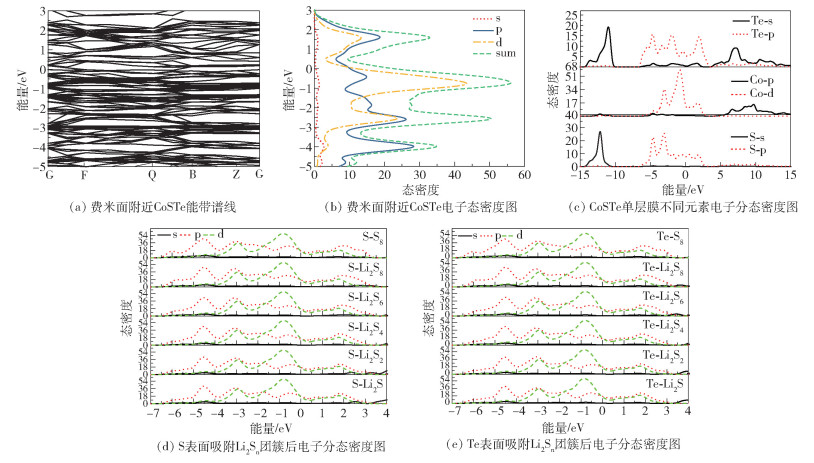
|
图 7 表面吸附Li2Sn团簇前后的能带谱线及态密度图 Fig.7 Energy band lines and density of states diagrams before and after surface adsorption of Li2Sn clusters |
在放电过程中,S8到Li2Sn团簇之间的化学反应可以描述如下。
| $ \mathrm{S}_8+2 \mathrm{Li}=\mathrm{Li}_2 \mathrm{S}_8 $ | (1) |
| $ 3 \mathrm{Li}_2 \mathrm{S}_8+2 \mathrm{Li}=4 \mathrm{Li}_2 \mathrm{S}_6 $ | (2) |
| $ 2 \mathrm{Li}_2 \mathrm{S}_6+2 \mathrm{Li}=3 \mathrm{Li}_2 \mathrm{S}_4 $ | (3) |
| $ \mathrm{Li}_2 \mathrm{S}_4+2 \mathrm{Li}=2 \mathrm{Li}_2 \mathrm{S}_2 $ | (4) |
| $ \mathrm{Li}_2 \mathrm{S}_2+2 \mathrm{Li}=2 \mathrm{Li}_2 \mathrm{S} $ | (5) |
为了验证Janus CoSTe单层膜在放电过程中的反应动力学得到增强,本文研究了硫在Janus CoSTe单层膜两个面上的硫还原反应(SRR) 性能[32]。反应前后的吉布斯自由能变化ΔG=ΔE+ΔEZPE-TΔS,其中ΔE、ΔEZPE、ΔS分别是反应产物和反应物之间的总能量、零点能量和熵的差。图 8显示了不同表面硫还原反应从S8到Li2S的每个反应步骤的吉布斯自由能演化,可以看出对于Janus CoSTe单层膜的两个表面,步骤(1)、(2)表现为自发的放热反应,其他3个步骤是吸热反应,而对于石墨烯表面只有步骤(1)放热,其他4个步骤均为吸热反应。对于Te表面,最大正吉布斯自由能变化ΔG3 =0.32 eV,对应Li2S6还原为Li2S4的步骤,是整个放电过程中的限速步骤;对于S表面和石墨烯表面,最大正吉布斯自由能变化ΔG分别为0.43 eV和0.75 eV,均对应Li2S2还原为Li2S的步骤,表明固体产物的形成是这两个表面的限速步骤。值得注意的是,Janus CoSTe单层膜两个表面的SRR吉布斯自由能垒整体均低于石墨烯,说明Janus CoSTe单层膜比石墨烯更利于硫还原,可以提高Li-S电池的电化学性能。
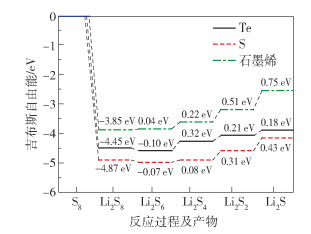
|
图 8 Janus CoSTe单层膜S、Te表面及石墨烯表面的SRR吉布斯自由能分布 Fig.8 SRR Gibbs free energy distributions for S and Te surfaces of a Janus CoSTe monolayer and a graphene surface |
构建了Janus过渡金属硫属化物CoSTe单层膜的热力学稳定结构,通过第一性原理计算了Li2Sn团簇在其表面的吸附、扩散、迁移及膜的电子结构等。分析了S8和Li2Sn团簇在CoSTe单层膜上的吸附、解离和扩散机理,以探究该单层膜在Li-S电池中的应用潜力。结果表明:(1)Li2Sn团簇在CoSTe单层膜上的吸附能在0.88~2.85 eV,属于中等吸附能范围,优于有机电解质和石墨烯;(2)吸附在CoSTe单层膜两表面上的Li2Sn团簇环状结构的吸附分解能为正值,表明可以避免其分解并溶解到电解质中;(3)CoSTe单层膜对Li2S分解的能垒分别为0.67 eV和0.74 eV,明显低于石墨烯的1.81 eV;(4)Li2Sn团簇在CoSTe单层膜表面扩散路径有其微观上的“通道”,而Li原子在CoSTe单层膜不同表面上的扩散较自由;(5)CoSTe单层膜的金属特性在吸附Li2Sn团簇后可以很好地得到保持,优良的导电性能够确保其作为电极材料具有优异的电化学性能;(6)CoSTe单层膜两表面上的硫还原反应能垒均低于石墨烯,这在放电过程中会加速表面Li2S的形成,且CoSTe单层膜两表面的最大还原反应能垒分别处于不同的反应步骤,这更利于还原反应的顺利进行。总体而言,Janus CoSTe单层膜有成为高性能Li-S电池的优秀锚定材料的潜质。
| [1] |
EFTEKHARI A, KIM D W. Cathode materials for lithium-sulfur batteries: a practical perspective[J]. Journal of Materials Chemistry A, 2017, 5(34): 17734-17776. DOI:10.1039/C7TA00799J |
| [2] |
WILD M, O'NEILL L, ZAHNG T, et al. Lithium sulfur batteries, a mechanistic review[J]. Energy & Environmental Science, 2015, 8(12): 3477-3494. |
| [3] |
MANTHIRAM A, FU Y Z, CHUNG S H, et al. Rechargeable lithium-sulfur batteries[J]. Chemical Reviews, 2014, 114(23): 11751-11787. DOI:10.1021/cr500062v |
| [4] |
LV X S, WEI W, YANG H C, et al. Group IV monochalcogenides MX (M=Ge, Sn; X=S, Se) as chemical anchors of polysulfides for lithium-sulfur batteries[J]. Chemistry—A European Journal, 2018, 24(43): 11193-11199. DOI:10.1002/chem.201801925 |
| [5] |
ZHANG Q F, WANG Y P, SEH Z W, et al. Understanding the anchoring effect of two-dimensional layered materials for lithium-sulfur batteries[J]. Nano Letters, 2015, 15(6): 3780-3786. DOI:10.1021/acs.nanolett.5b00367 |
| [6] |
JI X L, NAZAR L F. Advances in L i-S batteries[J]. Journal of Materials Chemistry, 2010, 20(44): 9821-9826. DOI:10.1039/b925751a |
| [7] |
MACFARLANE D R, FORSYTH M, HOWLETT P C, et al. Ionic liquids and their solid-state analogues as materials for energy generation and storage[J]. Nature Reviews Materials, 2016, 1: 15005. DOI:10.1038/natrevmats.2015.5 |
| [8] |
PENG H J, HUANG J Q, ZHANG Q. A review of flexible lithium-sulfur and analogous alkali metal-chalcogen rechargeable batteries[J]. Chemical Society Reviews, 2017, 46(17): 5237-5288. DOI:10.1039/C7CS00139H |
| [9] |
ZHONG Y, XIA X H, DENG S J, et al. Popcorn inspired porous macrocellular carbon: rapid puffing fabrication from rice and its applications in lithium-sulfur batteries[J]. Advanced Energy Materials, 2018, 8(1): 1701110. DOI:10.1002/aenm.201701110 |
| [10] |
CHEN K N, CAO J, LU Q Q, et al. Sulfur nanoparticles encapsulated in reduced graphene oxide nanotubes for flexible lithium-sulfur batteries[J]. Nano Research, 2018, 11(3): 1345-1357. DOI:10.1007/s12274-017-1749-2 |
| [11] |
YUAN Z, PENG H J, HUANG J Q, et al. Hierarchical free-standing carbon-nanotube paper electrodes with ultrahigh sulfur-loading for lithium-sulfur batteries[J]. Advanced Functional Materials, 2014, 24(39): 6105-6112. DOI:10.1002/adfm.201401501 |
| [12] |
PEI F, AN T H, ZANG J, et al. From hollow carbon spheres to N-doped hollow porous carbon bowls: rational design of hollow carbon host for L i-S batteries[J]. Advanced Energy Materials, 2016, 6(8): 1502539. DOI:10.1002/aenm.201502539 |
| [13] |
CHANG Z, DING B, DOU H, et al. Hierarchically porous multilayered carbon barriers for high-performance L i-S batteries[J]. Chemistry—A European Journal, 2018, 24(15): 3768-3775. DOI:10.1002/chem.201704757 |
| [14] |
LI J, GUO J Q, DENG J N, et al. Enhanced electrochemical performance of lithium-sulfur batteries by using mesoporous TiO2 spheres as host materials for sulfur impregnation[J]. Materials Letters, 2017, 189: 188-191. DOI:10.1016/j.matlet.2016.12.012 |
| [15] |
ZHANG Y, WANG L Z, ZHANG A Q, et al. Novel V2O5/S composite cathode material for the advanced secondary lithium batteries[J]. Solid State Ionics, 2010, 181(17-18): 835-838. DOI:10.1016/j.ssi.2010.04.010 |
| [16] |
FABER M S, LUKOWSKI M A, DING Q, et al. Earth-abundant metal pyrites (FeS2, CoS2, NiS2, and their alloys) for highly efficient hydrogen evolution and polysulfide reduction electrocatalysis[J]. The Journal of Physical Chemistry C, 2014, 118(37): 21347-21356. DOI:10.1021/jp506288w |
| [17] |
LI H, WEN X Z, SHAO F, et al. Interlayer-expanded MoS2 vertically anchored on graphene via C—O—S bonds for superior sodium-ion batteries[J]. Journal of Alloys and Compounds, 2021, 877: 160280. DOI:10.1016/j.jallcom.2021.160280 |
| [18] |
ZHANG J, JIA S, KHOLMANOV I, et al. Janus monolayer transition-metal dichalcogenides[J]. ACS Nano, 2017, 11(8): 8192-8198. DOI:10.1021/acsnano.7b03186 |
| [19] |
CAI H F, GUO Y F, GAO H J, et al. Tribo-piezoelectricity in Janus transition metal dichalcogenide bilayers: a first-principles study[J]. Nano Energy, 2019, 56: 33-39. DOI:10.1016/j.nanoen.2018.11.027 |
| [20] |
WANG J, SHU H B, ZHAO T F, et al. Intriguing electronic and optical properties of two-dimensional Janus transition metal dichalcogenides[J]. Physical Chemistry Chemical Physics, 2018, 20(27): 18571-18578. DOI:10.1039/C8CP02612B |
| [21] |
XU Y G, OU X D, ZHANG X W. Theoretical study of two-dimensional α-tellurene with pseudo-heterospecies as a promising elemental anchoring material for lithium-sulfur batteries[J]. The Journal of Physical Chemistry C, 2021, 125(8): 4623-4631. DOI:10.1021/acs.jpcc.0c11235 |
| [22] |
MUHAMMAD I D, AWANG M, MAMAT O, et al. First-principles calculations of the structural, mechanical and thermodynamics properties of cubic zirconia[J]. World Journal of Nano Science and Engineering, 2014, 4(2): 97-103. DOI:10.4236/wjnse.2014.42013 |
| [23] |
PERDEW J P, BURKE K, ERNZERHOF M. Generalized gradient approximation made simple[J]. Physical Review Letters, 1996, 77(18): 3865-3868. DOI:10.1103/PhysRevLett.77.3865 |
| [24] |
JIA X F, HOU Q Y, XU Z C, et al. Effect of Ce doping on the magnetic and optical properties of ZnO by the first principle[J]. Journal of Magnetism and Magnetic Materials, 2018, 465: 128-135. DOI:10.1016/j.jmmm.2018.05.037 |
| [25] |
FISCHER T H, ALMLÖF J. General methods for geometry and wave function optimization[J]. The Journal of Physical Chemistry, 1992, 96(24): 9768-9774. DOI:10.1021/j100203a036 |
| [26] |
ZHOU T H, LV W, LI J, et al. Twinborn TiO2-TiN heterostructures enabling smooth trapping-diffusion-conversion of polysulfides towards ultralong life lithium-sulfur batteries[J]. Energy & Environmental Science, 2017, 10(7): 1694-1703. |
| [27] |
GRIMME S, ANTONY J, EHRLICH S, et al. A consistent and accurate ab initio parametrization of density functional dispersion correction (DF T-D) for the 94 elements H-Pu[J]. The Journal of Chemical Physics, 2010, 132(15): 154104. DOI:10.1063/1.3382344 |
| [28] |
ZHANG H N, WANG S H, WANG Y Y, et al. Borophosphene: a potential anchoring material for lithium-sulfur batteries[J]. Applied Surface Science, 2021, 562: 150157. DOI:10.1016/j.apsusc.2021.150157 |
| [29] |
WU W A, ZHANG Y M, GUO Y H, et al. Exploring anchoring performance of InP3 monolayer for lithium-sulfur batteries: a first-principles study[J]. Applied Surface Science, 2020, 526: 146717. DOI:10.1016/j.apsusc.2020.146717 |
| [30] |
ZHOU G M, TIAN H Z, JIN Y, et al. Catalytic oxidation of Li2S on the surface of metal sulfides for L i-S batteries[J]. Proceedings of the National Academy of Sciences, 2017, 114(5): 840-845. DOI:10.1073/pnas.1615837114 |
| [31] |
OLSEN R A, KROES G J, HENKELMAN G, et al. Comparison of methods for finding saddle points without knowledge of the final states[J]. The Journal of Chemical Physics, 2004, 121(20): 9776-9792. DOI:10.1063/1.1809574 |
| [32] |
DU Z Z, CHEN X J, HU W, et al. Cobalt in nitrogen-doped graphene as single-atom catalyst for high-sulfur content lithium-sulfur batteries[J]. Journal of the American Chemical Society, 2019, 141(9): 3977-3985. DOI:10.1021/jacs.8b12973 |







