2. 北京化工大学 图书馆,北京 100029
2. Library of Beijing University of Chemical Technology, Beijing 100029, China
生物乙醇作为一种可再生的液体清洁能源,近年来受到广泛关注。相对于太阳能、水能、风能等其他可再生能源,生物乙醇可以直接与汽油混合作为汽车液体能源使用,这对缓解石油资源紧张、减少燃烧过程中污染物(碳氢化合物、一氧化碳、氮氧化物等)的排放具有重要意义[1]。然而,生物乙醇的大规模生产在近年的工业实践中遇到了各种各样的问题,例如以美国为代表的“玉米乙醇”、以巴西为代表的“甘蔗乙醇”存在“与人争粮、与粮争地”的问题,因此生物乙醇的生产在全球粮食安全堪忧的背景下缺乏发展的动力。纤维素燃料乙醇以资源丰富的秸秆、甘蔗渣和木屑等为原料进行生产可以避免上述问题,但是较低的乙醇产量以及较高的经济和环境成本迫使人们理性地看待其大规模发展[2]。
由于目前粮食与木质纤维素在能源化利用过程中存在诸多问题,人们开始寻找其替代原料。海藻是可以通过光合作用产生能量的自养型海洋生物,目前部分海藻可进行人工养殖。海藻养殖不占用陆地资源,不存在“与粮争地”的问题;海藻中的糖可通过简单处理而释放,预处理成本较纤维素原料低;海藻生长迅速,通过光合作用固定二氧化碳,可有效减轻温室效应,抑制海水酸化[3]。海藻资源的乙醇能源化应用不仅能够规避传统生物乙醇生产的不足,而且还可以带动我国海域藻类养殖产业及海洋生物能源产业的发展。
大型海藻中,褐藻可以作为发酵产乙醇较理想的原料,原因在于:褐藻在人工养殖中的生物量大,技术成熟;糖含量高(至少50%(基于褐藻干重)),预处理方法简单。但是,目前以褐藻为原料生产生物乙醇存在较大的困难。褐藻中的糖大部分为海藻酸,它是糖醛酸二聚合物的线性高聚物,由β-D-甘露糖醛酸(β-D-mannuronic acid,简称M)和α-L-古洛糖醛酸(α-L-guluronic acid,简称G)单元通过α-1, 4-糖苷键连接而成,由于海藻酸含有羧基,因此常以海藻酸盐的形式存在。目前广泛使用的产乙醇工业微生物,例如酿酒酵母(Saccharomyces cerevisiae)、管囊酵母(Pachysolen tannophilus)和运动发酵单胞菌(Zymomonas mobilis)等,既不能利用海藻酸也不能同化其降解产物,这个问题成为制约利用褐藻进行乙醇工业化生产的主要技术瓶颈。
天然酵母菌中,季也蒙酵母(Meyerozyma guilliermondii)可以利用海藻酸进行发酵生成乙醇,在发酵温度30 ℃、发酵时间96 h、初始pH为5的条件下,乙醇产率可达0.154 g/g[4]。季也蒙酵母属于兼性厌氧微生物,其发酵条件与传统的酿酒酵母相似,在工业应用上具有稳定性和易操作性[5]。相较于其他海藻酸天然发酵菌[6-7],季也蒙酵母具有一定的优势:具有较高的乙醇产率和较低的发酵能耗;所采用的厌氧发酵过程不需要改变原有的乙醇发酵工艺。Wargacki等[8]报道,以海带为底物时,季也蒙酵母与基因工程菌(转基因大肠杆菌(transgenic Escherichia coli))的乙醇发酵产率十分接近。Sudhakar等[9]也证实利用季也蒙酵母发酵冬青叶马尾藻(Sargassum ilicifolium)生产乙醇时,相较于其他常规酵母(如酿酒酵母),其乙醇产率更高。由此可见,这种新型的海藻酸发酵天然酵母菌具有较好的应用潜力,经过优化和处理后,乙醇得率会有更大的提升,有可能成为海藻工业化生产乙醇的优良菌种。
季也蒙酵母作为一种非常规酵母菌,具有广泛碳源(如各种糖类、脂肪酸,甚至烷烃)的代谢能力,可以生成醇类、有机酸等各种产物,但是其代谢机理目前并未完全清晰[10]。有研究[11-12]证实,季也蒙酵母可以产生多种酶,如淀粉酶、乙醇脱氢酶、鼠李糖苷酶、菊糖酶等,其碳源代谢过程中的具体代谢路径也有多种,如EMP途径(Embden-Meyerhof-Parnas pathway)、戊糖磷酸途径(pentose phosphate pathway)、莽草酸途径(shikimate pathway)、三羧酸循环(tricarboxylic acid cycle)等。本课题组在之前的研究[5]中证实,在发酵海藻酸生成乙醇的过程中季也蒙酵母能同时产生海藻酸裂解酶和乙醇脱氢酶。然而,其利用海藻酸生成乙醇的代谢机理尚未探明,能源物质形成和积累的机制还有待研究,尤其是影响乙醇产率的关键代谢步骤尚不明确。因此,本文考察了不同碳源对季也蒙酵母发酵生产乙醇的影响,监测了乙醇发酵过程中重要中间代谢产物含量的动态变化,提出了天然酵母菌转化海藻酸生成乙醇的代谢途径并进行了初步验证,以期为利用褐藻生产生物乙醇提供理论依据。
1 实验部分 1.1 实验材料与仪器季也蒙酵母,实验室保存;甘露糖醛酸标准品(纯度≥98%)、古洛糖醛酸标准品(纯度≥97%)、乙醇标准品(纯度≥99.9%)、丙酮酸标准品(纯度98%)、3-磷酸甘油醛标准品(纯度≥97%)、乙醛标准品(纯度≥99%),Sigma公司;海藻酸钠、硫酸铵、磷酸二氢钾、硫酸镁、丙酮酸、甘露糖醛酸、古洛糖醛酸、乙醛、浓硫酸、碳酸钡、乙二胺四乙酸(EDTA),均为分析纯,国药集团化学试剂有限公司;超纯水,由Mill i- Q IQ 7000型纯水机(德国默克密理博公司)制备。
活化培养基:硫酸铵10.8 g/L,磷酸二氢钾5.0 g/L,硫酸镁1.1 g/L,海藻酸钠10 g/L;发酵培养基:硫酸铵10.8 g/L,磷酸二氢钾5.0 g/L,硫酸镁1.1 g/L,不同碳源,调节pH=5。
高效液相色谱仪(L C- 10ADVP型)、气相色谱仪(GC17A型),日本岛津公司;恒温摇床(IS F- 7100型), 韩国杰奥特公司。
1.2 天然酵母菌的可代谢底物检测 1.2.1 海藻酸钠的多级高温酸解称取2.0 g海藻酸钠(精确至0.000 1 g),加入20 mL 70%的浓硫酸,混合均匀后在研钵中研磨,然后加入蒸馏水250 mL,在沸水浴中加热,于不同时间(0.5~3 h)取样,分析酸解产物。
1.2.2 酸解产物分析[13]将上述海藻酸钠的多级高温酸解产物冷却至室温,用碳酸钡调节pH至7左右,离心,沉淀,用蒸馏水洗涤3次。合并上清液与洗涤液,浓缩,经DOWEX 1- X8型阴离子交换树脂柱层析,用1 mol/L乙酸溶液以2 mL/min的速度进行洗脱。收集洗脱液,浓缩,定容至5 mL,使用高效液相色谱仪测定古洛糖醛酸和甘露糖醛酸的含量。色谱柱为Agilent zorbax sax阴离子交换柱,柱温40 ℃,流动相为0.5 mol/L乙酸,流速1.0 mL/min。另外用梯度浓度的标准品进样,绘制标准曲线,得到如下线性回归方程,以此计算古洛糖醛酸和甘露糖醛酸的浓度。
| $ 古洛糖醛酸:Y=67\;882X-10\;456 \\ 甘露糖醛酸:Y=40\;125X-4\;356 $ |
式中:Y为色谱峰面积;X为古洛糖醛酸或甘露糖醛酸的质量浓度,mg/mL。按照下式计算古洛糖醛酸和甘露糖醛酸的含量。
| $ c = \frac{{5\rho N}}{{{m_{\rm{a}}}}} \times 100\% $ |
式中:c为古洛糖醛酸或甘露糖醛酸的含量,ρ为古洛糖醛酸或甘露糖醛酸的质量浓度,N为稀释倍数,ma为海藻酸钠的质量。
1.3 不同底物的发酵试验分别以海藻酸钠的多级酸解产物、甘露糖醛酸、古洛糖醛酸、丙酮酸、乙醛为碳源,配制发酵培养基100 mL(碳源的质量浓度为10 g/L),若出现生长抑制,则调节丙酮酸和乙醛的浓度。将季也蒙酵母菌从固体培养基中转移至液体活化培养基中,于30 ℃、160 r/min下培养48 h,然后以10%(体积分数)的接种量将菌种转接至发酵培养基中。将装有发酵培养基的锥形瓶(在棉塞外用保鲜膜密封瓶口)放置在恒温摇床中,于30 ℃、160 r/min下进行发酵。
利用气相色谱法测定乙醇浓度。色谱柱为SGE A C- 10型气相毛细管柱,柱温180 ℃,检测器温度180 ℃,气化室温度180 ℃,载气氢气流量30 mL/min。另外用梯度浓度的标准品进样,绘制标准曲线,得到如下线性回归方程,以此计算乙醇浓度。
| $ Y=1.056\;1X-0.634\;2 $ |
式中:X为乙醇的质量浓度,mg/L。按照下式计算乙醇产率。
| $ y = {\rho _{\rm{e}}}{V_{\rm{f}}}/{m_{\rm{c}}} $ |
式中:y为乙醇产率,ρe为乙醇的质量浓度,Vf为发酵液体积,mc为碳源质量。
1.4 海藻酸发酵生产乙醇过程中间代谢产物含量测定以海藻酸钠为碳源配制发酵培养基,接种菌种,进行发酵。将发酵液离心,倒掉上层液,水洗后收集干净菌体,采用常规的高氯酸提取法(高氯酸的浓度为0.5 mol/L)对酵母细胞中的代谢物进行提取,然后利用高效液相色谱法测定不同时间(6~108 h)的代谢物的含量变化。色谱柱为H i- Plex H型液相柱,柱温50 ℃,以水和乙腈为流动相进行梯度洗脱,流速0.6 mL/min。另外用梯度浓度的标准品进样,绘制标准曲线,得到如下线性回归方程,以此计算有机物的浓度变化。
| $ 丙酮酸:Y=6\;179.3X-978.6 \\3-磷酸甘油醛:Y=1\;029.1X-314.2 $ |
式中:X为丙酮酸或3-磷酸甘油醛的浓度,mmol/L。然后将浓度单位换算为mg/L。
利用不分流进样气相色谱法测定不同时间的发酵液中乙醛的浓度。色谱柱为SGE A C- 10型气相毛细管柱,进样口温度150 ℃,载气流速5 mL/min,检测温度50 ℃,氢气流量40.0 mL/min,空气流量400.0 mL/min;升温程序:起始温度40 ℃,以10 ℃/min的速度升温至80 ℃,保持5 min,然后以10 ℃/min的速度升温至150 ℃,保持5 min。另外用梯度浓度的标准品进样,绘制标准曲线,得到如下线性回归方程,以此计算乙醛浓度。
| $ Y=0.131\;2X-0.299\;8 $ |
式中:X为乙醛的质量浓度,mg/L。
1.5 酵母细胞生物量测定利用细胞干重法测定不同发酵时间的酵母细胞生物量。吸取待测培养液放入离心管中,反复离心,用清水洗涤3次。于80 ℃真空干燥,称重,按照下式计算酵母细胞生物量。
| $ C=m/V $ |
式中:C为酵母细胞生物量,m为细胞质量,V为取样体积。
1.6 天然酵母菌转化海藻酸生成乙醇的代谢途径模型验证通过在发酵培养基中添加或减少特殊物质进行发酵试验,判断其对细胞生长及乙醇产率的影响。在发酵液中加入EDTA(0~1 mmol/L),或者改变发酵液中硫酸镁的质量浓度(0.2~1.2 g/L),其他试验条件不变,发酵时间为96 h, 测定乙醇产率和酵母细胞生物量。
2 结果与讨论 2.1 天然酵母菌的可代谢底物测定及发酵试验结果为了研究海藻酸在季也蒙酵母体内的代谢途径,首先应明确季也蒙酵母可以进行代谢的海藻酸前体物类型。本文制备了海藻酸在不同时间的酸解产物,测定其中甘露糖醛酸M和古洛糖醛酸G的含量,结果如图 1所示。随着酸解时间的延长,两种糖醛酸单体M和G的含量均升高,表明在不同降解时间下海藻酸的裂解程度不同,并且在酸解过程中会产生寡聚海藻酸,这与Lee等[6]的研究结果类似。
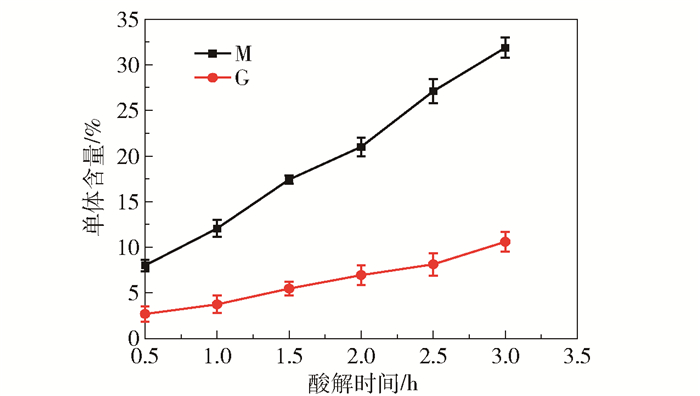
|
图 1 不同时间下海藻酸钠酸解生成的M和G单体的含量 Fig.1 Contents of M and G monomers generated by acid hydrolysis of sodium alginate at different times |
分别以海藻酸钠在不同时间的酸解产物、M单体、G单体为碳源进行发酵,测定乙醇产率,结果如图 2所示。以M和G单体为碳源时,乙醇产率较高,表明季也蒙酵母可以直接利用这两种单体进行乙醇发酵。还可以看出,并非酸水解的时间越长,乙醇产率越高。依据本课题组之前的研究[5],季也蒙酵母能够产生胞外海藻酸裂解酶,可以对海藻酸进行分解。由于海藻酸裂解酶的作用特异性,会生成在C4和C5之间形成双键的不饱和产物[14],这种非还原性末端含有不饱和双键的结构或许更容易被利用。
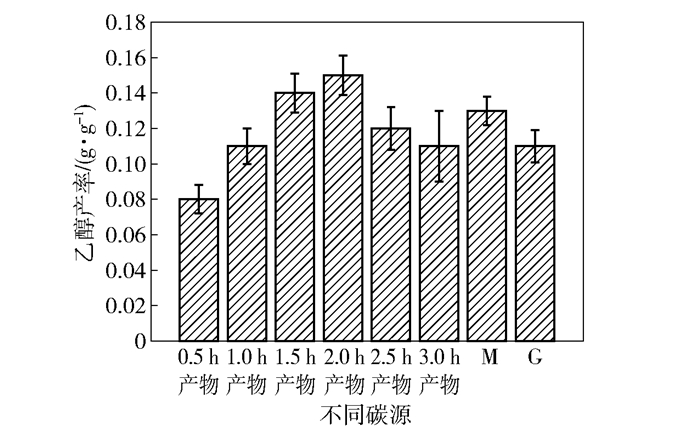
|
图 2 季也蒙酵母利用不同碳源进行发酵的乙醇产率 Fig.2 Ethanol yield of M. guilliermondii fermented with different carbon sources |
此外,本文还测定了以10 g/L丙酮酸和乙醛为碳源的乙醇产率,发现此时基本不产乙醇,这是因为10 g/L丙酮酸和乙醛对季也蒙酵母的生长产生了较强的抑制作用。因此本文降低了二者的浓度再次进行试验,结果表明:当丙酮酸的质量浓度降至4.5 g/L时,乙醇产率仅为0.031 g/g;当乙醛的质量浓度降至1.5 g/L时,乙醇产率为0.042 g/g。结果说明直接以这两种中间代谢产物为碳源,会导致糖的代谢前端产物缺乏,由于细胞中没有产生足够的还原型辅酶Ⅰ(NADH),因此乙醛无法作为电子受体大量转化为乙醇。
2.2 海藻酸发酵生产乙醇过程中重要中间代谢产物含量的动态变化通过化学分析手段对海藻酸代谢产生的中间产物进行检测,了解其含量的动态变化规律,以分析季也蒙酵母的海藻酸代谢路径。
2.2.1 丙酮酸浓度和3-磷酸甘油醛浓度的动态变化图 3为酵母细胞中中间代谢产物(丙酮酸和3-磷酸甘油醛)的质量浓度和酵母细胞生物量随时间的变化。丙酮酸是多种酵母菌在乙醇发酵过程中的重要中间体,也是许多其他代谢产物如乳酸、柠檬酸等有机酸的前体物质。在乙醇发酵过程中,细胞中的丙酮酸浓度与发酵菌种、发酵条件及外源添加物有关。可以看出,随着发酵的进行,丙酮酸的质量浓度先升高后降低,其变化规律与酵母细胞生物量相似,并且丙酮酸质量浓度的峰值出现在酵母的对数生长期和稳定生长期之间,说明丙酮酸的质量浓度与酵母活性相关。
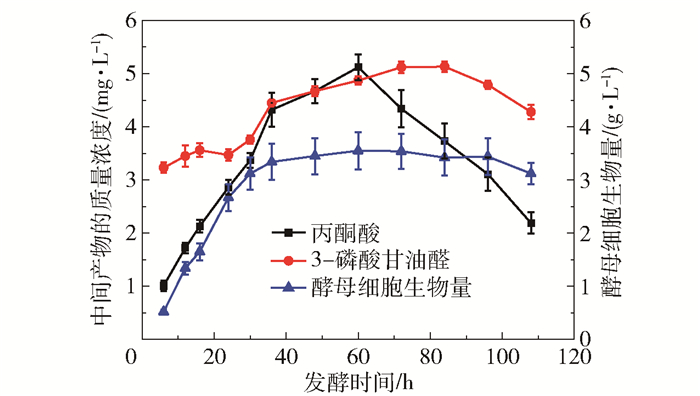
|
图 3 酵母细胞中中间代谢产物(丙酮酸和3-磷酸甘油醛) 的质量浓度及酵母细胞生物量的动态变化 Fig.3 Dynamic changes of the mass concentration of intermediate metabolites (pyruvic acid and glyceraldehyde 3-phosphate) in yeast cells and the yeast cell biomass |
3-磷酸甘油醛是生物体内糖原或淀粉酵解过程中的重要中间产物,可由糖磷酸化及异构化的产物磷酸果糖裂解产生,3-磷酸甘油醛可以与磷酸二羟丙酮在磷酸丙酮异构酶的催化下相互转变,且后续可在3-磷酸甘油醛脱氢酶的作用下生成1, 3-二磷酸甘油酸,并最终由烯醇化酶和丙酮酸激酶催化反应形成丙酮酸。由图 3可以看出,作为生成丙酮酸的前体物质,3-磷酸甘油醛在酵母细胞中的质量浓度变化规律与丙酮酸较为接近。但相较于丙酮酸,3-磷酸甘油醛的质量浓度变化较小,保持较为稳定的状态,原因可能是3-磷酸甘油醛的转化过程始终处于平衡状态。
2.2.2 发酵液中乙醛浓度的动态变化乙醛是乙醇发酵过程中的一种中间产物,它是由丙酮酸在丙酮酸脱羧酶的作用下产生的,同时又会在乙醇脱氢酶的催化作用下转化为乙醇,因此它的浓度积累与最终的乙醇发酵效率密切相关。由于乙醛的分子量较小,它可以通过自由扩散的方式穿过细胞膜,因此本研究中检测的是发酵液中乙醛的浓度,结果如图 4所示。在发酵过程中,乙醛的质量浓度呈现先增大后减小的趋势:在发酵初期,随着酵母菌的繁殖,乙醛的质量浓度迅速升高;随后酵母菌生长进入平稳期,乙醛的质量浓度逐渐降低直到发酵末期。
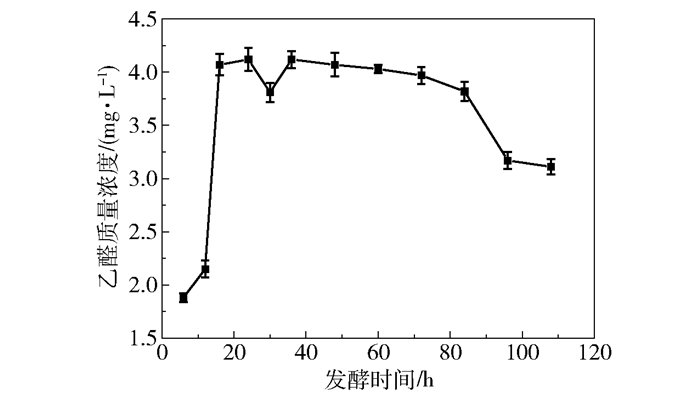
|
图 4 发酵液中乙醛质量浓度的动态变化 Fig.4 Dynamic changes of acetaldehyde mass concentration in the fermentation broth |
此外,本文还检测了发酵过程中产生的其他一些常见的有机物,如甘油、甲酸、乳酸、乙酸等,但均未能检出,原因可能是:这些物质的浓度较低,低于检测限;其代谢速度较快,未能积累;在海藻酸向乙醇的代谢过程中未产生。
2.3 海藻酸代谢途径模型建立及初步验证根据本文的研究结果,同时结合本课题组的前期研究[5],对海藻酸的代谢途径进行了推测,结果如图 5所示。海藻酸代谢过程的基本途径为:天然酵母菌产生胞外海藻酸裂解酶,将海藻酸裂解成寡聚海藻酸,随后其进一步降解为低聚体;进入酵母菌细胞后,低聚体转化为糖醛酸单体等前体物质,随后转化为3-磷酸甘油醛、丙酮酸等中间产物,然后在丙酮酸脱羧酶及乙醇脱氢酶的作用下,最终生成乙醇。其中,海藻酸裂解和丙酮酸脱羧是海藻酸代谢过程的关键步骤。本文所推测的天然酵母菌的海藻酸代谢途径与文献[8]报道的转基因大肠杆菌的研究结果较为接近,即在碳源进入细胞前,都是通过海藻酸裂解酶的作用实现海藻酸的裂解。但该基因工程菌的胞内糖代谢过程明确为部分细菌体内进行乙醇代谢的Entner-Doudoroff(ED)途径。ED途径是存在于缺乏完整EMP途径的微生物(主要是细菌)中的一种替代途径,而季也蒙酵母可进行完整的EMP途径代谢[12],因此推测酵母菌体内的糖代谢过程与该基因工程菌不同,可能为EMP途径或者部分ED、部分EMP途径,这一点在今后的研究中还需要进一步验证。
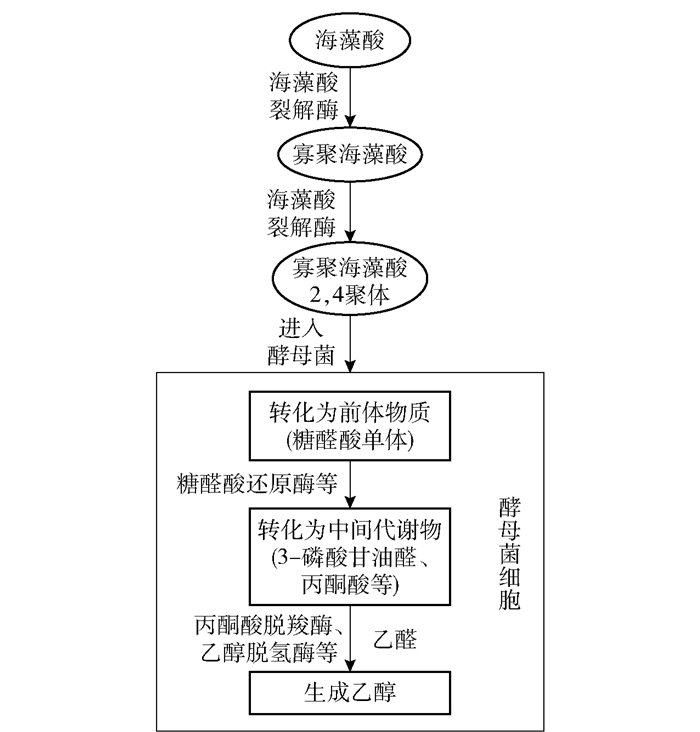
|
图 5 海藻酸代谢途径模型 Fig.5 Metabolic pathway model for alginate |
为了验证上述海藻酸的代谢过程,本文进行了EDTA添加试验和镁离子浓度控制试验,结果分别如图 6和图 7所示。由图 6可以看出,随着体系中EDTA浓度的增加,乙醇产率和酵母细胞生物量均明显降低。当EDTA的浓度为1 mmol/L时,与不添加EDTA的体系相比,发酵96 h的酵母细胞生物量减少了46.7%,乙醇产率降低了61%。EDTA的添加可影响体系中还原糖的浓度,延缓微生物的生长,降低乙醇发酵产率。而本课题组的前期实验证实EDTA还能够降低海藻酸裂解酶的酶活力[15],这可能是EDTA的添加影响酵母菌利用海藻酸代谢生成乙醇的主要原因。由图 7可以看出,镁离子浓度也影响乙醇发酵过程,随着镁离子质量浓度的增加,乙醇产率和酵母细胞生成量均增加。镁离子是酵母菌胞内的酶(如丙酮酸脱羧酶等)的重要辅助因子,在海藻酸代谢生成乙醇的过程中,这些酶也可能发挥重要作用。在发酵过程中,可以通过调节镁离子浓度来提高酵母的活性,促进酵母对糖的吸收和利用,从而增加乙醇产率和酵母细胞生成量。
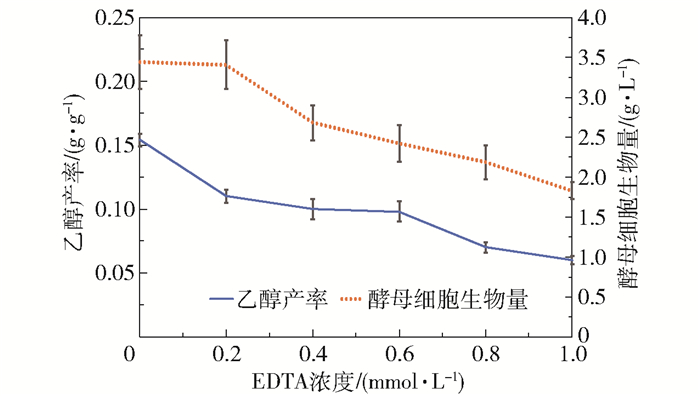
|
图 6 EDTA对海藻酸发酵生产乙醇的影响 Fig.6 Effect of EDTA on ethanol production by alginate fermentation |
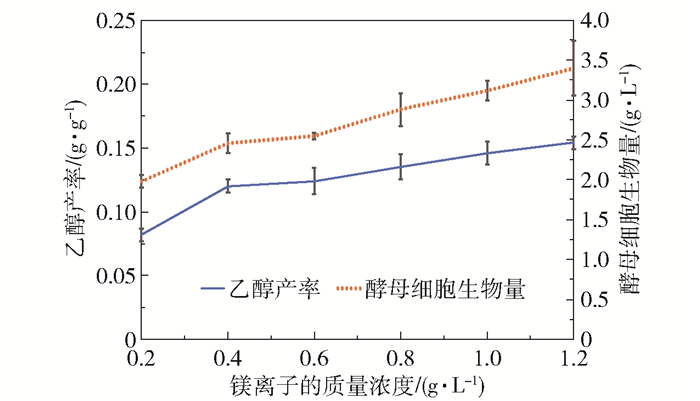
|
图 7 镁离子对海藻酸发酵生产乙醇的影响 Fig.7 Effect of Mg2+ on ethanol production by alginate fermentation |
通过测定季也蒙酵母的可代谢前体物对发酵生产乙醇的影响以及关键中间产物的动态变化,建立了酵母菌代谢海藻酸生成乙醇的路径模型并进行了初步实验验证,推测海藻酸的代谢途径为:酵母菌产生胞外海藻酸裂解酶,将海藻酸裂解为寡聚海藻酸,随后进一步降解为低聚体;进入酵母菌细胞后,低聚体转化为糖醛酸单体等前体物质,随后转化为3-磷酸甘油醛、丙酮酸等中间产物,然后在丙酮酸脱羧酶及乙醇脱氢酶的作用下,最终生成乙醇。由于海藻酸的代谢过程非常复杂,其涉及的各级产物及调控环节远未明确,因此本研究仍然存在局限。今后将进一步细化各相关中间步骤的研究,并重点分析“环境- 底物- 菌”之间的相互作用,以期能够设计出适用于工业化生产的技术路线。
| [1] |
郭振强, 张勇, 曹运齐, 等. 燃料乙醇发酵技术研究进展[J]. 生物技术通报, 2020, 36(1): 238-244. GUO Z Q, ZHANG Y, CAO Y Q, et al. Research progress of fuel ethanol fermentation technology[J]. Biotechnology Bulletin, 2020, 36(1): 238-244. (in Chinese) |
| [2] |
SUDHAKAR K, MAMAT R, SAMYKANO M, et al. An overview of marine macroalgae as bioresource[J]. Renewable and Sustainable Energy Reviews, 2018, 91: 165-179. DOI:10.1016/j.rser.2018.03.100 |
| [3] |
ALFONSÍN V, MACEIRAS R, GUTIÉRREZ C. Bioethanol production from industrial algae waste[J]. Waste Management, 2019, 87: 791-797. DOI:10.1016/j.wasman.2019.03.019 |
| [4] |
ZHANG W, ZHANG J, CUI H. The isolation and performance studies of an alginate degrading and ethanol producing strain[J]. Chemical and Biochemical Engineering Quarterly, 2014, 28(3): 391-398. DOI:10.15255/CABEQ.2013.1888 |
| [5] |
ZHANG W, XIA X, ZHANG Z. Alginate lyase of a novel algae fermentation strain[J]. Chemical and Biochemical Engineering Quarterly, 2019, 33(1): 125-131. DOI:10.15255/CABEQ.2018.1291 |
| [6] |
LEE S M, LEE J H. Ethanol fermentation for main sugar components of brown-algae using various yeasts[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(1): 16-18. DOI:10.1016/j.jiec.2011.11.097 |
| [7] |
JI S Q, WANG B, LU M, et al. Direct bioconversion of brown algae into ethanol by thermophilic bacterium Defluviitalea phaphyphila[J]. Biotechnology for Biofuels, 2016, 9: 81. DOI:10.1186/s13068-016-0494-1 |
| [8] |
WARGACKI A J, LEONARD E, WIN M N, et al. An engineered microbial platform for direct biofuel production from brown macroalgae[J]. Science, 2012, 335(6066): 308-313. DOI:10.1126/science.1214547 |
| [9] |
SUDHAKAR M P, JEGATHEESAN A, POONAM C, et al. Biosaccharification and ethanol production from spent seaweed biomass using marine bacteria and yeast[J]. Renewable Energy, 2017, 105: 133-139. DOI:10.1016/j.renene.2016.12.055 |
| [10] |
YAN W, GAO H, QIAN X J, et al. Biotechnological applications of the non-conventional yeast Meyerozyma guilliermondii[J]. Biotechnology Advances, 2021, 46: 107674. DOI:10.1016/j.biotechadv.2020.107674 |
| [11] |
HERMANSYAH H, FACHRIJAL F, MIKSUSANTI M, et al. Xylose and arabinose fermentation to produce ethanol by isolated yeasts from durian (Durio zibethinus L.) fruit[J]. Molekul, 2019, 14(2): 133-139. DOI:10.20884/1.jm.2019.14.2.562 |
| [12] |
LIU G L, FU G Y, CHI Z, et al. Enhanced expression of the codon-optimized exo-inulinase gene from the yeast Meyerozyma guilliermondii in Saccharomyces sp. W0 and bioethanol production from inulin[J]. Applied Microbiology & Biotechnology, 2014, 98: 9129-9138. |
| [13] |
张文婧, 李静梅, 吴颖, 等. 海藻和海藻酸钠中糖醛酸含量的测定[J]. 食品工业科技, 2010, 31(12): 338-340, 343. ZHANG W J, LI J M, WU Y, et al. Quantitative determination of uronic acid in seaweeds and sodium alginate[J]. Science and Technology of Food Industry, 2010, 31(12): 338-340, 343. (in Chinese) |
| [14] |
赵琳, 王乔平, 邰宏博, 等. 海藻酸裂解酶异源表达研究进展[J]. 生命科学研究, 2013, 17(5): 447-451. ZHAO L, WANG Q P, TAI H B, et al. Advances in heterdogous expression of alginate lyase[J]. Life Science Research, 2013, 17(5): 447-451. (in Chinese) |
| [15] |
张雯, 裘雨妮, 周家杰. 以海藻为原料的乙醇发酵过程中关键酶研究[J]. 当代化工研究, 2021(19): 22-24. ZHANG W, QIU Y N, ZHOU J J. Study on key enzymes in ethanol fermentation with seaweed as raw material[J]. Modern Chemical Research, 2021(19): 22-24. (in Chinese) DOI:10.3969/j.issn.1672-8114.2021.19.010 |








