2. 湖北工业大学 工业发酵省部共建协同创新中心,武汉 430068;
3. 湖北工业大学 国家外专局/教育部细胞调控与分子药物“111”引智基地,武汉 430068
2. Cooperative Innovation Center of Industrial Fermentation, Ministry of Education & Hubei Province, Hubei University of Technology, Wuhan 430068, China;
3. National "111" Center for Cellular Regulation and Molecular Pharmaceutics, Hubei University of Technology, Wuhan 430068, China
近年来,疾病的多发使得临床导尿管的使用量逐渐增多,留置导管是医院为患者解决不能自主排尿的主要方案,然而,长期留置导管会导致细菌感染[1]。导管相关性尿路感染(catheter-associated urinary tract infection,CAUTI)是由长期在患者体内留置导管造成的,是医院常见的细菌感染之一,可引起许多医疗并发症,例如导管结痂、膀胱结石、败血症、内毒素休克和肾盂肾炎[2-3]。因此,如何减少和预防CAUTI的发生是临床上亟待解决的问题。造成CAUTI的主要原因为细菌易在导管表面黏附并形成难以清除的生物膜,该过程涉及的主要细菌包括大肠埃希菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)等[4-5]。面对临床的迫切需求,开发具有抗菌效果的导尿管成为科研工作者及医疗保健企业等共同关注的重点。目前,临床上应对CAUTI的主要策略是对导管材料表面进行物理及化学方面的修饰改性(如涂敷抗菌涂层),使其可以将杀菌剂释放到环境中,从而起到持续的抗菌及杀菌效果,这是预防生物膜形成的有效手段之一[6-9]。
近年来,一氧化氮(NO)作为抗菌剂在生物抗菌领域得到广泛应用。NO是一种内皮源性舒张因子,研究发现,其反应副产物如N2O3和ONOO-(过氧亚硝酸盐)可通过氧化和亚硝基化应激,对微生物蛋白质、DNA、代谢酶和外膜结构造成氧化和亚硝基化损伤,从而改变重要的蛋白质功能并诱导细菌细胞死亡,从而根除细菌[10-11]。NO作为杀菌剂已被证明可以对抗广泛的革兰氏阴性菌(如铜绿假单胞菌和大肠杆菌)和革兰氏阳性菌(如金黄色葡萄球菌和表皮葡萄球菌),以及耐药细菌(如耐甲氧西林金黄色葡萄球菌(MRSA))[12-13]。已有研究证明NO释放可以有效防止细菌黏附[14],采用模拟内源性NO释放的聚合物材料抗菌提供了一种潜在的解决医疗器械相关感染的方法。S-亚硝基-N-乙酰青霉胺(SNAP)是一种成本低、安全性高的S-亚硝基硫醇(RSNO)类NO供体,可以分解并释放NO,其中RSNO是一类新兴的内源性和外源性NO供体。当SNAP掺入吸水率非常低的聚合物时,可长期持续释放NO。Wo等[15]制备了一种SNAP掺杂的CarboSil聚合物导管,在生理通量水平上该导管可持续释放NO超过3周,实验结果表明其可以显著降低细菌的生存能力。然而,目前关于SNAP导尿管抗菌性能的研究仍缺乏在大动物模型上的进一步评价。因此,本文制备了可持续释放NO的SNAP导尿管,评价了其在体外及绵羊体内的抗菌性能,以期为SNAP导尿管的临床应用提供参考。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料一次性使用无菌硅胶导尿管,广州维力医疗器械股份有限公司;纳米银抗菌导尿管,美昕医疗器械(上海)有限公司;金黄色葡萄球菌(ATCC6538)、大肠埃希菌(ATCC8739)、铜绿假单胞菌(ATCC9027)、肺炎克雷伯菌(Klebsiella pneumoniae)(ATCC10031),武汉大学中国典型培养物保藏中心;胰酪胨大豆肉汤(TSB)培养基、胰蛋白胨大豆琼脂(TSA)培养基,广东环凯微生物科技有限公司;血管鞘(402-606X),北京迪玛克医药科技有限公司;泌尿道引导丝(1001780-HC),张家港市华美医疗器械有限公司;一次性使用球囊压力泵(SM-ID-A2530H-TB),深圳市昕力医疗设备开发有限公司;Y型阀(DMK-Y)、三通(409511CN)、指引导管(LA6JR40)、丙泊酚,四川国瑞药业有限责任公司;舒泰,北京佑宠生物科技有限公司;异氟烷,友诚生物科技有限公司;0.9%生理盐水,河南科伦药业有限公司;肝素钠注射液,齐鲁制药有限公司;注射用青霉素钠,瑞阳制药有限公司;非吸收性外科缝线,扬州环宇医疗器械有限公司;N-乙酰-D-青霉胺(N-acetyl-D-penicillamine,NAP)、亚硝酸钠(NaNO2),Sigma-Aldrich公司;PBS缓冲液(pH7.2~7.4),Gibco公司;盐酸(HCl)、丙酮、乙醚、四氢呋喃(THF),均为分析纯,国药集团化学试剂北京有限公司;乙二胺四乙酸(EDTA),纯度≥99.5%,北京索莱宝科技有限公司。
雌性绵羊,30~40 kg,来源于浓浓(北京)生物科技有限公司。常温饲养,每笼一只,普通饲料喂养,每只每天供给其体重5%的饲料,自由摄食,自由饮水,每天冲洗清洁羊笼,直至实验结束。实验动物福利与伦理审查预先经湖北工业大学中德生物医学中心生命科学研究伦理审查委员会批准。
1.1.2 实验仪器紫外可见分光光度计(UV-Vis)(UV-752),Shimadzu公司;一氧化氮分析仪(Nitric Oxide Analyzer)(NOA 280i),美国通用电气集团分析仪器公司;恒温培养摇床(ZHWY-1102C),上海智诚分析仪器制造有限公司;离心机(Sorvall Legend Micro 17),Thermo Scientific公司;恒温恒湿培养箱(DNP-9082),上海精宏实验设备有限公司;呼吸麻醉机(ACM608),北京航天长峰公司;呼吸机(SV350)、除颤仪(BeneHert D6),深圳迈瑞生物医疗电子股份有限公司。
1.2 SNAP的合成按照文献[16]的方法合成SNAP。称取0.478 g NAP溶解于8.0 mL水(含有2.5 mL的1.0 mol/L HCl)中,加入0.173 g NaNO2,在5 ℃下搅拌40 min后,用5 mL丙酮处理该溶液并继续搅拌10 min。抽滤除去绿色沉淀物,用冰水洗涤5次,用10 mL丙酮和乙醚的混合溶剂洗涤3次,得到产物SNAP,置于真空干燥箱中干燥。使用紫外可见分光光度计在200~700 nm的范围内记录UV-Vis光谱。
1.3 SNAP导尿管的制备参照文献[17]的方法制备SNAP导管。将SNAP溶解在THF中15 min(SNAP的质量浓度为125 mg/mL),然后将一次性使用无菌硅胶导管在黑暗中完全浸入含有SNAP的THF溶液中2 h。在该溶胀/浸渍期之后,在通风橱中将导管在黑暗环境下干燥72 h以去除残留溶剂,得到SNAP导尿管。
1.4 NO释放量测定将SNAP导管剪成长度为1 cm的小段,将导管段放置在琥珀色玻璃瓶中,瓶内装有4 mL PBS缓冲液(pH 7.4)和100 μmol/L EDTA(浸入37 ℃水浴中),使用一氧化氮分析仪测定SNAP导管的NO释放量。NO持续产生后,立即被N2扫气和鼓泡器净化并扫入化学发光检测室。在测定NO释放量期间,将所有导管置于新鲜的PBS缓冲液中,并且在每次测量后在没有环境光的条件下于37 ℃孵育。
1.5 体外抗菌性能评价 1.5.1 菌液制备将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、肺炎克雷伯菌加入TSB培养基中振荡培养,在(37±2)℃的条件下培养至其菌液的OD600(600 nm波长下的吸光度值)为0.45左右,此时菌液浓度通常为106~107 cfu/mL,各试验菌种的浓度如表 1所示。
| 下载CSV 表 1 受试菌种的浓度 Table 1 Concentrations of the tested bacteria |
将制备的SNAP导尿管剪成长度为1 cm的小段,阴性对照样品(一次性无菌硅胶导尿管)与阳性对照样品(纳米银抗菌导尿管)均制成与受试样品等长的小段。
1.5.3 试验菌接种将200 mL TSA培养基(融化后用水浴冷却至45 ℃左右)与20 mL新鲜培养的菌液充分混合,然后倒在平板上,在培养基未凝固时用无菌镊子将长度为1 cm的导尿管分别垂直插入和平行放置于TSA平板培养基中。每个平板放置1个SNAP导尿管、1个纳米银抗菌导尿管和1个一次性无菌硅胶导尿管,每两个样品之间距离25 mm以上,样品与平板边缘距离15 mm以上,然后盖上培养皿等待凝固。
1.5.4 培养与观察待培养基凝固后,将其置于37 ℃培养箱中培养16~18 h,取出观察是否有抑菌圈产生,并选取均匀的抑菌圈测量其直径。
1.6 体内抗菌性能评价 1.6.1 实验分组将24只绵羊平均分成4组,每组6只。其中1组为正常饲养对照组,另外3组为实验组:SNAP导尿管组、纳米银抗菌导尿管组、一次性硅胶导尿管组。
1.6.2 绵羊导尿管留置模型的构建参照文献[18]的方法构建绵羊导尿管留置模型。将绵羊麻醉后,用碘伏对绵羊的尿道周围进行消毒,确保导管插入时周围环境处于无菌状态。按住绵羊,使其仰卧位导尿,打开导尿包,用镊子夹住碘伏棉球对绵羊尿道口处进行常规消毒后铺巾,用无菌水剂润滑导尿管,并保持导尿管夹处于松开状态。用镊子持导尿管轻轻插入尿道,插入的深度为距离尿道口2~5 cm,见有尿液流出后再插入2 cm,导尿管外端开口置于接尿盒中。固定住止回阀外壁,用不带针头的注射器经阀门注入额定的无菌水,使膨胀的球囊卡在膀胱出口。固定阀门外壁,缓慢拔下注射器,止回阀阀门自动密封,保持球囊膨胀。留取中段尿,置于无菌试管中送检,用于细菌培养。连接引流袋和导尿管,如不需要持续导尿,则夹闭导尿管夹。用无菌缝合线将引流袋和导尿管固定到绵羊尾部,并对缝合线部位消毒。手术后,固定住导管止回阀,用不带针头的空注射器插入止回阀内,抽吸球囊中的水,当抽出水与注入水的体积接近时缓慢拔出导尿管。如需留置导尿管,则用胶布将其固定。
1.6.3 尿液含菌量检测每日观察实验动物的精神状态、行为活动和摄食等情况,分别在第1、3、7、17天(一般硅胶对照组最长15天)收集绵羊尿液中段2管,送往医院进行尿常规检测和尿液细菌学检查。采用培养菌落计数的方法测定尿液含菌量:取200 mL TSA培养基倒在平板上待其完全凝固,然后将收集的尿液标本轻轻混匀,用定量接种环分别取尿液1 μL涂抹接种于平板上,倒置,于35~37 ℃培养18~24 h,观察细菌的菌落生长情况并进行计数。
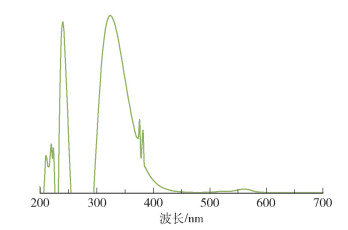
2 结果与讨论 2.1 SNAP的UV-Vis测试结果对合成的SNAP进行紫外可见分光光度检测,结果如图 1所示。在339 nm波长处SNAP有最大吸光度,符合SNAP的特征吸收峰,表明合成的SNAP成功引入了亚硝基硫醇结构。
|
图 1 SNAP的UV-Vis谱图 Fig.1 UV-Vis spectrum of SNAP |
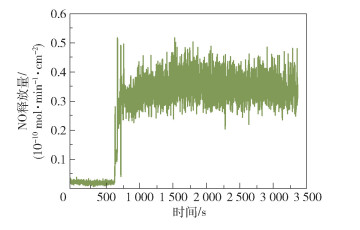
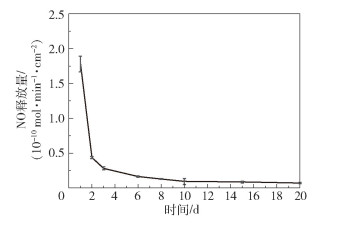
图 2为SNAP导管的典型NO释放曲线,可以看出,在约600 s时即观察到NO的释放,释放量约为0.3×10-10 mol/(min ·cm2),此后NO释放量缓慢增加。图 3为SNAP导管在20天中的NO长期释放曲线,在第1天观察到NO的释放量最大,约为1.8×10-10 mol/(min ·cm2),这主要归因于SNAP在导管表面的分布,即SNAP从导管表面的最外层快速浸出到缓冲液中。当最外层区域的SNAP耗尽后,在第2天NO释放量开始下降(约为0.5×10-10 mol/(min ·cm2)),然后在接下来的18天内NO释放量逐渐下降到0.1×10-10 mol/(min ·cm2)。导管中涂层的大部分SNAP分子是以结晶形式存在的,嵌入聚合物主体中的结晶SNAP需要一定时间溶解和释放NO,因此认为这种缓慢的晶体溶解过程是SNAP导管能够长期释放NO的原因。
|
图 2 SNAP导管的典型NO释放曲线 Fig.2 Typical NO release curve of the SNAP catheter |
|
图 3 SNAP导管的NO长期释放曲线 Fig.3 Long-term NO release curve of the SNAP catheter |
SNAP导尿管对各试验菌种的抑菌圈如图 4所示,抑菌圈直径测量结果如表 2所示。在两种导尿管放置方式的实验中,SNAP导尿管对金黄色葡萄球菌均具有清晰可见的抑菌圈,垂直插入法和平行放置法的抑菌圈直径分别为2.59 mm和2.75 mm,表明SNAP导尿管对金黄色葡萄球菌具有一定的抑菌效果。在其他菌种的测定结果中均未观察到清晰的抑菌圈,表明SNAP导尿管对大肠埃希菌、铜绿假单胞菌和肺炎克雷伯菌没有抑菌效果。

|
1—SNAP导尿管;2—纳米银导尿管;3—一次性硅胶导尿管。 图 4 SNAP导尿管、纳米银导尿管和一次性硅胶导尿管对不同菌种的抑菌圈实验结果 Fig.4 Experimental results showing the inhibition zones for the SNAP catheter, nano-silver catheter and disposable silica gel catheter against different strains |
| 下载CSV 表 2 SNAP导尿管对不同菌种的抑菌圈直径 Table 2 Inhibition zone diameter of the SNAP catheter against different strains |
在临床的尿常规检测中,当尿液含菌量大于105 cfu/mL时,提示有泌尿系统感染。对各组留置导尿管后1、3、7、17天的尿液进行尿常规检测和尿液细菌学检查,得到各组绵羊的尿液含菌量,如表 3所示。结果显示,总体上看留置SNAP导尿管的绵羊组比留置纳米银导尿管组和硅胶导尿管组的尿液含菌量更低。在第17天,留置SNAP导尿管的绵羊尿液中未检测到菌残留;在留置纳米银导尿管组中,在第17天有2只绵羊的尿液含菌量大于105 cfu/mL,有2只绵羊的尿液含菌量为104~105 cfu/mL,提示纳米银导尿管在体内留置较长时间后会诱发尿路感染;在留置硅胶导尿管组中,在第15天有1只绵羊的尿液含菌量大于105 cfu/mL。以上结果表明,相较于纳米银导尿管和硅胶导尿管,SNAP导尿管具有较为明显的抗菌效果。
| 下载CSV 表 3 各实验组在不同时间的绵羊尿液含菌量 Table 3 Bacterial content in the urine of sheep in each experimental group at different times |
(1) SNAP导管的典型NO释放曲线表明,在约600 s时即可观察到NO的释放(释放量约0.3×10-10 mol/(min ·cm2)),此后NO释放量缓慢增加;NO长期释放曲线表明,在第1天观察到NO的释放量可达1.8×10-10 mol/(min ·cm2),此后NO释放量逐渐下降并可持续释放20天。
(2) 体外抑菌实验表明,SNAP导尿管对金黄色葡萄球菌有较明显的抑菌作用,垂直插入法和平行放置法测得的抑菌圈直径分别为2.59 mm和2.75 mm,但SNAP导尿管对大肠埃希菌、铜绿假单胞菌和肺炎克雷伯菌没有抑菌作用。
(3) 在体内抗菌活性测定实验中,在监测17天后,在SNAP导尿管组的绵羊尿液中未检测到细菌,而在纳米银导尿管组和硅胶导尿管组的绵羊尿液中均检测出含菌量大于105 cfu/mL。结果表明SNAP导尿管具有较好的体内抗菌性能。
| [1] |
KRANZ J, SCHMIDT S, WAGENLEHNER F, et al. Catheter-associated urinary tract infections in adult patients[J]. Deutsches Ärzteblatt International, 2020, 117(6): 83-88. |
| [2] |
CORTESE Y J, WAGNER V E, TIERNEY M, et al. Review of catheter-associated urinary tract infections and in vitro urinary tract models[J]. Journal of Healthcare Engineering, 2018, 2018: e2986742. |
| [3] |
FLORES-MIRELES A, HREHA T N, HUNSTAD D A. Pathophysiology, treatment, and prevention of catheter-associated urinary tract infection[J]. Topics in Spinal Cord Injury Rehabilitation, 2019, 25(3): 228-240. DOI:10.1310/sci2503-228 |
| [4] |
MAHARJAN G, KHADKA P, SIDDHI SHILPAKAR G, et al. Catheter-associated urinary tract infection and obstinate biofilm producers[J]. Canadian Journal of Infectious Diseases and Medical Microbiology, 2018, 2018: e7624857. |
| [5] |
谷娅, 陈艺, 李子慧, 等. 留置导尿患者导尿管表面生物膜形成的危险因素分析[J]. 中国消毒学杂志, 2021, 38(11): 839-842. GU Y, CHEN Y, LI Z H, et al. Analysis of risk factors of biofilm formation on catheter surface in patients with in-dwelling urinary catheter[J]. Chinese Journal of Disinfection, 2021, 38(11): 839-842. (in Chinese) DOI:10.11726/j.issn.1001-7658.2021.11.012 |
| [6] |
张娟, 岳卫华. 银离子水凝胶涂层导尿管的体外抑菌效果[J]. 医疗装备, 2022, 35(1): 51-53. ZHANG J, YUE W H. In vitro evaluation of antibacterial effect of silver hydrogel coated catheter[J]. Medical Equipment, 2022, 35(1): 51-53. (in Chinese) |
| [7] |
李育强, 智倩倩, 王晓丽, 等. 新型导尿管超滑抗菌涂层的制备及生物安全性评价[J]. 生物医学工程研究, 2019, 38(1): 105-110. LI Y Q, ZHI Q Q, WANG X L, et al. The preparation and biological safety evaluation for ultra smooth antibacterial coating for new catheter[J]. Journal of Biomedical Engineering Research, 2019, 38(1): 105-110. (in Chinese) |
| [8] |
周小婷, 徐玉茵, 田林奇, 等. 涂层导尿管的研究进展[J]. 品牌与标准化, 2020(1): 46-50. ZHOU X T, XU Y Y, TIAN L Q, et al. Advances in the study of coated catheters[J]. Brand & Standardization, 2020(1): 46-50. (in Chinese) |
| [9] |
BRISBOIS E J, MAJOR T C, GOUDIE M J, et al. Improved hemocompatibility of silicone rubber extracorporeal tubing via solvent swelling-impregnation of S-nitroso-N-acetylpenicillamine (SNAP) and evaluation in rabbit thrombogenicity model[J]. Acta Biomaterialia, 2016, 37: 111-119. DOI:10.1016/j.actbio.2016.04.025 |
| [10] |
JONES M L, GANOPOLSKY J G, LABBÉ A, et al. Antimicrobial properties of nitric oxide and its application in antimicrobial formulations and medical devices[J]. Applied Microbiology and Biotechnology, 2010, 88(2): 401-407. DOI:10.1007/s00253-010-2733-x |
| [11] |
SCHAIRER D O, CHOUAKE J S, NOSANCHUK J D, et al. The potential of nitric oxide releasing therapies as antimicrobial agents[J]. Virulence, 2012, 3(3): 271-279. DOI:10.4161/viru.20328 |
| [12] |
LIU S X, CAI X, XUE W, et al. Chitosan derivatives co-delivering nitric oxide and methicillin for the effective therapy to the methicillin-resistant S. aureus infection[J]. Carbohydrate Polymers, 2020, 234: 115928. DOI:10.1016/j.carbpol.2020.115928 |
| [13] |
WU M, LU Z H, WU K K, et al. Recent advances in the development of nitric oxide-releasing biomaterials and their application potentials in chronic wound healing[J]. Journal of Materials Chemistry B, 2021, 9(35): 7063-7075. |
| [14] |
COLLETTA A, WU J, WO Y, et al. S-nitroso-N-acetylpenicillamine (SNAP) impregnated silicone foley catheters: a potential biomaterial/device to prevent catheter-associated urinary tract infections[J]. ACS Biomaterials Science & Engineering, 2015, 1(6): 416-424. |
| [15] |
WO Y, LI Z, BRISBOIS E J, et al. Origin of long-term storage stability and nitric oxide release behavior of CarboSil polymer doped with S-nitroso-N-acetyl-D-penicillamine[J]. ACS Applied Materials & Interfaces, 2015, 7(40): 22218-22227. |
| [16] |
CHIPINDA I, SIMOYI R H. Formation and stability of a nitric oxide donor: S-nitroso-N-acetylpenicillamine[J]. The Journal of Physical Chemistry B, 2006, 110(10): 5052-5061. |
| [17] |
WO Y, BRISBOIS E J, WU J, et al. Reduction of thrombosis and bacterial infection via controlled nitric oxide (NO) release from S-nitroso-N-acetylpenicillamine (SNAP) impregnated CarboSil intravascular catheters[J]. ACS Biomaterials Science & Engineering, 2017, 3(3): 349-359. |
| [18] |
李非, 马艳斌, 迟戈. 基于技术审评的一次性使用导尿管研究[J]. 中国医疗器械信息, 2010, 16(9): 40-43. LI F, MA Y B, CHI G. Research of catheters based on medical device evaluation[J]. China Medical Device Information, 2010, 16(9): 40-43. (in Chinese) |








