2. 河北工程技术学院 土木工程学院, 石家庄 050000
2. School of Civil Engineering, Hebei Polytechnic Institute, Shijiazhuang 050000, China
L-天冬氨酸(L-aspartic acid)又称L-天门冬氨酸,是一种α-氨基酸,它是构成蛋白质的20种天然氨基酸之一[1]。在医药方面,L-天冬氨酸可以用于治疗心脏病、肝病及高血压,还可以用作氨解毒剂、肝功能促进剂和疲劳恢复剂[2];在食品工业方面,L-天冬氨酸是一种良好的营养增补剂,可添加于各种清凉饮料中,也是生产甜味素阿斯巴甜(天冬酰苯丙氨酸甲酯)的主要原料[3];在化工方面,L-天冬氨酸是合成高分子材料聚天冬氨酸的前体[4]。
L-天冬氨酸的生产方法有化学合成法和酶催化法[2]。化学合成法主要以马来酸或富马酸或者它们的酯为原料,在加压下用氨处理,然后水解,但容易合成得到L型与D型混合的天冬氨酸;酶催化法采用L-天冬氨酸裂解酶催化富马酸加氨,得到专一的L-型天冬氨酸。目前,工业上多采用化学法和酶催化法两步生产L-天冬氨酸:以马来酸酐为原料,在无机催化剂、强酸性条件下转化生成富马酸;然后以富马酸和氨水为底物,在L-天冬氨酸裂解酶的催化下生成L-天冬氨酸[5-7]。化学法生产富马酸需要在高温高压下进行,对设备要求高,且容易造成环境污染[8]。Abdullah等[9]采用产马来酸异构酶菌株将马来酸异构化生成富马酸后,利用产L-天冬氨酸裂解酶菌株催化富马酸加成氨生成L-天冬氨酸。目前,已有采用马来酸异构酶和L-天冬氨酸裂解酶共表达菌株全细胞催化马来酸铵合成L-天冬氨酸的报道[10-11]。全细胞法的两种酶均位于细胞内,底物需通过大肠杆菌细胞壁与酶接触,催化效率低,菌体用量高,无法发挥最大的催化效率。余龙等[10]采用固定化细胞进行两步转化反应,固定化细胞工艺提高了酶生产成本,并且经多批次反应后,固定化细胞的马来酸异构酶酶活显著下降,反应批次有限。目前,工业上采用硫酸酸化使L-天冬氨酸结晶[12],硫酸结晶引入了杂质硫酸根,且产生了经济价值低的硫酸铵。
本课题组将来源于Bordetalla pertussis tohama I的马来酸异构酶基因序列(Bpt)克隆至大肠杆菌表达载体pET29a上,采用定点突变技术得到马来酸异构酶突变菌株E.coli BL21(DE3) Bptm;随后,将大肠杆菌天冬氨酸裂解酶基因序列(Easp)克隆至pET29a-Bptm上,将Easp和Bptm串联重组后的表达质粒转化到大肠杆菌中,得到双酶表达菌株E.coli BL21(DE3) Bptm-Easp。在此基础上,本研究将上述菌体超声破碎,得到两种酶的细胞裂解液,经测定,相比于裂解前的菌悬液,细胞裂解液的马来酸异构酶酶活有显著提高,采用细胞裂解液催化反应可降低投入的菌体量;然后分别采用马来酸异构酶和天冬氨酸裂解酶单酶表达菌株E.coli BL21(DE3) Bptm和E.coli BL21(DE3) Easp的细胞裂解液或双酶表达菌株E.coli BL21(DE3) Bptm-Easp的细胞裂解液催化马来酸铵两步反应,得到L-天冬氨酸;反应结束后,反应液经活性炭脱色,采用马来酸调酸使L-天冬氨酸结晶,过滤、洗涤、干燥后,得到L-天冬氨酸晶体,而滤液为马来酸溶液,可作为下一轮反应的底物。然而滤液体积与原反应液接近,若采用25%氨水中和将造成反应液体积超过初始批次的反应液体积,而采用不含水的碳酸氢铵代替大部分氨水中和马来酸溶液,反应产物二氧化碳会从反应液中溢出,新一批次的反应液体积不会超过初始批次的反应液,可以保证无限循环反应。碳酸氢铵作为常见的氮肥,其价格与工业氨水接近,且储存运输方便。
1 实验部分 1.1 实验材料与仪器 1.1.1 菌株马来酸异构酶菌株E.coli BL21(DE3) Bptm、L-天冬氨酸裂解酶菌株E.coli BL21(DE3) Easp、双酶表达菌株E.coli BL21(DE3) Bptm-Easp由本实验室构建和保藏。
1.1.2 试剂马来酸、富马酸、氨水、碳酸氢铵,均为化学纯,购自上海国药化学试剂有限公司;L-天冬氨酸对照品(纯度98%),分析纯,购自百灵威科技有限公司;酵母粉和胰蛋白胨,购自Oxoid公司;异丙基硫代半乳糖苷(IPTG),购自翌圣生物科技(上海)股份有限公司;LB培养基,含胰蛋白胨10 g/L、氯化钠5 g/L、酵母粉10 g/L。
1.1.3 实验仪器紫外分光光度计(TU-1810,北京普析分析仪器有限公司)、恒温振荡摇床(ZWY-111B,上海智城分析仪器制造有限公司)、集热式磁力搅拌器(DF-101S,巩义市予华仪器有限责任公司)、pH计(S210,梅特勒-托利多公司)、高效液相色谱仪(HPLC)(Agilent1220,安捷伦公司)、细胞超声波破碎仪(Sonicator 3000,Misonix公司)、台式冷冻高速离心机(Sorvall Stratos,Thermo公司)、高温干燥箱(GZX-9146MB,上海博讯实业有限公司医疗设备厂)。
1.2 大肠杆菌培养与酶蛋白诱导表达挑取甘油管中保存的马来酸异构酶菌株、L-天冬氨酸裂解酶菌株以及双酶表达菌株,分别接种于LB培养基试管中,于37 ℃、220 r/min过夜培养。以1%的接种量接种于150 mL LB培养基中,于37 ℃、220 r/min培养,采用紫外分光光度计在600 nm波长下测定发酵液的吸光度,直至吸光度为1.0。加入IPTG(终浓度为1 mmol/L)诱导酶蛋白表达,于25 ℃、220 r/min培养24 h。离心收集湿菌体,称重。使用20 mmol/L磷酸盐缓冲液(pH7.0)以10 mg/mL的质量浓度重悬菌体,得到菌悬液。采用细胞超声波破碎仪破碎菌悬液,离心后得到酶的细胞裂解液。
1.3 马来酸异构酶和L-天冬氨酸裂解酶的酶活测定 1.3.1 马来酸异构酶马来酸异构酶的酶活定义:在37 ℃、pH8.0的条件下,每分钟将1 μmol马来酸转化为富马酸(以pH8.0的马来酸钠溶液为底物)所需要异构酶的量,定义为1 U。测定方法如下:称取马来酸5 g,加入40 mL纯化水溶解,用4 mol/L氢氧化钠调节pH为8.0,定容至100 mL。底物溶液在水浴条件下达到37 ℃后,吸取950 μL底物溶液加入到2 mL离心管中,加入50 μL细胞裂解液,在37 ℃摇床中于120 r/min振荡反应20 min。吸取50 μL反应液加入950 μL纯化水,混匀后,再吸取100 μL该液体加入900 μL纯化水,煮沸2 min,用0.45 μm滤膜过滤,吸取10 μL滤液进行HPLC检测,测定反应液中富马酸的含量并计算酶活。
1.3.2 L-天冬氨酸裂解酶L-天冬氨酸裂解酶的酶活定义:在37 ℃、pH8.0的条件下,每分钟将1 μmol富马酸铵转化为L-天冬氨酸(以pH8.0的富马酸铵溶液为底物)所需要L-天冬氨酸裂解酶的量,定义为1 U。测定方法如下:称取10.0 g富马酸,加入纯化水25 mL溶解,用氨水调节pH为8.0,定容至50 mL。底物溶液在水浴条件下达到37 ℃后,吸取富马酸铵母液4 mL,加入0.1 mL细胞裂解液,于37 ℃、220 r/min下振荡反应10 min。吸取50 μL反应液加入950 μL纯化水,然后用纯化水稀释10倍,混匀,煮沸2 min,冷却后,用0.45 μm滤膜过滤,吸取10 μL滤液进行HPLC检测,测定反应液中L-天冬氨酸的含量并计算酶活。
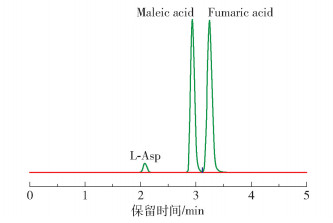
1.4 马来酸、富马酸和L-天冬氨酸的含量测定采用高效液相色谱仪测定马来酸、富马酸和L-天冬氨酸的含量。流动相A:50 mmol/L磷酸二氢钾(pH2.5),流动相B:乙腈,流动相A与B的体积比为95 ∶5;检测波长205 nm,流速0.8 mL/min,进样量10 μL;色谱柱为C18液相色谱柱(Agela Innoval ODS-2,150 mm×4.6 mm,5 μm),柱温30 ℃,走样时间5 min。图 1为1 mg/mL L-天冬氨酸、0.2 mg/mL马来酸与富马酸的高效液相色谱图,按照式(1)计算L-天冬氨酸纯度。
| $P=\frac{A_{\rm{s}} \rho_{\mathrm{r}}}{A_{\mathrm{r}} \rho_{\mathrm{s}}} \times 100 \%$ | (1) |
|
图 1 L-天冬氨酸、马来酸和富马酸的高效液相色谱图 Fig.1 High performance liquid chromatograms of L-aspartic acid, maleic acid and fumaric acid |
式中:P为L-天冬氨酸纯度;As为样品峰面积;Ar为对照品峰面积;ρs为样品质量浓度,mg/mL;ρr为对照品质量浓度,mg/mL。
1.5 底物的配制氨水法称取40 g马来酸,加入100 mL水搅拌溶解,加入约60 mL氨水调节pH为8.0(40 ℃),定容到200 mL,此时马来酸含量为200 g/L。
碳酸氢铵法称取40 g马来酸,加100 mL水搅拌溶解,加入48.7 g碳酸氢铵后pH为6.0(40 ℃), 加入8 mL氨水调节pH为8.0(40 ℃),定容到200 mL,此时马来酸含量为200 g/L。
1.6 L-天冬氨酸的循环生产工艺在马来酸铵底物溶液中加入总活力为2 000 U/L的马来酸异构酶的细胞裂解液(E.coli BL21(DE3) Bptm)和总活力为6 000 U/L的L-天冬氨酸裂解酶的细胞裂解液(E.coli BL21(DE3) Easp),或者以马来酸异构酶为标准加入总活力为2 000 U/L的马来酸异构酶的双酶菌株(E.coli BL21(DE3) Bptm-Easp)细胞裂解液,控制反应温度40 ℃,搅拌转速120~150 r/min,采用HPLC检测反应过程中马来酸、富马酸和L-天冬氨酸的含量变化。待马来酸转化率(计算公式如式(2)所示)到达99%以上,同时中间产物富马酸的含量降到2 g/L时,停止转化,进行脱色和结晶操作。
| $R=\frac{\rho_0-\rho}{\rho_0} \times 100 \%$ | (2) |
式中:R为马来酸转化率;ρ0为初始马来酸含量,g/L;ρ为剩余马来酸含量,g/L。
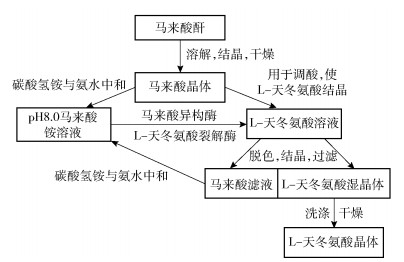
将反应结束后的溶液进行活性炭脱色,过滤去除活性炭,升温至80 ℃,缓慢加入固体马来酸调节反应液pH为2.8,冷却至常温后,过滤得到L-天冬氨酸晶体。采用碳酸氢铵和少量氨水调节马来酸滤液的pH为8.0,作为下一轮反应底物。用纯化水对L-天冬氨酸晶体洗涤3次,于60 ℃干燥5 h,得到高纯度的L-天冬氨酸晶体,按照式(3)计算结晶收率。L-天冬氨酸的循环生产工艺流程如图 2所示。
| $Y=\frac{m_1}{m_2} \times 100 \%$ | (3) |
|
图 2 L-天冬氨酸的循环生产工艺流程图 Fig.2 Flow chart of the cyclic production process for L-aspartic acid |
式中:Y为结晶收率;m1为实际得到的L-天冬氨酸晶体的质量,g;m2为反应液中理论含有的L-天冬氨酸的质量,g。
2 结果与讨论 2.1 马来酸异构酶和L-天冬氨酸裂解酶的酶活测定了菌株E.coli BL21(DE3) Bptm、双酶表达菌株E.coli BL21(DE3) Bptm-Easp细胞裂解液的马来酸异构酶酶活,同时测定了菌株E.coli BL21(DE3) Easp和E.coli BL21(DE3) Bptm-Easp细胞裂解液的L-天冬氨酸裂解酶酶活,并对比了E.coli BL21(DE3) Bptm细胞裂解液及其菌悬液的马来酸异构酶酶活,结果见表 1。可以看出:等细胞浓度的菌悬液的马来酸异构酶酶活不足细胞裂解液的1/3,将菌体破碎使酶释放有利于提高反应效率;一菌双酶表达菌株E.coli BL21(DE3) Bptm-Easp的马来酸异构酶和L-天冬氨酸裂解酶的酶活略小于各自的单酶表达菌株,采用单独两种酶的细胞裂解液可以达到最低的酶消耗量,而采用一菌双酶细胞裂解液可以减少发酵次数。马来酸异构酶的单位酶活远低于L-天冬氨酸裂解酶,因此异构反应为两步转化反应的限速步骤。
| 下载CSV 表 1 马来酸异构酶和L-天冬氨酸裂解酶的酶活 Table 1 Enzymatic activities of maleic acid isomerase and L-aspartic acid lyase |
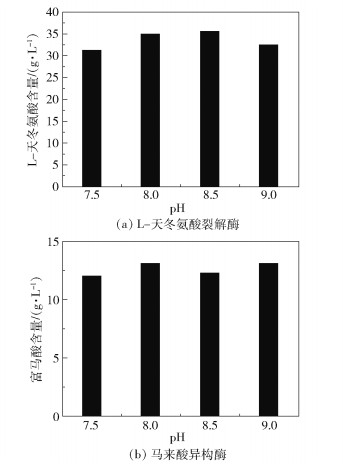
配制pH为7.5、8.0、8.5和9.0的200 g/L富马酸铵溶液,加入700 U/mL的E.coli BL21(DE3) Easp细胞裂解液,于37 ℃、220 r/min振荡反应30 min,终止反应后,测定反应液中生成的L-天冬氨酸含量,结果如图 3(a)所示。同时,配制pH为7.5、8.0、8.5和9.0的50 g/L马来酸钠溶液,加入25 U/mL的E.coli BL21(DE3) Bptm细胞裂解液,于37 ℃、120 r/min振荡反应30 min,终止反应后,测定反应液中生成的富马酸含量,结果如图 3(b)所示。结果表明,L-天冬氨酸裂解酶的最佳pH范围为8.0~8.5,马来酸异构酶的最佳pH范围为8.0~9.0。为减少氨的添加量,选择pH8.0的马来酸铵作为双酶催化体系的底物。
|
图 3 pH对L-天冬氨酸裂解酶和马来酸异构酶催化效率的影响 Fig.3 Effect of pH on the catalytic efficiency of L-aspartic acid lyase and maleic acid isomerase |
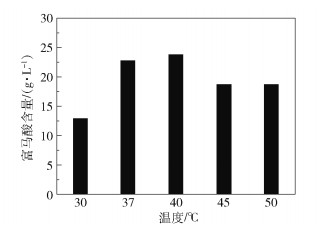
文献[8]表明L-天冬氨酸裂解酶的最适反应温度为37 ℃。为了研究反应温度对马来酸异构酶的影响,配制pH为8.0的50 g/L马来酸钠溶液,加入75 U/mL的E.coli BL21(DE3) Bptm细胞裂解液,分别在30 ℃、37 ℃、40 ℃、45 ℃和50 ℃的恒温摇床中于120 r/min振荡反应20 min,终止反应后,测定反应液中生成的富马酸含量,结果见图 4。可以看出,马来酸异构酶的最适反应温度为40 ℃,由于异构反应为两步反应的限速步骤,因此选择双酶催化反应的温度为40 ℃。
|
图 4 温度对马来酸异构酶催化效率的影响 Fig.4 Effect of temperature on the catalytic efficiency of maleic acid isomerase |
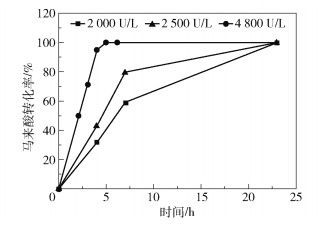
在200 mL的200 g/L马来酸铵底物溶液(pH8.0)中分别加入马来酸异构酶总活力为2 000、2 500、4 800 U/L的E.coli BL21(DE3) Bptm-Easp细胞裂解液,于40 ℃、150 r/min进行反应,测定反应过程中马来酸含量,计算马来酸转化率,结果如图 5所示。对于添加马来酸异构酶总活力为4 800 U/L的一菌双酶反应,8 h内马来酸转化率可达100%;对于添加马来酸异构酶总活力为2 000 U/L和2 500 U/L的一菌双酶反应,24 h内可将200 g/L马来酸转化完毕。考虑酶成本,选择本反应添加的马来酸异构酶总活力为2 000 U/L。
|
图 5 马来酸异构酶添加量对马来酸转化率的影响 Fig.5 Effect of maleic acid isomerase dosage on maleic acid conversion rate |
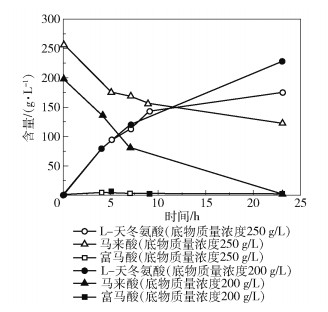
采用一菌双酶菌株E.coli BL21(DE3) Bptm-Easp考察底物马来酸浓度对反应过程的影响。马来酸的质量浓度分别为200 g/L和250 g/L,加入碳酸氢铵中和反应液至pH为6.0,再加入少量氨水调节pH为8.0,反应液中分别加入马来酸异构酶活力为2 000 U/L和2 500 U/L的E.coli BL21(DE3) Bptm-Easp细胞裂解液,于40 ℃、150 r/min反应24 h,测定反应过程中马来酸、富马酸和L-天冬氨酸的含量变化,结果如图 6所示。可以看出,当底物的质量浓度增加25%,相应的马来酸异构酶总酶活增加25%时,反应24 h,马来酸并未转化完毕。考虑到转化效率和结晶所必需的马来酸浓度,选择本反应最佳的底物浓度为200 g/L。
|
图 6 底物质量浓度对转化反应的影响 Fig.6 Effect of substrate mass concentration on transformation reaction |
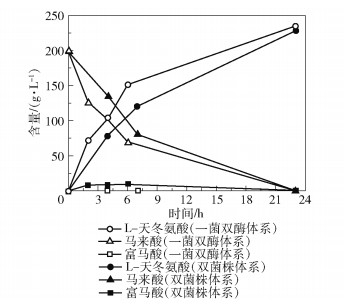
以200 g/L马来酸铵为底物,添加总活力为2 000 U/L的马来酸异构酶,对比一菌双酶体系与马来酸异构酶和L-天冬氨酸裂解酶两种细胞裂解液的反应过程。表 2为两种酶催化体系的反应液中马来酸异构酶和L-天冬氨酸裂解酶的酶活,可以看出一菌双酶体系的L-天冬氨酸裂解酶总活力远高于双菌株细胞裂解液。图 7为两种体系的催化反应中马来酸、富马酸和L-天冬氨酸的含量变化,结果显示:在添加马来酸异构酶总活力相同的情况下,由于一菌双酶体系添加的L-天冬氨酸裂解酶的总活力较高,因此中间产物富马酸的积累量较低;24 h内两种催化体系的马来酸转化率均可达到100%,因此两种体系均可用于转化反应。
| 下载CSV 表 2 一菌双酶和双菌株催化体系中马来酸异构酶和L-天冬氨酸裂解酶的总活力 Table 2 Total activity of maleic acid isomerase and L-aspartic acid lyase in one-strain double enzyme and double-strain catalytic system |
|
图 7 一菌双酶和双菌株催化体系的反应过程对比 Fig.7 Comparison of the reaction processes between the one-strain double enzyme and double-strain catalytic system |
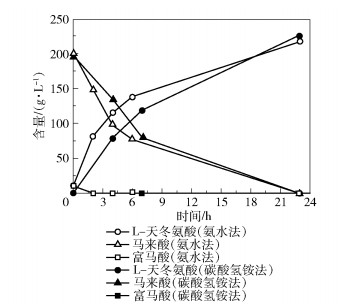
以200 g/L马来酸铵为底物,分别采用氨水法和碳酸氢铵法配制200 mL马来酸铵反应液(pH8.0),加入马来酸异构酶总活力为2 000 U/L的E.coli BL21(DE3) Bptm-Easp细胞裂解液,于40 ℃、150 r/min搅拌反应24 h,测定两种底物配制方法制备的反应液中马来酸、富马酸和L-天冬氨酸的含量变化,结果如图 8所示。结果表明,氨水法和碳酸氢铵法配制的反应液中,在24 h内200 g/L马来酸均可转化完毕。
|
图 8 氨水法和碳酸氢铵法的反应过程对比 Fig.8 Comparison of the reaction processes between the ammonia method and ammonium bicarbonate method |
以200 g/L马来酸为底物,首批反应可选择氨水或碳酸氢铵中和马来酸,调节pH为8.0,在优化的酶催化反应条件下采用一菌双酶体系(E.coli BL21(DE3) Bptm-Easp细胞裂解液)进行转化,马来酸转化完毕后经活性炭脱色,于80 ℃采用固体马来酸调节反应液pH为2.8使L-天冬氨酸结晶,过滤后得到L-天冬氨酸湿润晶体,经纯化水洗涤后干燥,得到L-天冬氨酸晶体。而含有大量马来酸的滤液可作为下次反应的底物,滤液体积约为170~190 mL,初始反应和4次循环反应的滤液成分和结晶所消耗的马来酸质量见表 3,结晶消耗的马来酸总量与初始投入的马来酸质量(40 g)接近。采用碳酸氢铵中和马来酸滤液至pH为6.0,再用5~8 mL氨水调节上清液的pH为8.0,定容至200 mL,可得到与初始反应浓度接近的马来酸铵溶液。市售的氨水多为25%氨水,其中含有的大量水会使反应液的体积超过200 mL,后期循环反应前需要将反应液浓缩,而采用碳酸氢铵中和可以避免此问题。在此基础上对马来酸滤液进行了4批转化反应,前后共5批反应的马来酸转化率、L-天冬氨酸结晶收率和纯度见表 4。结果表明,5批反应均得到纯度较高的L-天冬氨酸(对照品L-天冬氨酸的纯度为98%),马来酸转化率、L-天冬氨酸的结晶收率及纯度与初始批次反应无显著差异。
| 下载CSV 表 3 结晶后马来酸滤液的成分和结晶消耗的马来酸质量 Table 3 Composition of the maleic acid filtrate after crystallization and mass of maleic acid consumed by crystallization |
| 下载CSV 表 4 5批反应的马来酸转化率、L-天冬氨酸结晶收率和纯度 Table 4 Conversion rate of maleic acid, crystallization yield and purity of L-aspartic acid in five batches |
利用实验室构建的马来酸异构酶菌株E.coli BL21(DE3) Bptm、天冬氨酸裂解酶菌株E.coli BL21(DE3) Easp和双酶共表达菌株E.coli BL21(DE3) Bptm-Easp的细胞裂解液将马来酸异构化为富马酸,进而加氨得到L-天冬氨酸,建立了L-天冬氨酸的循环生产工艺,所得结论如下:
(1) 优化了酶催化反应条件:采用pH8.0的200 g/L马来酸铵溶液作为底物,添加含有2 000 U/L马来酸异构酶和6 000 U/L天冬氨酸裂解酶的双菌株体系或者添加相应的一菌双酶体系,40 ℃搅拌反应24 h,马来酸可转化完毕。其中,底物马来酸铵溶液可以采用氨水法或碳酸氢铵法配制。
(2) 开发了固体马来酸替代硫酸使L-天冬氨酸结晶的工艺,结晶后的马来酸滤液可用碳酸氢铵中和至pH6.0,再用少量氨水调节pH为8.0,作为下一批次反应的底物。结晶消耗的马来酸量与下批次反应所需的马来酸量接近,采用碳酸氢铵替代大部分氨水中和马来酸可避免反应液体积超过初始批次反应液的体积。在此基础上对马来酸滤液进行了4批转化反应,马来酸转化率、L-天冬氨酸的结晶收率及纯度与初始批次反应基本一致。
| [1] |
GÖTZ K P, CHMIELEWSKI F M, GÖDEKE K, et al. Assessment of amino acids during winter rest and ontogenetic development in sweet cherry buds (Prunus avium L.)[J]. Scientia Horticulturae, 2017, 222: 102-110. DOI:10.1016/j.scienta.2017.05.001 |
| [2] |
冯志斌, 殷曰彩, 米阳, 等. 天冬氨酸生产工艺的研究进展[J]. 发酵科技通讯, 2012, 41(2): 38-41. FENG Z B, YIN Y C, MI Y, et al. Research progress on production process of aspartic acid[J]. Bulletin of Fermentation Science and Technology, 2012, 41(2): 38-41. (in Chinese) DOI:10.3969/j.issn.1674-2214.2012.02.014 |
| [3] |
林应锐. 阿斯巴甜的生物合成[J]. 微生物学通报, 1992, 19(4): 226-229. LIN Y R. Biosynthesis of aspartame[J]. Microbiology China, 1992, 19(4): 226-229. (in Chinese) DOI:10.13344/j.microbiol.china.1992.04.010 |
| [4] |
杨士林, 黄君礼, 张玉玲, 等. 聚天冬氨酸制造工艺研究进展[J]. 环境污染治理技术与设备, 2002, 3(9): 38-41, 45. YANG S L, HUANG J L, ZHANG Y L, et al. The research progress in manufacture process of polyaspartic acid[J]. Techniques and Equipment for Environmental Pollution Control, 2002, 3(9): 38-41, 45. (in Chinese) |
| [5] |
PAPIERZ M, GADOMSKA G, SOBIERAJSKI B, et al. Selection and activation of Escherichia coli strains for L-aspartic acid biosynthesis[J]. Polish Journal of Microbiol-ogy, 2007, 56(2): 71-76. |
| [6] |
SZYMAŃSKA G, SOBIERAJSKI B, CHMIEL A. Immobilized cells of recombinant Escherichia coli strain for continuous production of L-aspartic acid[J]. Polish Journal of Microbiology, 2011, 60(2): 105-112. DOI:10.33073/pjm-2011-014 |
| [7] |
GADOMSKA G, PŁUCIENNICZAK A, CHMIEL A. Recombinant strains of Escherichia coli for L-aspartic acid biosynthesis[J]. Polish Journal of Microbiology, 2007, 56(2): 77-82. |
| [8] |
郝大伟, 裘娟萍. 生物催化富马酸加氨合成天门冬氨酸的研究进展[J]. 氨基酸和生物资源, 2008, 30(2): 39-43. HAO D W, QIU J P. Research progress on synthesizing aspartic acid by fumaric acid ammonification biotransformation[J]. Amino Acid & Biotic Resourses, 2008, 30(2): 39-43. (in Chinese) |
| [9] |
ABDULLAH Y, DAUD A R, ALIAS N H, et al. Biodegradable polymeric bone cement formed from hydroxyapatite, poly(propylene fumerate), poly(vinyl pyrrolidone) and benzoyl peroxide[J]. Materials Science and Technology, 2004, 20(9): 1084-1086. DOI:10.1179/026708304225019713 |
| [10] |
余龙, 陈寅, 周丽, 等. 双酶偶联催化马来酸生成L-天冬氨酸[J]. 食品与发酵工业, 2018, 44(8): 20-26. YU L, CHEN Y, ZHOU L, et al. Whole-cell biocatalysis of maleic acid into L-aspartic acid by dual-enzyme coupling[J]. Food and Fermentation Industries, 2018, 44(8): 20-26. (in Chinese) |
| [11] |
刘祥涛, 张瑞, 冯进辉, 等. "一锅双酶"法制备L-天冬氨酸的工艺条件优化[J]. 生物加工过程, 2017, 15(4): 45-50. LIU X T, ZHANG R, FENG J H, et al. Optimizing of L-aspartic acid production by a "one-pot two-enzyme" process[J]. Chinese Journal of Bioprocess Engineering, 2017, 15(4): 45-50. (in Chinese) |
| [12] |
徐慧, 崔颖, 王珊珊, 等. L-天冬氨酸的提取工艺优化[J]. 中国酿造, 2021, 40(3): 181-185. XU H, CUI Y, WANG S S, et al. Optimization of extraction technology of L-aspartic acid[J]. China Brewing, 2021, 40(3): 181-185. (in Chinese) |







