过氧化氢酶(EC 1.11.1.6,CAT)是生物体内普遍存在的具有抗氧化活性的氧化还原酶,可有效地将H2O2转化为水和分子氧,还可以与超氧化物歧化酶、谷胱甘肽过氧化物酶等进行协同作用,通过清除细胞中过量的活性氧(ROS)而保护生物体[1-2]。目前,CAT在食品加工杀菌消毒、纺织物和纸张漂白、药物合成生物催化剂以及医用伤口愈合等领域被广泛应用[3-4]。但是游离CAT稳定性差、难以重复利用,通过固定化可有效提高其热稳定性和操作稳定性,并易实现可重复使用性而降低成本[5-8]。
众所周知,固定化介质和固定化方法是影响固定化酶活性和催化性质的重要因素。磁性Fe3O4粒子具有超顺磁性、良好的生物相容性、大的比表面积以及易于从反应体系中分离等特点,因此在酶固定化方面具有良好的应用前景[9]。Wang等[10]通过吸附交联法使用磁性Fe3O4-壳聚糖纳米复合材料固定CAT,固定化量达到82.3 mg/g,并提高了酶的稳定性和可重复使用性;Ibrahim Alhayali等[11]将CAT和磁性Fe3O4粒子混合后,添加含Cu2+的溶液得到CAT/Fe3O4@Cu2+复合粒子,用于硝基苯和有机染料的还原反应;Ali等[12]合成了环氧功能化Fe3O4纳米粒子用于共价固定CAT,提高了酶的耐高温性能以及碱性环境下的酶活性;Wang等[13]经SiO2层包覆、戊二醛处理,获得醛基活化的磁性粒子Fe3O4@SiO2-CHO,然后通过共价结合法固定CAT,当其固定化量为14.4 μg/mg时,酶活性回收率可达100%。
为了避免大分子修饰引起的粒子团聚以及提高酶固定化的选择性[14],本研究采用溶剂热法制备了磁性Fe3O4粒子,并通过小分子共价反应负载Ni2+离子,获得单分散固定化介质(Fe3O4@Ni),制备过程中无聚合反应或大分子参与;构建了在氨基端和羧基端各修饰6×His的CAT基因工程菌并进行表达,然后通过Fe3O4@Ni上的Ni2+与CAT的His咪唑基之间的金属螯合作用实现选择性固定,提高了酶的固定化效果,为CAT固定化的进一步应用研究奠定基础。
1 实验部分 1.1 实验原料和仪器 1.1.1 实验原料六水合氯化铁(FeCl3·6H2O)、无水乙酸钠(NaAc)、乙二醇、聚乙二醇4000(PEG-4000)、1, 4-二氧六环、环氧氯丙烷(EPI)、亚氨基二乙酸(IDA)、硫酸镍(NiSO4),均为分析纯,国药集团化学试剂有限公司;双氧水(30% H2O2)、氯化钠(NaCl)、盐酸(HCl)、氢氧化钠(NaOH)、无水乙醇,均为分析纯,北京化工厂;蛋白Marker、4×蛋白上样缓冲液,北京Solarbio科技有限公司;蛋白胨、酵母浸粉、咪唑,北京奥博星生物技术有限责任公司;异丙基-β-D-硫代半乳糖苷(IPTG),纯度99%,上海源叶生物科技有限公司;限制性内切酶NdeⅠ和SacⅠ,New England Biolabs公司;E.coli BL21(DE3)、载体pET28a为本实验室保藏。
1.1.2 实验仪器SUPRA-55型扫描电子显微镜(SEM),德国ZEISS公司;Multiskan FC型酶标仪,Thermo Fisher科技有限公司;DYY-10C型电泳仪,北京市六一仪器厂;UV1810型紫外分光光度计,上海菁华科技仪器有限公司。
1.2 实验方法 1.2.1 Fe3O4@Ni粒子的制备对文献[14]的方法进行改进制备Fe3O4@Ni粒子,主要过程如下:将2.7 g FeCl3·6H2O溶于80 mL乙二醇中,添加7.2 g无水乙酸钠和2.0 g PEG-4000,磁力搅拌至均匀溶解。然后转移到聚四氟乙烯衬底的高压反应釜中,200 ℃保温8 h。通过磁性分离获得产物,分别用去离子水和乙醇洗涤数次,于60 ℃真空干燥过夜,得到磁性Fe3O4粒子。将0.5 g磁性Fe3O4粒子均匀分散在10 mL 1, 4-二氧六环和2 mL环氧氯丙烷中,于25 ℃、180 r/min保温4 h,磁性分离洗涤后,与20 mL IDA溶液(5%,pH7.0)和20 mL Na2CO3-NaHCO3缓冲液(0.1 mol/L,pH9.7)混合,并于37 ℃、250 r/min振荡反应24 h,用去离子水洗涤后加入到20 mL的1 mol/L NiSO4溶液中,于30 ℃、200 r/min孵育12 h。磁性分离后将反应产物用去离子水洗涤数次,得到Fe3O4@Ni粒子。
1.2.2 CAT基因工程菌的构建与表达根据美国生物信息数据库(NCBI)提供的CAT的katE的mRNA序列,设计引物(Kat-F:AAACATATGATGTCGCAACATAACGAAAAGAACCCACT-ACAGC,Kat-R:AAAGAGCTCTCAGGCAGGAATT-TTGTCAATCTTAGGAATGC),以E.coli BL21(DE3)基因组为模板进行PCR扩增,并对目的基因和载体pET28a-His进行NdeⅠ和SacⅠ双酶切,以构建质粒pET28a-katE,该质粒表达氨基端和羧基端各带有6×His Tag的CAT,即2×6×His CAT。E.coli BL21(DE3)用作表达该CAT的宿主菌。
将携带pET28a-katE质粒的E.coli BL21(DE3)过夜培养后接种到含有50 μg/mL卡那霉素的LB培养基中,于37 ℃、200 r/min振荡培养。当600 nm波长下测定的光密度值(OD600)达到0.6~0.8时,加入IPTG,于30 ℃、200 r/min培养8 h,诱导CAT表达。培养结束后,3 600×g离心30 min,收集沉淀,重悬于pH7.0的50 mmol/L磷酸盐缓冲液(PBS)中。将细胞进行超声波破碎,4 500×g冷冻离心20 min,得到的上清液即为CAT粗酶液,于4 ℃保存备用。
1.2.3 Fe3O4@Ni-CAT的制备将15 mL CAT溶液(1~2.25 mg/mL)在不同pH值(pH6.0~8.0的溶液由0.02 mol/L PBS缓冲液配制,pH9.0的溶液由0.02 mol/L甘氨酸- NaOH缓冲液配制)条件下分别加入0.025 g Fe3O4@Ni粒子,固定化时间为0.5~16 h。反应结束后通过磁场分离,用pH7.0的0.02 mol/L PBS洗涤数次,然后用0.2 mol/L咪唑缓冲液洗涤,冷冻干燥,得到固定化酶Fe3O4@Ni-CAT。
1.2.4 Fe3O4@Ni-CAT的表征采用扫描电子显微镜观察样品的微观形貌并使用mapping方法进行表面元素分析;采用电泳仪对样品进行十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(SDS-PAGE),方法如下:配制电泳胶(5%浓缩胶和10%分离胶)和电泳液,将10 μL游离酶、0.02 g Fe3O4@Ni-CAT分别与40 μL 4×上样缓冲液混合,在90 ℃水浴中加热10 min,取样10 μL和Maker 5 μL分别上样,使用电泳仪进行SDS-PAGE,电泳条件为120 V、50 mA,时间为90 min。
1.2.5 CAT固定化量的测定采用Bradford法[15]检测Fe3O4@Ni-CAT的固定化量。使用酶标仪测定固定化前后酶液在595 nm波长处的吸光度A595,按照式(1)计算CAT固定化量。
| $D=\frac{\left(A_1-A_2\right) N}{k m}$ | (1) |
式中:D为CAT固定化量,A1、A2分别为固定化前后酶液的吸光度A595,k为蛋白标准曲线的斜率,N为稀释倍数,m为Fe3O4@Ni的质量。
1.2.6 游离CAT和Fe3O4@Ni-CAT酶活性的测定CAT及Fe3O4@Ni-CAT的活性检测机理为其催化降解H2O2导致在240 nm波长处的吸光度(A240)下降[16]。CAT酶活力定义:在一定条件下,每分钟分解1 μmol H2O2所需要的酶量为1 U。相对酶活定义为某一反应条件下酶的活性与相同反应条件下酶的最大活性的比值。
游离CAT活性的测定室温条件下,将0.3 mL CAT溶液加入到9.7 mL浓度为20 mmol/L的H2O2溶液反应体系中,迅速混匀,倒入石英比色杯中,使用紫外可见分光光度计于240 nm波长处测定吸光度,每隔0.5 min读数1次,共测定2 min。
Fe3O4@Ni-CAT活性的测定室温条件下,将0.025 g Fe3O4@Ni-CAT加入到10 mL浓度为20 mmol/L的H2O2溶液反应体系中,迅速混匀,其他操作同“游离CAT活性的测定”。
1.2.7 游离CAT和Fe3O4@Ni-CAT的动力学参数测定在pH7.0、25 ℃的条件下,分别测量系列浓度(5~30 mmol/L)的H2O2溶液的反应速率,根据米氏方程(式(2))计算游离CAT和固定化CAT的动力学参数Vmax和Km。
| $\frac{1}{V}=\frac{K_{\mathrm{m}}}{V_{\max }} \frac{1}{[\mathrm{~S}]}+\frac{1}{V_{\max }}$ | (2) |
式中:V为CAT催化反应的初速度,[S]为底物浓度,Vmax为最大反应速度,Km为Michaelis-Menten常数。
1.2.8 Fe3O4@Ni-CAT对H2O2清除反应条件优化通过响应面法(RSM)优化Fe3O4@Ni-CAT催化清除H2O2的反应条件。选取反应温度(A)、溶液pH(B)和底物H2O2浓度(C)为影响因素,以H2O2清除率作为响应值,采用Box-Behnken中心组合实验设计(BBD)研究Fe3O4@Ni-CAT对H2O2清除反应的影响,确定最佳反应条件。各因素的编码水平如表 1所示,其中pH5.0的溶液由0.02 mol/L柠檬酸- 柠檬酸钠缓冲液配制,pH7.0的溶液由0.02 mol/L PBS配制,pH9.0的溶液由0.02 mol/L甘氨酸- NaOH缓冲液配制。
| 下载CSV 表 1 各因素的编码水平 Table 1 Coding levels of the experimental factors |
在设定的条件下,将0.025 g Fe3O4@Ni粒子与10 mL H2O2溶液反应,测定反应前后H2O2溶液在240 nm波长下的吸光度(A240),按照式(3)计算H2O2清除率。
| $R=\frac{x_1-x_2}{x_1-b} \times 100 \%$ | (3) |
式中:R为H2O2清除率,x1、x2分别为反应前后H2O2溶液的吸光度A240,b为H2O2标准曲线的截距。
1.2.10 Fe3O4@Ni-CAT的可重复利用性测定Fe3O4@Ni-CAT在40 ℃、pH6.4的条件下催化H2O2反应,然后通过磁性分离,用去离子水洗涤3次。将回收的Fe3O4@Ni-CAT重新添加到新鲜配制的H2O2溶液中进行催化反应,每批次反应时间为2 min。
2 结果与讨论 2.1 Fe3O4@Ni-CAT的表征结果图 1为Fe3O4、Fe3O4@Ni和Fe3O4@Ni-CAT的SEM图。可以看出,Fe3O4(图 1(a))和Fe3O4@Ni (图 1(b))的平均粒径为200~300 nm,且均具有良好的分散性。这是因为Fe3O4粒子经过小分子化学物质EPI、IDA化学修饰后键合Ni2+,全程没有大分子参与,也无聚合反应,所以Fe3O4@Ni的粒径无明显变化,无团聚现象发生。由图 1(c)可以看出,Fe3O4@ Ni-CAT的表面有些许附着物,也保持较好的单分散性,有利于催化反应进行。

|
图 1 Fe3O4、Fe3O4@Ni和Fe3O4@Ni-CAT的SEM图 Fig.1 SEM images of Fe3O4, Fe3O4@Ni and Fe3O4@Ni-CAT |
对蛋白质的标志元素N进行SEM-mapping分析,结果如图 2所示。可以看出,Fe3O4和Fe3O4@Ni仅有很弱的信号,而Fe3O4@Ni-CAT上的N元素分布较多,进一步说明CAT固定在Fe3O4@Ni粒子表面。
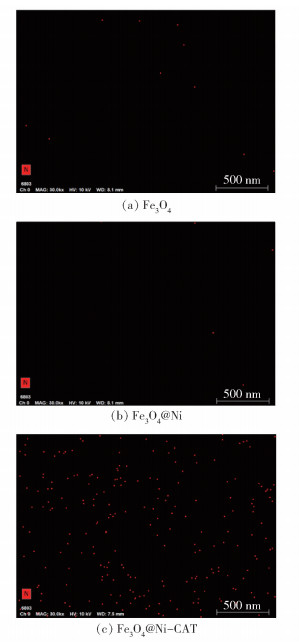
|
图 2 Fe3O4、Fe3O4@Ni和Fe3O4@Ni-CAT的N元素SEM-mapping图 Fig.2 SEM-mapping images of N element in Fe3O4, Fe3O4@Ni and Fe3O4@Ni-CAT |
目的基因katE的大小为2 262 bp,加上CAT的氨基端和羧基端分别连接的6×His,理论上表达出的蛋白分子量约为90 kDa。对游离CAT和Fe3O4@Ni-CAT进行SDS-PAGE分析,结果如图 3所示。CAT和Fe3O4@Ni-CAT在90 kDa左右出现了明显的条带,与预期结果一致,证明CAT成功表达并固定在Fe3O4@Ni上。带有2×6×His的CAT通过His上的咪唑基与Fe3O4@Ni粒子的Ni2+之间的金属螯合作用固定,使得粒子对CAT具有高选择性。有文献报道在分离蛋白的过程中,通过金属螯合作用可以实现对组氨酸标签蛋白很好的选择性吸附[17]。

|
M—Marker,1—CAT粗酶液,2—Fe3O4@Ni-CAT,3—0.2 mol/L咪唑溶液洗涤后的Fe3O4@Ni-CAT。 图 3 游离CAT和Fe3O4@Ni-CAT的SDS-PAGE电泳图 Fig.3 SDS-PAGE electrophoretograms of free CAT and Fe3O4@Ni-CAT |
在CAT质量浓度为1.8 mg/mL、固定化反应时间为14 h的条件下,考察了pH对CAT固定化量和酶活性的影响,结果如图 4所示。可以看出,Fe3O4@ Ni-CAT的固定化酶量随着pH的增大呈现先升高后降低的趋势,在pH为7.0时固定化酶量最大。这是因为:CAT的等电点为6.5[18],pH为7.0时带负电的CAT和带正电的Ni2+更容易结合,之后通过酶之间的吸附作用进行结合[18];随着pH继续增大,带电荷量的增加不利于酶之间的吸附,使得固定化酶量降低[19-20]。Fe3O4@Ni-CAT的酶活性在pH为6.5~7.5保持较高水平,之后酶活性随着pH的升高而急剧下降。这是因为:pH值的改变会影响酶活性中心有关基团的解离程度,在偏离最适pH时其解离程度不利于酶和底物的结合,导致酶活性下降[21];同时过高或过低的pH会影响酶本身的构像,甚至导致酶的失活[22]。综合考虑固定化酶量和酶活性,本研究选择固定化反应溶液pH值为7.0。
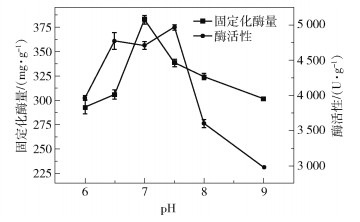
|
图 4 pH对CAT固定化量和Fe3O4@Ni-CAT活性的影响 Fig.4 Effect of pH on CAT immobilization amount and Fe3O4@Ni-CAT activity |
在pH为7.0、固定化反应时间为10 h的条件下,考察了CAT质量浓度对CAT固定化量和酶活性的影响,结果如图 5所示。可以看出,随着CAT质量浓度的升高,Fe3O4@Ni-CAT的固定化酶量逐渐增大,而酶活性呈现先升高后略微下降的趋势,这是因为虽然酶质量浓度升高使固定化酶量增多,但空间位阻增加,酶活性中心难以与底物充分接触反应,从而降低了酶催化活性[23]。综合考虑酶固定化量和酶活性,本研究选择固定化反应的CAT质量浓度为1.75 mg/mL。
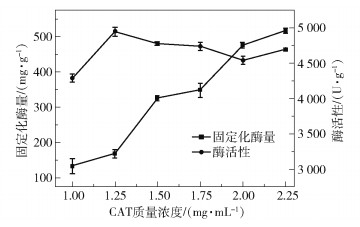
|
图 5 CAT质量浓度对CAT固定化量和Fe3O4@Ni-CAT活性的影响 Fig.5 Effect of CAT mass concentration on CAT immobilization amount and Fe3O4@Ni-CAT activity |
在pH为7.0、CAT质量浓度为1.75 mg/mL的条件下,考察了固定化时间对CAT固定化量和酶活性的影响,结果如图 6所示。可以看出,反应30 min时,Fe3O4@Ni-CAT的固定化酶量为168.46 mg/g,固定化酶量随着固定化时间的增加而增加,在16 h时达到408.71 mg/g。Fe3O4@Ni-CAT的酶活性也随着固定化时间的延长而增大,在12 h时达到最高(4 946 U/g),此时CAT固定化酶量可达376.13 mg/g,保持在较高水平。随着固定化时间继续延长,CAT固定化量持续增加,但酶活性略有下降,可能的原因是:固定化时间延长会影响酶活性;随着固定化酶量增加,酶分子之间的相互作用阻碍了酶活性中心与底物分子的结合。综合考虑固定化效果,本研究选择固定化反应时间为12 h。

|
图 6 固定化时间对CAT固定化量和Fe3O4@Ni-CAT活性的影响 Fig.6 Effect of immobilization time on CAT immobilization amount and Fe3O4@Ni-CAT activity |
综上所述,通过对CAT固定化条件进行优化,得到最佳反应条件:反应溶液pH值为7.0,CAT质量浓度为1.75 mg/mL,反应时间为12 h。表 2为本研究与文献报道的CAT固定化效果的比较,结果表明,本研究的CAT固定化效果优于目前的文献报道。
| 下载CSV 表 2 本研究与文献报道的CAT固定化效果比较 Table 2 Comparison of immobilization effects on CAT between this study and those reported in the literature |
图 7为不同H2O2浓度下游离CAT和Fe3O4@Ni-CAT的Lineweaver-Burk双倒数曲线,根据双倒数曲线得到游离CAT和Fe3O4@Ni-CAT的Km和Vmax(表 3)。结果表明,与游离CAT相比,Fe3O4@Ni-CAT对底物的亲和力降低,最大反应速率减小,这是由于固定化酶分子在反应体系中的分散性降低,与底物分子结合的机会减少,以及与溶质之间的传质阻力造成的[7, 10]。
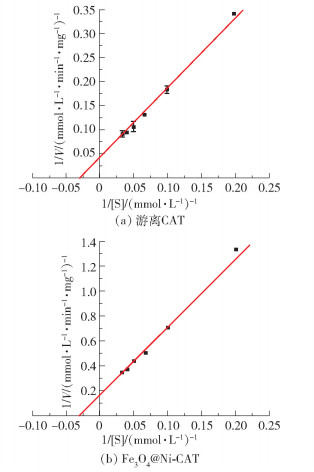
|
图 7 游离CAT和Fe3O4@Ni-CAT的双倒数曲线 Fig.7 Double reciprocal curves of free CAT and Fe3O4@Ni-CAT |
| 下载CSV 表 3 游离CAT和Fe3O4@Ni-CAT的动力学参数 Table 3 Kinetic parameters for free CAT and Fe3O4@Ni-CAT |
在10~60 ℃下,将Fe3O4@Ni-CAT和游离CAT在PBS缓冲液(pH7.0,0.02 mol/L)中孵育2 h,测定其热稳定性。分别以未经处理的Fe3O4@Ni-CAT和游离CAT的酶活性作为100%,计算得到其相对酶活性,结果如图 8所示。游离CAT在20 ℃处理2 h,相对活性最大,之后随着温度的升高活性逐渐下降,60 ℃时相对酶活性仅为29%。而Fe3O4@Ni-CAT在30 ℃时的热稳定性最高,相对酶活性达到约98%,在50 ℃以下处理时相对酶活性均超过85%。因此,Fe3O4@Ni-CAT比游离CAT具有更高的热稳定性。
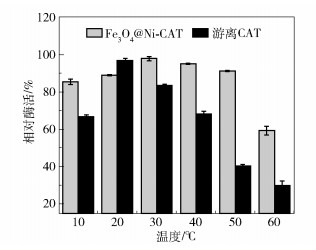
|
图 8 Fe3O4@Ni-CAT和游离CAT的热稳定性比较 Fig.8 Comparison of thermal stability between Fe3O4@Ni-CAT and free CAT |
将Fe3O4@Ni-CAT和游离CAT在4 ℃条件下储藏,每隔2 d测定其酶活性,评价其储存稳定性。分别以新制备的Fe3O4@Ni-CAT和游离CAT的酶活作为100%,计算得到相对酶活性,结果如图 9所示。随着储存时间延长,Fe3O4@Ni-CAT和游离CAT的酶活性均下降,但Fe3O4@Ni-CAT的储存稳定性明显高于游离CAT。游离CAT在储存2 d、4 d、6 d和12 d时相对酶活性分别为86%、64%、45%和21%;而Fe3O4@Ni-CAT较大程度地改善了CAT的储存稳定性,在储存2 d、4 d、6 d和12 d时其相对酶活性分别为94%、84%、60%和43%。
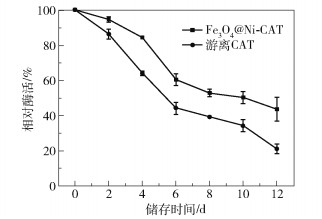
|
图 9 Fe3O4@Ni-CAT和游离CAT的储存稳定性比较 Fig.9 Comparison of storage stability between Fe3O4@Ni-CAT and free CAT |
通过响应面法,采用3因素3水平的优化实验研究反应温度、溶液pH和底物H2O2的浓度对Fe3O4@ Ni-CAT清除H2O2效果的影响,结果见表 4。
| 下载CSV 表 4 响应面设计与实验结果 Table 4 Response surface design and experimental results |
使用Design-Expert软件进行方差分析和显著性检验,结果见表 5。该模型的显著性检验P值<0.001,说明具有统计学意义。失拟项的P值>0.05,说明失拟不显著,该模型选择合适。
| 下载CSV 表 5 响应面的方差分析 Table 5 Analysis of variance for response surface |
通过响应面回归分析获得多元二次方程如下:Y=81.19+6.37A-3.12B-4.62C+4.60AB+4.60AC+2.87BC-1.53A2-9.30B2-11.10C2,决定系数R2=0.956 4,说明该方程的拟合性较好,可用于分析Fe3O4@CAT催化H2O2反应的最佳条件。根据上述回归方程,得到Fe3O4@Ni-CAT的最佳催化反应条件:反应温度为40 ℃,溶液pH为6.4,底物H2O2的浓度为14.5 mmol/L。在优化条件下响应面拟合出H2O2的清除率为83.63%,通过实验测得H2O2的清除率为84.32%,与拟合结果基本一致,说明该优化方法和结果适用于该催化反应。
2.6 Fe3O4@Ni-CAT的可重复利用性在最佳催化反应条件下考察Fe3O4@Ni-CAT催化清除H2O2的可重复利用性。将首次测得的H2O2清除率设定为100%,计算得到H2O2相对清除率,结果如图 10所示。当重复利用5批次时,H2O2相对清除率保持在86.25%;当重复利用10批次时,H2O2相对清除率保持在69.07%。结果表明该固定化酶具有较好的可重复利用性。
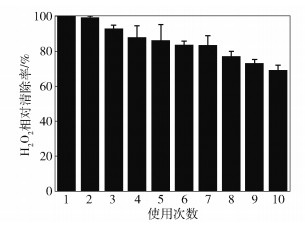
|
图 10 Fe3O4@Ni-CAT的可重复利用性 Fig.10 Reusability of Fe3O4@Ni-CAT |
本文采用溶剂热法制备了磁性Fe3O4粒子,通过对其表面修饰Ni2+得到单分散酶固定化介质Fe3O4@ Ni;通过基因工程改造获得氨基端和羧基端各修饰一个6×His的CAT,Fe3O4@Ni通过金属离子螯合作用与该酶选择性结合,成功制得Fe3O4@Ni-CAT,并测定了其催化活性,所得结论如下:
(1) 对Fe3O4@Ni-CAT的固定化条件进行优化,得到最佳条件:溶液pH为7.0,CAT质量浓度为1.75 mg/mL,固定化时间为12 h。在此条件下,固定化酶量可达376.13 mg/g,酶活性可达4 946 U/g,Fe3O4@Ni-CAT表现出较高的酶负载量和良好的催化活性。
(2) 与游离CAT相比,Fe3O4@Ni-CAT具有较高的热稳定性和储存稳定性;采用响应面法对Fe3O4@Ni-CAT的催化反应条件进行优化,得到最佳条件:反应温度为40 ℃,溶液pH为6.4,底物H2O2的浓度为14.5 mmol/L。在此条件下,测得H2O2的清除率可达84.32%,并且该固定化酶表现出良好的可重复使用性。
| [1] |
ESEN E, ÖZTÜRK S, ERTUĞRUL UYGUN H D, et al. Cibacron blue F3GA incorporated immobilized metal chelate affinity sorbent as a high efficient affinity immobilization materials for catalase enzyme[J]. Colloids and Surfaces B: Biointerfaces, 2021, 206: 111911. DOI:10.1016/j.colsurfb.2021.111911 |
| [2] |
INANAN T, TVZMEN N, KARIPCIN F. Oxime-functionalized cryogel disks for catalase immobilization[J]. International Journal of Biological Macromolecules, 2018, 114: 812-820. DOI:10.1016/j.ijbiomac.2018.04.006 |
| [3] |
GRIGORAS A G. Catalase immobilization: a review[J]. Biochemical Engineering Journal, 2017, 117: 1-20. |
| [4] |
刘灵芝, 钟广蓉, 熊莲, 等. 过氧化氢酶的研究与应用新进展[J]. 化学与生物工程, 2009, 26(3): 15-18. LIU L Z, ZHONG G R, XIONG L, et al. Research and application progress of catalase[J]. Chemistry & Bioengineering, 2009, 26(3): 15-18. (in Chinese) DOI:10.3969/j.issn.1672-5425.2009.03.004 |
| [5] |
ARABACI G, USLUOGLU A. Catalytic properties and immobilization studies of catalase from Malva sylvestris L.[J]. Journal of Chemistry, 2013, 2013: 686185. |
| [6] |
KAUSHAL J, SEEMA, SINGH G, et al. Immobilization of catalase onto chitosan and chitosan-bentonite complex: a comparative study[J]. Biotechnology Reports, 2018, 18: e00258. DOI:10.1016/j.btre.2018.e00258 |
| [7] |
WU H, LIANG Y P, SHI J F, et al. Enhanced stability of catalase covalently immobilized on functionalized titania submicrospheres[J]. Materials Science and Engineering: C, 2013, 33(3): 1438-1445. DOI:10.1016/j.msec.2012.12.048 |
| [8] |
CUI J D, FENG Y X, JIA S R. Silica encapsulated catalase@metal-organic framework composite: a highly stable and recyclable biocatalyst[J]. Chemical Engineering Journal, 2018, 351: 506-514. DOI:10.1016/j.cej.2018.06.121 |
| [9] |
ALI A, ZAFAR H, ZIA M, et al. Synthesis, characterization, applications, and challenges of iron oxide nanoparticles[J]. Nanotechnology, Science and Applications, 2016, 9: 49-67. DOI:10.2147/NSA.S99986 |
| [10] |
WANG H M, WANG J, WANG J W, et al. Spectroscopic method for the detection of 2, 4-dichlorophenoxyacetic acid based on its inhibitory effect towards catalase immobilized on reusable magnetic Fe3O4-chitosan nanocomposite[J]. Sensors and Actuators B: Chemical, 2017, 247: 146-154. DOI:10.1016/j.snb.2017.02.175 |
| [11] |
IBRAHIM ALHAYALI N, KALAYCIOĞLU ÖZPOZAN N, DAYAN S, et al. Catalase/Fe3O4@Cu2+ hybrid biocatalytic nanoflowers fabrication and efficiency in the reduction of organic pollutants[J]. Polyhedron, 2021, 194: 114888. DOI:10.1016/j.poly.2020.114888 |
| [12] |
ALI A O, ALI K A, SHAHEIN Y E, et al. Epoxy functionalized iron oxide magnetic nanoparticles for catalase enzyme covalent immobilization[J]. Chemical Papers, 2022, 76: 4431-4441. DOI:10.1007/s11696-022-02180-6 |
| [13] |
WANG L, CHEN G, ZHAO J, et al. Catalase immobilization on amino-activated Fe3O4@SiO2 nanoparticles: loading density affected activity recovery of catalase[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 133: S468-S474. DOI:10.1016/j.molcatb.2017.03.011 |
| [14] |
LIU C X, YANG Y D, GUO H F, et al. Preparation and enzymatic activity of Fe3O4-IDA-Ni/NAD kinase magnetic catalyst[J]. Korean Journal of Chemical Engineering, 2020, 37(3): 475-481. DOI:10.1007/s11814-019-0472-y |
| [15] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254. |
| [16] |
BEERS R F, SIZER I W. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase[J]. Journal of Biological Chemistry, 1952, 195(1): 133-140. DOI:10.1016/S0021-9258(19)50881-X |
| [17] |
朱音谛. 功能化磁性纳米粒子的制备及在组氨酸标签蛋白分离纯化中的应用[D]. 马鞍山: 安徽工业大学, 2020. ZHU Y D. Preparation of functional magnetic nanoparticles and their application in separation and purification of histidine-tagged proteins[D]. Ma'anshan: Anhui University of Technology, 2020. (in Chinese) |
| [18] |
MÖRIKOFER-ZWEZ S, VON WARTBURG J P, AEBI H. Heterogeneity of erythrocyte catalase: variability of the isoelectric point[J]. Experientia, 1970, 26(9): 945-947. DOI:10.1007/BF02114120 |
| [19] |
袁宇航. 铜基金属有机骨架材料固定漆酶及其催化双酚A的降解研究[D]. 广州: 华南理工大学, 2021. YUAN Y H. Immobilization of laccase on Cu-based metal organic frameworks and its catalytic degradation of bisphenol A [D]. Guangzhou: South China University of Technology, 2021. (in Chinese) |
| [20] |
张丽萍. 多孔壳聚糖磁性微球的制备及对固定化木聚糖酶的研究[D]. 黄石: 湖北师范学院, 2011. ZHANG L P. Preparation of porous chitosan magnetic microspheres and study on magnetic microspheres immobilized xylanase [D]. Huangshi: Hubei Normal University, 2011. (in Chinese) |
| [21] |
杨树林, 孟广荣, 曾亮亮. pH值对纤维素酶系内切β-葡聚糖苷酶活力影响的酶催化动力学模型[J]. 南京理工大学学报(自然科学版), 2006, 30(1): 92-96. YANG S L, MENG G R, ZENG L L. Enzyme catalysis kinetic model of pH effect on activity of endo-β-glucanase[J]. Journal of Nanjing University of Science and Technology (Natural Science Edition), 2006, 30(1): 92-96. (in Chinese) |
| [22] |
DE OLIVEIRA CARVALHO J, FRANCA ORLANDA J F. Heat stability and effect of pH on enzyme activity of polyphenol oxidase in buriti (Mauritia flexuosa Linnaeus f.) fruit extract[J]. Food Chemistry, 2017, 233: 159-163. DOI:10.1016/j.foodchem.2017.04.101 |
| [23] |
AKHOND M, PASHANGEH K, KARBALAEI-HEIDARI H R, et al. Efficient immobilization of porcine pancreatic α-amylase on amino-functionalized magnetite nanoparticles: characterization and stability evaluation of the immobilized enzyme[J]. Applied Biochemistry and Biotechnology, 2016, 180(5): 954-968. DOI:10.1007/s12010-016-2145-1 |
| [24] |
LI J, LI L S, XU L. Hierarchically macro/mesoporous silica spheres for catalase immobilization and catalysis[J]. Materials Letters, 2017, 193: 67-69. DOI:10.1016/j.matlet.2017.01.091 |
| [25] |
EROL K, CEBECI B K, KÖSE K, et al. Effect of immobilization on the activity of catalase carried by poly(HEMA-GMA) cryogels[J]. International Journal of Biological Macromolecules, 2019, 123: 738-743. DOI:10.1016/j.ijbiomac.2018.11.121 |
| [26] |
HE L, LAN W T, CEN L, et al. Improving catalase stability by its immobilization on grass carp (Ctenopharyngodon idella) scale collagen self-assembly films[J]. Materials Science and Engineering: C, 2019, 105: 110024. DOI:10.1016/j.msec.2019.110024 |
| [27] |
陈军. 壳聚糖固定化过氧化氢酶在清除卷烟烟气自由基等有害物质中的应用[D]. 无锡: 江南大学, 2006. CHEN J. Application of catalase immobilized by chitosan in scavenging toxicants as free radicals in cigarette smoke[D]. Wuxi: Jiangnan University, 2006. (in Chinese) |








