2. 北京化工大学 生命科学与技术学院, 北京 100029
2. College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China
白色念珠菌(Candida albicans)感染引起的阴道炎(vulvovaginal candidiasis, VVC)是一种常见的妇科疾病,长期以来困扰着众多女性[1]。阴道环境的改变是引起念珠菌致病的先决条件之一,抗生素的滥用可改变阴道内的菌群比例,使微生物之间的制约关系失调,念珠菌得以繁殖而引起感染[2]。近年来随着抗生素及皮质类固醇药物的普遍应用,VVC发病率在世界各地呈明显上升趋势,严重影响女性的工作和生活[3]。目前,对VVC的治疗方案大多采用简单的抗生素(如咪康唑栓剂、氟康唑栓剂)杀菌,虽然抗生素可有效杀死有害菌,但很难对VVC达到根治的目的,而且容易带来新的抗生素滥用的风险[4]。
一些研究者从中医湿热的理念出发,采用传统中草药配方对VVC进行治疗,发现传统中药对人体的伤害较小,疾病不易复发,有望从源头消除致病因素[5]。目前,越来越多的植物精油和天然产物被发掘出来,从中药和天然产物的角度治疗VVC逐渐受到广泛关注。黄晓敏等[6]发现2.5%(体积分数)的阴香精油可以抑制白色念珠菌生物膜的形成,作用90 min能够完全清除培养7 d的白色念珠菌生物膜;孙盛梅等[7]利用蛇床子提取物对小鼠阴道菌群失调模型进行治疗,治疗后白色念珠菌和大肠杆菌的存活率显著降低,并且对乳酸杆菌(Lactobacillus sp.)的生长无抑制作用。目前,采用中药对VVC治疗的相关研究主要集中在单方精油的抑菌效果方面,而对于精油与天然产物复配体系的研究较少。此外,药物在杀除有害菌的同时对体内原有微生态环境的影响在大多研究中也未被重视。
本研究利用实验室自有技术制备了精油微乳液,评价了精油和天然产物单独使用对白色念珠菌的抑菌作用,然后将抑菌效果较好的精油和天然产物进行复配,研究了复合配方对白色念珠菌和有益菌群(乳酸杆菌)的抑菌效果。
1 实验部分 1.1 实验材料 1.1.1 供试菌种白色念珠菌菌种编号ATCC 10231,购自北京北纳创联生物技术研究院(BNCC)。菌落形状为圆形,直径1~2 mm,呈乳白色。中间凸起,边缘整齐,表面明亮光滑,不透明。
乳酸杆菌本实验室保存。菌落形状为圆形,直径约2 mm,呈乳白色。中间凸起,边缘整齐,表面粗糙无光泽,半透明。
1.1.2 精油与天然产物精油香桃木(Myrtus communis Linn.)、白千层(Melaleuca leucadendron L.)、广藿香(Pogostemon cablin)、薰衣草(Lavandula angustifolia Mill.)、蛇床子(Cnidium monnieri (L.) Cuss.)、柠檬香茅(Cymbopogon citratus),北京花眷芳香科技有限公司。
天然产物黄连(Coptis chinensis Franch.)提取物、甘草(Glycyrrhiza uralensis Fisch.)提取物、厚朴(Magnolia officinalis)提取物,辰风天然本草(北京)科技有限公司;KHC20抑菌剂(复配天然产物抑菌剂),本实验室自制。
1.1.3 培养基YPD培养基酵母膏3.0 g,麦芽提取物3.0 g,葡萄糖10.0 g,蛋白胨5.0 g,琼脂20.0 g,去离子水1 000 mL。pH调至6.2±0.2,121 ℃灭菌20 min,用于白色念珠菌培养。
MRS培养基葡萄糖20.0 g,蛋白胨10.0 g,牛肉浸取物10.0 g,酵母提取液5.0 g,乙酸钠5.0 g,柠檬酸氢二胺2.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.2 g,去离子水1 000 mL。pH调至6.3±0.1,121 ℃灭菌20 min,用于乳酸杆菌培养。
1.1.4 其他试剂增溶剂PEG2000,德国巴斯夫公司(BASF);Resazurin,北京索莱宝科技有限公司;无水乙醇、氯化钠,分析纯,北京化工厂。
1.2 实验仪器HZQ-R型恒温振荡器,哈尔滨市东联电子技术开发有限公司;DF-101S型集热式搅拌器,金坛市科析仪器有限公司;GL224i-1SCN型分析天平,赛多利斯科学仪器有限公司;SPX-250B型生化培养箱,天津市泰斯特仪器有限公司;YT-CJ-2N型超净工作台,北京亚泰科隆仪器技术有限公司;UV-5100型紫外可见分光光度计,上海元析仪器有限公司;LDZX-50KB型立式压力蒸汽灭菌器,上海申安医疗器械厂。
1.3 实验方法 1.3.1 供试药液的制备精油微乳液称取12 g PEG2000于无菌试剂瓶中,搅拌滴加4 g植物精油,并加入34 mL无菌水,密封后搅拌60 min,体系均一后放入4 ℃冰箱中保存。
天然产物提取物溶液称取50 mg天然产物提取物于无菌离心管中,加入3 mL 80%乙醇,在恒温振荡器中以200 r/min的转速震荡24 h,完全溶解后于室温下保存。
复方微乳液根据配方(按50 mL计),将质量比为3 ∶1的PEG2000和植物精油加入无菌试剂瓶中,在搅拌下滴加天然产物提取物溶液,并加入无菌水补至50 mL,密封后搅拌60 min,体系均一后放入4 ℃冰箱中保存。
1.3.2 菌悬液的制备对白色念珠菌、乳酸杆菌进行菌种活化后,分别在28 ℃、37 ℃的条件下培养24 h。使用紫外可见分光光度计在500 nm波长下测定菌悬液的吸光度,稀释后的菌悬液吸光度控制在0.140±0.005,其对应的菌悬液浓度约为106 CFU/mL。
1.3.3 平板抑菌试验抑菌圈直径将直径6 mm的无菌圆形滤纸片置于精油微乳液中浸泡2 h。取100 μL白色念珠菌菌悬液接种到YPD培养基表面,涂布均匀。然后将浸泡过的滤纸片紧贴在平板上,各滤纸间的距离均等。在28 ℃的生化培养箱中培养,24 h后观察结果,测量抑菌圈直径。
抑菌率向无菌平板中加入20 mL YPD培养基,水平静置凝固后吸取100 μL白色念珠菌菌悬液并接种到平板上,滴加100 μL精油微乳液、天然产物提取物或复方微乳液,涂布均匀。对于阴性对照组,吸取菌液和生理盐水各100 μL。在28 ℃的生化培养箱中培养,24 h后观察结果,对每个平板上的菌落进行计数,并根据下式计算抑菌率R。
| $ R=\frac{N_{\mathrm{c}}-N_{\mathrm{t}}}{N_{\mathrm{c}}} \times 100 \% $ |
式中:Nc为阴性对照组的平均菌落数,Nt为试验组的平均菌落数。
1.3.4 Resazurin试剂的制备活细胞中存在乳酸脱氢酶,可将Resazurin(蓝色)转化为荧光物质Resorufin(粉红色),Resorufin可进一步被还原为无荧光物质(无色),无活性或死亡的细胞由于无代谢能力而不能还原Resazurin[8]。据此原理,可以使用Resazurin显色法根据颜色的变化判断样品是否具有抑菌能力。其中,蓝色、紫红色、粉红色分别代表抑菌作用强、抑菌作用弱、无抑菌作用。Resazurin试剂的制备方法为:称取Resazurin固体50 mg,配制1 mg/mL溶液,于4 ℃避光保存。
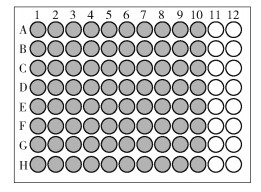
1.3.5 最小抑菌浓度(MIC)的测定本实验采用96孔板微量稀释法[9]测定供试药液对供试菌种的最小抑菌浓度,96孔板装样孔位如图 1所示。
|
图 1 96孔板微量稀释法装样孔位示意图 Fig.1 Diagram of the sampling hole positions in the 96-well plate by microdilution method |
(1) 在96孔无菌平板中,采用对倍稀释法稀释药液。向A2~A10孔中加入100 μL生理盐水,将200 μL药液加入A1孔中混匀,从A1孔中吸取100 μL药液至A2孔,混匀后,从A2孔中吸取100 μL药液至A3孔,以此类推,直至A10孔。混匀后,从A10孔中吸弃100 μL药液。
(2) B~H行第1~10孔的加样过程同A行。
(3) A11~H11孔为阳性对照,每孔加入100 μL生理盐水和100 μL含液体培养基的菌悬液;A12~H12孔为阴性对照,每孔加入100 μL生理盐水和100 μL液体培养基。
(4) 在A~H行第1~10孔中加入100 μL含液体培养基的菌悬液。
(5) 另取96孔板作为颜色对照,重复(1)~(3)的操作,在A~H行第1~10孔中加入100 μL液体培养基。
(6) 加样完成后于培养箱中培养,白色念珠菌和乳酸杆菌的培养温度分别为28 ℃和37 ℃。24 h后,向所有孔中加入10 μL Resazurin指示剂,继续培养4 h后观察颜色变化。颜色变为粉红色表示有菌生长,颜色未变化则表示无菌生长。记录颜色发生变化的最低药液浓度,即为药液对供试菌种的MIC值。
1.3.6 精油和天然产物复配的抑菌效果测试为了进一步检验精油和天然产物联合使用的抑菌效果,首先使用浓度为10倍MIC的单方精油和单方天然产物进行平板涂布,测定抑菌率,根据其抑菌结果,筛选出抑菌效果较好的精油和天然产物。然后将精油和天然产物进行复配,通过不同抑菌机理的精油和天然产物的联用,探索二者协同增效的可能性,以增强最终复合配方的综合杀菌性能。例如,香桃木主要通过影响细胞壁和细胞膜的通透性,促进细胞内容物向胞外释放从而杀菌[10]。厚朴提取物则是通过促进细胞产生大量的活性氧,破坏细胞膜电位,从而抑制线粒体等细胞器的功能;此外,厚朴提取物还可以与细胞膜中的麦角甾醇结合,从而影响细胞通透性,加速细胞死亡[11]。二者合用可以增加细胞膜的通透性,同时抑制细胞壁形成。
2 结果与讨论 2.1 精油单独使用对白色念珠菌的抑菌圈直径表 1为精油单独使用对白色念珠菌的抑菌圈直径。可以看出,各精油微乳液对白色念珠菌的抑菌能力由强到弱依次为:柠檬香茅>香桃木>薰衣草>白千层>广藿香>蛇床子。3组空白辅料对照(生理盐水、80%乙醇、增溶剂PEG2000)均无抑菌作用,表明辅料对实验结果没有干扰。
| 下载CSV 表 1 精油单独使用对白色念珠菌的抑菌圈直径 Table 1 Bacteriostatic ring diameter of the essential oils used alone against Candida albicans |
使用96孔板微量稀释法测定精油和天然产物单独使用对白色念珠菌的MIC值,结果如表 2所示。可以看出,所测试的4种天然产物提取物对白色念珠菌的MIC值明显小于6种精油微乳液,而厚朴提取物的MIC值远小于其他3种天然产物提取物,说明在相同条件下其抑菌能力最强,可以优先考虑厚朴提取物作为复合配方的主要添加成分。
| 下载CSV 表 2 精油和天然产物单独使用对白色念珠菌的MIC值 Table 2 MIC values of the essential oils and natural products used alone against Candida albicans |
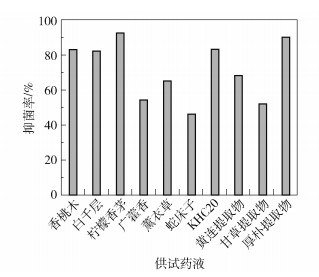
单独使用10倍MIC的精油和天然产物对白色念珠菌进行平板涂布,测定抑菌率,结果如图 2所示。结果显示,供试药液单独使用对白色念珠菌的抑制效果存在较大差异:白色念珠菌对柠檬香茅和厚朴提取物均表现为高度敏感,24 h的抑菌试验中其抑菌率分别为92%和90%;香桃木、白千层和KHC20抑菌剂的抑菌效果次之,抑菌率均达到80%以上;相比之下,白色念珠菌对广藿香、蛇床子和甘草提取物的敏感程度较低。
|
图 2 10倍MIC的精油和天然产物单独使用对白色念珠菌的涂布抑菌率 Fig.2 Coating inhibition rate of the essential oils and natural products with 10 times MIC used alone against Candida albicans |
根据2.1~2.3节的实验结果,初步筛选出抑菌圈较大、MIC值较小并且在10倍MIC条件下抑菌率高于80%的5种精油和天然产物:柠檬香茅、厚朴提取物、香桃木、白千层和KHC20抑菌剂,将其作为复合配方的抑菌组分。其中,白色念珠菌对厚朴提取物的敏感度极高,这与厚朴提取物通过影响细胞基因表达而抑制生物膜多糖的形成有关[12];柠檬香茅则是通过降低细胞膜脂质层的相变温度而影响膜脂的流动性[13]。二者对生物膜形成过程中不可或缺的生物大分子均存在抑制作用,因此考虑将其作为最主要的两种成分加入复合配方中,二者协同使用有望达到更佳的抑菌效果。而KHC20抑菌剂、香桃木、白千层分别对菌壁中的几丁质、多糖以及菌体中的蛋白质、核酸进行补充抑制[14]。
表 3为本实验设计的精油和天然产物复合配方。其中,选取0.6 mg/mL厚朴提取物为配方一、配方三、配方四的主要成分,20 mg/mL柠檬香茅为辅助成分;选取50 mg/mL柠檬香茅为配方二、配方五、配方六的主要成分,0.3 mg/mL厚朴提取物为辅助成分;KHC20抑菌剂、白千层和香桃木在各配方中辅助的主次关系也有所调整。
| 下载CSV 表 3 精油和天然产物的复合配方 Table 3 Compound formulation of the essential oils and natural products |
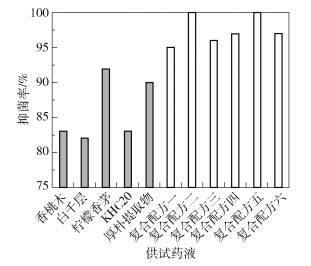
采用96孔板微量稀释法测得精油和天然产物的复合配方一至六对白色念珠菌的MIC值分别为:1.36、0.32、0.34、0.34、0.65、0.32 mg/mL。使用10倍MIC的复合配方对白色念珠菌进行平板涂布,测定抑菌率,10倍MIC复合配方与10倍MIC单方药液的抑菌率比较如图 3所示。结果显示,6种复合配方均比单方药液表现出更好的抑菌效果,表明精油和天然产物复配对抑菌存在协同增效作用。单方药液中柠檬香茅的抑菌效果最佳,在24 h的抑菌试验中抑菌率为92%,柠檬香茅与天然产物复配后可进一步提高其抑菌活性。白色念珠菌对6种复合配方均表现出高度敏感,敏感程度由高到低依次为:配方二>配方五>配方六>配方四>配方三>配方一,其中配方二与配方五的抑菌活性最强,在24 h的抑菌试验中可完全抑制白色念珠菌。
|
图 3 精油和天然产物复配后抑菌能力的协同增效作用 Fig.3 Synergistic effect of combination of essential oils and natural products on bacteriostasis |
考虑到有益菌在平衡阴道菌群中的重要地位,实验进一步评估了乳酸杆菌对复合配方的敏感程度,测定了复合配方对乳酸杆菌的抑菌活性,结果如表 4所示。在实验中发现,当使用10倍MIC的复合配方时,白色念珠菌表现出高度敏感,但是乳酸杆菌均可形成菌膜且生长良好,对复合配方表现不敏感。由表 4可知,乳酸杆菌对复合配方的敏感程度由高到低排序为:配方五=配方六>配方三=配方四>配方一>配方二。由于在实际情况中白色念珠菌和乳酸杆菌在同一环境下生长,故需要评估这两类菌种在相同条件下对复合配方的敏感度差异。白色念珠菌的10倍MIC与乳酸杆菌的MIC相差越大,表明白色念珠菌对复合配方越敏感,乳酸杆菌对复合配方越不敏感。结果显示,在96孔板微量稀释法的实验中,10倍MIC的配方一在高度抑制白色念珠菌的情况下也会一定程度地抑制乳酸杆菌生长,导致有益菌群被破坏;其他5种复合配方均可以保证在高度抑制白色念珠菌的情况下保护有益菌群不被破坏。综合比较来看,6种复合配方在抑制致病菌的同时保护有益菌的能力大小顺序为:配方二>配方三=配方四>配方六>配方五>配方一。
| 下载CSV 表 4 精油和天然产物的复合配方对供试菌种的MIC值 Table 4 MIC values of the compound formulation of the essentials oil and natural products against the tested strains |
(1) 与单独使用相比,精油和天然产物复配使用对白色念珠菌具有更强的抑制活性,实验所选用的5种精油及天然产物复配表现出协同增效作用。
(2) 筛选出对白色念珠菌抑制效果最佳、同时对乳酸杆菌抑制效果不显著的复合配方(配方二):柠檬香茅50 mg/mL、厚朴提取物0.3 mg/mL、白千层5 mg/mL、香桃木5 mg/mL、KHC20抑菌剂2 mg/mL。
本研究采用精油与天然产物的微乳液复配体系,在解决精油稳定性和溶解性问题的同时,增强了精油本身的抑菌效果,可以考虑作为精油类产物入方的通用方法。此外,天然产物不含有刺激性成分,并且具有较好的抑菌活性,在极大降低产品毒性的同时保证了抑菌效果。因此,本文开发的精油与天然产物复合配方有望成为治疗VVC等妇科疾病的核心活性成分,也为后续的体内实验及临床研究提供参考。
| [1] |
DE BERNARDIS F, GRAZIANI S, TIRELLI F, et al. Candida vaginitis: virulence, host response and vaccine prospects[J]. Medical Mycology, 2018, 56(Suppl 1): 26-31. |
| [2] |
戴晓晓, 杜珂珂, 赵静, 等. 乳杆菌活菌胶囊联合抗生素治疗细菌性阴道炎的疗效及复发情况分析[J]. 中国妇幼保健, 2020, 35(11): 2058-2060. DAI X X, DU K K, ZHAO J, et al. Analysis on curative effect and recurrence of living preparation of lactobacillus combined with antibiotic in treatment of bacterial vaginosis[J]. Maternal and Child Health Care of China, 2020, 35(11): 2058-2060. (in Chinese) |
| [3] |
DONDERS G G G, GRINCEVICIENE S, BELLEN GERT, et al. Is non-response to fluconazole maintenance therapy for recurrent Candida vaginitis related to sensitization to atopic reactions?[J]. American Journal of Reproductive Immunology, 2018, 79(14): e12811. |
| [4] |
赵继芳, 贾铮. 念珠菌性阴道炎及抗菌药物的研究进展[J]. 中外医学研究, 2013, 11(2): 152-154. ZHAO J F, JIA Z. Study progress on antifungal drugs of Candida vaginitis[J]. Chinese and Foreign Medical Research, 2013, 11(2): 152-154. (in Chinese) DOI:10.3969/j.issn.1674-6805.2013.02.115 |
| [5] |
李善举. 治疗妇科病应发挥中药优势——访北京大学人民医院妇产科主任魏丽惠[J]. 中国食品药品监管, 2013(3): 68-70. LI S J. The treatment of gynecological diseases should give full play to the advantages of traditional Chinese medicine: an interview with Wei Lihui, director of obstetrics and gynecology, Peking University People's Hospital[J]. China Food and Drug Administration Magazine, 2013(3): 68-70. (in Chinese) |
| [6] |
黄晓敏, 王晨明, 管文华, 等. 阴香植物精油对白色念珠菌生物膜的抑制研究[J]. 中国消毒学杂志, 2012, 29(8): 666-669. HUANG X M, WANG C M, GUAN W H, et al. Study on the inhibitory effects of essential oils on Candida albicans biofilm[J]. Chinese Journal of Disinfection, 2012, 29(8): 666-669. (in Chinese) |
| [7] |
孙盛梅, 温达静, 赵东旭, 等. 蛇床子提取物对小鼠阴道菌群影响的研究[J]. 黑龙江医药科学, 2020, 43(1): 188-189, 191. SUN S M, WEN D J, ZHAO D X, et al. Study on the effect of Fructus cnidii extract on vaginal flora in mice[J]. Heilongjiang Medicine and Pharmacy, 2020, 43(1): 188-189, 191. (in Chinese) |
| [8] |
李宙阳, 周英. 刃天青显色法检测铜绿假单胞菌对几种抗菌药物的敏感性[J]. 山地农业生物学报, 2010, 29(3): 237-241. LI Z Y, ZHOU Y. A resazurin-based assay for evaluation of anti-Pseudomonas aeruginosa drugs sensitivity[J]. Journal of Mountain Agriculture and Biology, 2010, 29(3): 237-241. (in Chinese) DOI:10.3969/j.issn.1008-0457.2010.03.010 |
| [9] |
ELSHIKH M, AHMED S, FUNSTON S, et al. Resazurin-based 96-well plate microdilution method for the determination of minimum inhibitory concentration of biosurfactants[J]. Biotechnology Letters, 2016, 38(6): 1015-1019. |
| [10] |
GIAMPIERI F, CIANCIOSI D, FORBES-HERNÁNDEZ T Y. Myrtle (Myrtus communis L.) berries, seeds, leaves, and essential oils: new undiscovered sources of natural compounds with promising health benefits[J]. Food Frontiers, 2020, 1(3): 276-295. |
| [11] |
燕银芳. 天然源和厚朴酚与异黄腐酚的抗菌活性评价及(和)厚朴酚的复配增效研究[D]. 兰州: 兰州大学, 2021. YAN Y F. Evaluation of antifungal activity of natural honokiol and isoxanthohumol, and synergistic effects of magnolol and honokiol[D]. Lanzhou: Lanzhou University, 2021. (in Chinese) |
| [12] |
谭珍媛, 邓家刚, 张彤, 等. 中药厚朴现代药理研究进展[J]. 中国实验方剂学杂志, 2020, 26(22): 228-234. TAN Z Y, DENG J G, ZHANG T, et al. Research progress in modern pharmacology of Magnolia officinalis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(22): 228-234. (in Chinese) |
| [13] |
胡林峰, 许明录, 朱红霞. 植物精油抑菌活性研究进展[J]. 天然产物研究与开发, 2011, 23(2): 384-391. HU L F, XU M L, ZHU H X. Advances in antifungal activity of plant essential oil[J]. Natural Product Research and Development, 2011, 23(2): 384-391. (in Chinese) |
| [14] |
王梁凤, 李慧婷, 陈青垚, 等. 中药挥发油抗菌作用的研究进展[J]. 中国中药杂志, 2021, 46(5): 1026-1033. WANG L F, LI H T, CHEN Q Y, et al. Research progress on antibacterial activity of herbal volatile oil[J]. China Journal of Chinese Materia Medica, 2021, 46(5): 1026-1033. (in Chinese) |








