2. 清华大学 环境学院 环境污染溯源与精细监管技术研究中心, 北京 100084;
3. 清华苏州环境创新研究院先进监管技术仪器研发中心, 苏州 215163;
4. 安徽建筑大学 水污染控制与废水资源化安徽省重点实验室, 合肥 230601
2. Research Center of Environmental Technology in Water Pollution Source Identification and Precise Supervision, School of Environment, Tsinghua University, Beijing 100084;
3. Research and Development Center of Advanced Environmental Supervision Technology and Instrument, Research Institute for Environmental Innovation (Suzhou), Tsinghua, Suzhou 215163;
4. Anhui Key Laboratory of Water Pollution Control and Wastewater Reuse, Anhui Jianzhu University, Hefei 230601, China
荧光分析法(fluorescence analysis)是利用分子被光照射后所发射的具有特征波长的荧光来进行定性或定量分析的方法,广泛应用于化学[1]、临床医学[2]、药学[3]和环境科学[4]等领域。在荧光分析法中,三维荧光光谱分析法因具有灵敏度高、检测限低、便捷快速等优点,在水体水质异常快速预警、水污染成因快速诊断及水污染溯源中展现出良好的应用前景[5-6]。在水体中,结构相似的有机污染物可能具有相近的三维荧光光谱,这为它们的精准溯源带来挑战。因此,深度挖掘荧光特征是精准识别结构相似的有机污染物的关键。
荧光寿命(fluorescence lifetime,τ)和荧光量子产率(fluorescence quantum yield,FQY)是荧光化合物的重要发光参数[7],可以用来区分取代基位置异构、构型异构、构象异构的同分异构体,例如区分D-色氨酸和L-色氨酸[8],证明2-氨基嘌呤的互变异构等[9]。荧光寿命和荧光量子产率对于揭示同分异构现象对分子荧光的影响机制以及同分异构体的精准识别具有重要作用[10]。
多环芳烃是存在于污水或天然水体中的常见有机污染物[11],具有较强的致畸、致癌、致突变作用。同时,取代基位置异构和苯环排布异构是多环芳烃中的常见异构现象。因此,选取多环芳烃作为研究对象可以较为清晰地探究同分异构现象对分子荧光的影响机理以及构建同分异构体精准识别的方法,具有较强的科学意义和工程价值。目前,已有相关研究报道了取代基位置异构对荧光特性的影响[12],但是苯环排布方式对多环芳烃分子荧光的影响机制尚不清楚,也未见通过荧光寿命和荧光量子产率实现多环芳烃同分异构体精准识别方法构建的相关报道。本研究选取同分异构体蒽和菲作为多环芳烃的典型代表,测定了它们的三维荧光光谱、荧光寿命和荧光量子产率,并结合量子化学计算,解析苯环排布异构对多环芳烃分子荧光的影响机制,为尝试构建多环芳烃同分异构体精准溯源的新方法奠定理论基础。
1 实验部分 1.1 实验材料蒽、菲,纯度>99%(GC),Sigma-Aldrich公司;Ludox AS-30胶态二氧化硅悬浮液,质量分数为30%,Sigma-Aldrich公司;乙醇,纯度>99.9%(HPLC),J&K公司。蒽和菲的分子中均含有3个苯环,二者互为同分异构体,其中蒽属于线性排布,菲属于角形排布,其结构式如图 1所示。
|
图 1 蒽和菲的结构式 Fig.1 Structural formulae of anthracene and phenanthrene |
使用乙醇为溶剂配制1 000 mg/L的蒽和菲溶液作为储备液,置于4 ℃冰箱中避光保存备用,临用时用乙醇稀释至所需浓度。
1.3 测试与表征采用荧光分光光度计(F2700,Hitachi公司)测定样品的三维荧光光谱。激发波长的扫描范围为220~600 nm,发射波长的扫描范围为230~650 nm,步进波长5 nm,扫描电压700 V,扫描速度12 000 nm/min。
采用紫外可见分光光度计(DR6000,Hach公司)测定样品的紫外可见吸收光谱,扫描范围为200~500 nm。
采用稳态/瞬态荧光仪(FLS1000,Edinburgh Instruments公司)测定样品的荧光量子产率,使用积分球直接法测试。
采用稳态/瞬态荧光仪(FLS1000,Edinburgh Instruments公司)测定样品的荧光寿命。光源采用EPLED系列皮秒脉冲二极管激光器,激发波长为254.5 nm,分析通道数目为2 048。在350~500 nm的波长范围内记录不同波长下的荧光寿命,测定荧光衰减曲线以及相应条件下的仪器响应函数(instrument response function, IRF)曲线,通过拟合扣除仪器响应时间的影响。荧光衰减曲线通过多指数函数(式(1))表示。
| $ R(t)=\sum\limits_{i=1}^n B_i \exp \left(-t / \tau_i\right) $ | (1) |
式中:R(t)为荧光总强度,Bi和τi分别为不同分子构象的指前因子和荧光寿命。χ2是检验拟合结果质量好坏的直接标志,通常在1.0~1.3范围内都是合理的。
1.4 量子化学计算使用Gaussian view 06软件生成分子结构,Gaussian 16W进行计算。采用密度泛函理论中的B3LYP泛函,在6-31G(d,p)基组水平上对蒽和菲分子结构的基态进行频率和能量优化。采用基于构型相互作用单体(configuration interaction singles,CIS)的方法,在6-31G(d,p)基组水平上对激发态进行优化[13]。利用优化好的结构,在B3LYP/6-31G(d,p)水平上计算蒽和菲的吸收光谱和发射光谱。本研究是在乙醇溶剂中进行的,以上所有过程均结合类导体极化连续模型(conductor-like polarizable continuum model,CPCM)模拟乙醇的溶剂效应。
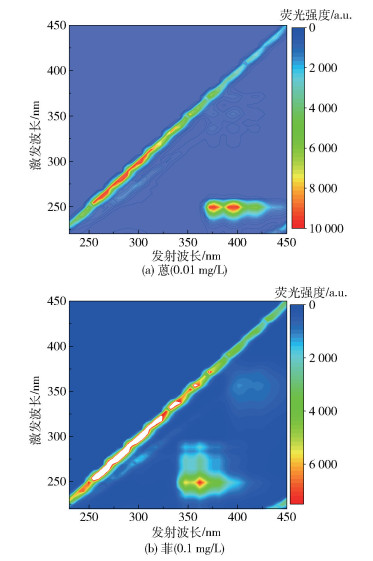
2 结果与讨论 2.1 三维荧光光谱蒽和菲的三维荧光光谱包含众多的荧光峰,大致可以分成强荧光峰和弱荧光峰两个区域,如图 2所示。荧光峰的位置以[激发波长/发射波长]表示,在蒽的三维荧光光谱中,强荧光峰区域有3个峰:[250/380]nm、[250/400]nm、[250/425]nm;弱荧光峰区域有8个峰:[340/380]nm、[340/400]nm、[340/425]nm、[355/380]nm、[355/400]nm、[355/425]nm、[375/400]nm、[375/425]nm。
|
图 2 蒽和菲的三维荧光光谱 Fig.2 Three-dimensional fluorescence spectra of anthracene and phenanthrene |
在菲的三维荧光光谱中,强荧光峰区域有两个峰:[250/350]nm、[250/365]nm;较弱的荧光峰区域有4个峰:[275/350]nm、[275/365]nm、[290/350]nm、[290/365]nm;最弱的荧光峰区域有两个峰:[360/405]nm、[360/425]nm。在蒽和菲的弱荧光峰区域有几个相近的荧光峰,例如蒽的[355/400]nm、[355/425]nm和菲的[360/405]nm、[360/425]nm。
比较二者的荧光峰可以看出,在激发波长为250 nm处,蒽和菲均为强荧光峰区域,蒽的发射波长在380~425 nm之间,菲的发射波长在350~365 nm,蒽强荧光峰的发射波长相对于菲发生红移。在弱荧光峰区域:蒽的激发波长在340~375 nm,菲的激发波长在275~360 nm;蒽的发射波长为380~425 nm,菲的发射波长为350~425 nm。结果表明蒽弱荧光峰的激发波长和发射波长相对于菲均发生了红移。此外,在相同的质量浓度(0.01 mg/L)下,蒽在最强荧光峰[250/380]nm处的荧光强度约为9 999;菲在最强荧光峰[250/365]nm处的荧光强度约为746.2,表明蒽的荧光强度大于菲。
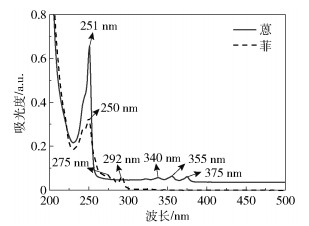
2.2 紫外可见吸收光谱图 3为蒽和菲(1 mg/L)的紫外可见吸收光谱。可以看出,蒽和菲均有2个吸收带。蒽在B带的最大吸收峰位于251 nm处;在K带有3个明显的吸收峰,分别位于340 nm、355 nm、375 nm处,其中最大吸收峰位于355 nm处。菲在B带的最大吸收峰位于250 nm处;在K带有2个明显的吸收峰,分别位于275 nm、292 nm处,其中最大吸收峰位于约292 nm处。B带上的吸收峰是由共轭双键产生的,K带上的吸收峰主要是由封闭共轭体系的π-π*跃迁和苯环振动重叠而产生的。蒽和菲在K带上都拥有多个吸收峰,这主要是由分子吸收能量后从基态跃迁到第一电子激发态中的各个不同振动能级引起的。在B带中,二者的最大吸收峰都位于250 nm左右,但是蒽的吸收强度比菲强。在K带中,蒽的最大吸收峰所在的波长相对于菲发生红移。以上结果表明,蒽和菲的苯环排列方式对分子中电子的跃迁产生很大的影响。
|
图 3 蒽和菲(1 mg/L)的紫外可见吸收光谱 Fig.3 UV-Vis absorption spectra of anthracene and phenanthrene (1 mg/L) |
荧光量子产率在测试中容易受温度[14-16]和激发波长[17]的影响。为保证测试结果的准确性,选取紫外可见吸收光谱(图 3)中吸收峰对应的波长作为激发波长,在室温25 ℃、质量浓度1 mg/L的条件下,探究荧光量子产率与激发波长的关系;同时在相同的激发波长(250 nm)和质量浓度(1 mg/L)下,探究温度对荧光量子产率的影响。
表 1为在相同温度(25 ℃)时蒽和菲在不同激发波长下的荧光量子产率。在B带上,蒽和菲在约250 nm处各有一个吸收峰,其荧光量子产率分别为(32.93±2.15)%和(3.95±0.01)%。在K带上,蒽和菲的最大吸收波长分别位于355 nm和292 nm,其荧光量子产率分别为(29.07±0.61)%和(4.94±0.12)%。上述结果显示,同一化合物在不同激发波长下的荧光量子产率存在差异。结合紫外可见吸收光谱可知,吸收强度反映电子在该波段分子跃迁概率的大小,吸收强度越大,电子跃迁概率越大,越容易发生跃迁[18];吸收波长反映电子跃迁所需的能量大小,吸收波长越大,电子跃迁所需的能量越低,越容易发生跃迁。因此,蒽和菲在不同激发波长下的荧光量子产率大小取决于荧光在产生过程中的分子跃迁概率和跃迁所需能量,分子跃迁概率越大,跃迁所需能量越低,荧光量子产率越大。
| 下载CSV 表 1 蒽和菲在不同激发波长下的荧光量子产率(25 ℃) Table 1 Fluorescence quantum yields of anthracene and phenanthrene at different excitation wavelengths(25 ℃) |
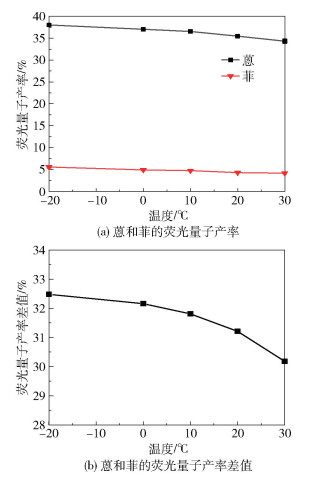
在相同的激发波长(250 nm)下,分别在-20、0、10、20、30 ℃下测试蒽和菲的荧光量子产率,结果如图 4(a)所示。在-20~30 ℃范围内,蒽和菲的荧光量子产率随着温度的升高而缓慢减小。这是由于随着温度的升高,溶液中分子的活性增强,溶液的黏度减小,溶质分子与溶剂分子之间的碰撞机会增大,提高了非辐射跃迁速率,使蒽和菲的荧光量子产率减小。图 4(b)为蒽和菲的荧光量子产率差值随温度的变化。在-20~30 ℃范围内,蒽和菲的荧光量子产率差值随着温度的降低而增大。
|
图 4 温度对蒽和菲的荧光量子产率以及二者差值的影响(激发波长为250 nm) Fig.4 Effect of temperature on the fluorescence quantum yields of anthracene and phenanthrene and their differences (with an excitation wavelength of 250 nm) |
总的来说,在本实验条件下,相同温度、相近的激发波长范围下,蒽的荧光量子产率明显高于菲;在相同的激发波长下,蒽和菲的荧光量子产率差值随着温度的降低而增大。蒽和菲的荧光量子产率的差异,可以有效区分这两种同分异构体。
2.4 荧光寿命荧光寿命的大小受发射波长和浓度的影响[19]。在激发波长为254.5 nm、质量浓度为5 mg/L的条件下,探究了发射波长对蒽和菲荧光寿命的影响,结果如表 2所示。结果表明,二者的荧光寿命均保持良好的单指数衰减。蒽在不同发射波长下的荧光寿命均保持在4.4 ns左右;菲在365 nm、400 nm、405 nm的发射波长下荧光寿命保持在14.9 ns左右,仅在425 nm处荧光寿命(约14.5 ns)略有减小。两种同分异构体的荧光寿命在选取的发射波长范围内大致保持在某一稳定数值。
| 下载CSV 表 2 不同发射波长下蒽和菲溶液(5 mg/L)的荧光寿命 Table 2 Fluorescence lifetimes of anthracene and phenanthrene solutions (5 mg/L) at different emission wavelengths |
在激发波长为254.5 nm的条件下,分别在5×10-3、5×10-2、5×10-1、5×100、5×101、5×102 mg/L的质量浓度下测试蒽和菲的荧光寿命,其中蒽的发射波长设置为400 nm,菲的发射波长设置为365 nm,结果如表 3所示。结果表明,在5×10-3~5×10-1 mg/L范围内,蒽的荧光寿命基本保持在(4.048 8±0.040 6)ns左右。在5×10-1~5×102 mg/L范围内,蒽的荧光寿命随着质量浓度的增大先增加后减小。蒽的荧光寿命减小可能是内滤效应导致的,内滤效应是指在溶液浓度较高时,会发生溶质间的相互作用,其激发态分子与基态分子容易产生二聚物或者与其他溶质分子形成复合物,从而导致荧光光谱改变、荧光强度下降以及荧光寿命减少。菲的荧光寿命随着质量浓度的增大而增大,5×102 mg/L下的荧光寿命比5×10-3 mg/L下的荧光寿命增加了11.19%。这主要是由于浓度增大时,菲会形成基态分子聚集体,导致电子跃迁受到阻碍,辐射跃迁速率减小,荧光寿命增长[7]。上述结果表明,浓度对同分异构体荧光寿命的影响有所不同,浓度越高,蒽和菲的荧光寿命差异越大,二者更容易区分。
| 下载CSV 表 3 不同质量浓度下蒽和菲溶液的荧光寿命 Table 3 Fluorescence lifetimes of anthracene and phenanthrene solutions at different mass concentrations |
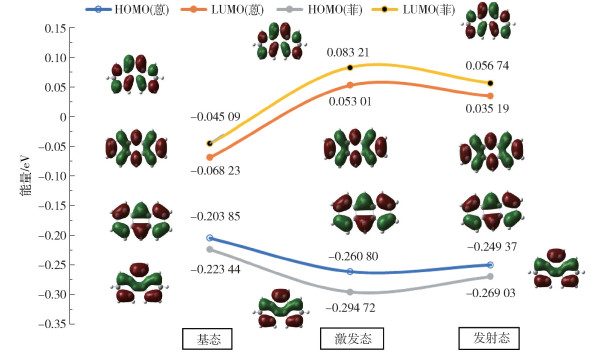
前文系统分析了蒽和菲的紫外可见吸收光谱和三维荧光光谱特征,并探究了不同因素对二者荧光寿命及荧光量子产率的影响。显然,蒽和菲的荧光特征具有较大的差异,为了从微观机理层面解析这种差异的原因,本研究开展了量子化学计算。图 5为蒽和菲在基态、激发态和发射态下的高能占据分子轨道(high energy occupied molecular orbitals,HOMO)和低能未占据分子轨道(low energy unoccupied molecular orbitals,LUMO)。由结果可知,蒽和菲在基态、激发态和发射态下的HOMO电子云都均匀分布于整个分子结构上,苯环的共轭π电子为其主要特征;共轭体系的电子被激发至LUMO后,苯环上C C共轭双键区域的电子云密度增大,该跃迁属于π→π*跃迁;处于反键轨道的π*电子非常不稳定,会从高能级迅速弛豫到第一激发态的最低振动能级,经过辐射跃迁,伴随荧光的产生返回基态,该过程属于π*→π跃迁,对应LUMO→HOMO轨道跃迁。HOMO和LUMO的能级差ΔE表示分子硬度(molecular hardness, η),可表明化合物的稳定性[20]。表 4为蒽和菲在基态、激发态和发射态下高能占据分子轨道能量(EHOMO)、低能未占据分子轨道能量(ELUMO)以及二者差值(ΔE)。在发射态下,ΔE蒽(0.284 56 eV)<ΔE菲(0.325 77 eV),说明蒽的分子硬度比菲小,蒽较不稳定,蒽上的π电子更容易从基态被激发到激发态,因而荧光强度和荧光量子产率比菲大;同时,蒽上离域的π电子完成π-π*跃迁所需的时间更短,因此荧光寿命更短。
|
图 5 蒽和菲在基态、激发态和发射态下的HOMO和LUMO示意图 Fig.5 Schematic diagram of HOMO and LUMO for anthracene and phenanthrene in the ground, excited and emission states |
| 下载CSV 表 4 蒽和菲在基态、激发态和发射态下的分子硬度 Table 4 Molecular hardness of anthracene and phenanthrene in ground state, excited state and emission state |
本文研究了同分异构体蒽和菲的三维荧光光谱和紫外可见吸收光谱特征,考察了不同因素对二者荧光寿命及荧光量子产率的影响,并结合量子化学计算,解析了苯环排布异构对多环芳烃分子荧光的影响机制,得到如下结论。
(1) 在三维荧光光谱中,蒽强荧光峰的发射波长相对于菲发生了红移,蒽弱荧光峰的激发波长和发射波长相对于菲均发生了红移;在紫外可见吸收光谱中,蒽的最大吸收峰所在波长相对于菲发生了红移。
(2) 蒽和菲的荧光量子产率受到激发波长和温度的影响。在不同激发波长下蒽和菲的荧光量子产率存在差异;在-20~30 ℃范围内,二者的荧光量子产率均随着温度的升高而缓慢减小。
(3) 蒽和菲的荧光寿命在选取的发射波长范围内均稳定保持在某一数值。蒽的荧光寿命在5×10-3~5×10-1 mg/L范围内基本保持在(4.048 8±0.040 6)ns;在5×10-1~5×102 mg/L范围内,蒽的荧光寿命随着质量浓度的增大先增加后减小;菲的荧光寿命在5×10-3~5×102 mg/L范围内,随着质量浓度的增大而增大。
(4) 密度泛函理论计算结果表明,在发射态下,ΔE蒽(0.284 56 eV)<ΔE菲(0.325 77 eV),说明蒽的分子硬度比菲小,蒽较不稳定,蒽上的π电子更容易从基态被激发到激发态,因此荧光强度和荧光量子产率比菲大;同时蒽上离域的π电子完成π-π*跃迁所需的时间更短,因此荧光寿命更短。
| [1] |
SUN C, GRADZIELSKI M. Advances in fluorescence sensing enabled by lanthanide-doped upconversion nanophosphors[J]. Advances in Colloid and Interface Science, 2021, 300: 102579. |
| [2] |
WANG Z W, ZHENG Y P, ZHAO D Q, et al. Applications of fluorescence lifetime imaging in clinical medicine[J]. Journal of Innovative Optical Health Sciences, 2018, 11(1): 1830001. DOI:10.1142/S179354581830001X |
| [3] |
GUO M C, SONG H, LI K, et al. A new approach to developing diagnostics and therapeutics: aggregation-induced emission-based fluorescence turn-on[J]. Medicinal Research Reviews, 2019, 40(5): 1-27. |
| [4] |
CARSTEA E M, BRIDGEMAN J, BAKER A, et al. Fluorescence spectroscopy for wastewater monitoring: a review[J]. Water Research, 2016, 95: 205-219. DOI:10.1016/j.watres.2016.03.021 |
| [5] |
刘传旸, 柴一荻, 徐宪根, 等. 南方某河水质荧光指纹特征及污染溯源[J]. 光谱学与光谱分析, 2021, 41(7): 2142-2147. LIU C Y, CHAI Y D, XU X G, et al. Aqueous fluorescence fingerprint characteristics and discharge source identification of a river in southern China[J]. Spectroscopy and Spectral Analysis, 2021, 41(7): 2142-2147. (in Chinese) |
| [6] |
吕清, 顾俊强, 徐诗琴, 等. 水纹预警溯源技术在地表水水质监测的应用[J]. 中国环境监测, 2015, 31(1): 152-156. LYU Q, GU J Q, XU S Q, et al. Application of pre-warning and pollution source identification technique based on fingerprint in water quality monitoring of surface water[J]. Environmental Monitoring in China, 2015, 31(1): 152-156. (in Chinese) DOI:10.3969/j.issn.1002-6002.2015.01.030 |
| [7] |
许金钩, 王尊本. 荧光分析法[M]. 3版. 北京: 科学出版社, 2006. XU J G, WANG Z B. Fluorimetry[M]. 3rd ed. Beijing: Science Press, 2006. (in Chinese) |
| [8] |
WEI Y L, WANG S F, SHUANG S M, et al. Chiral discrimination between D- and L-tryptophan based on the alteration of the fluorescence lifetimes by the chiral additives[J]. Talanta, 2010, 81(4-5): 1800-1805. DOI:10.1016/j.talanta.2010.03.044 |
| [9] |
NEELY R K, MAGENNIS S W, DRYDEN D T F, et al. Evidence of tautomerism in 2-aminopurine from fluorescence lifetime measurements[J]. The Journal of Physical Chemistry B, 2004, 108(45): 17606-17610. DOI:10.1021/jp0490857 |
| [10] |
FEDORENKO E V, MIROCHNIK A G, GERASIMENKO A V, et al. Fluorescence and phosphorescence of α- and β-isomers of boron difluoride naphthaloylacetonates[J]. Journal of Photochemistry & Photobiology A: Chemistry, 2021, 412: 113220. |
| [11] |
范博, 王晓南, 黄云, 等. 我国七大流域水体多环芳烃的分布特征及风险评价[J]. 环境科学, 2019, 40(5): 2101-2114. FAN B, WANG X N, HUANG Y, et al. Distribution and risk assessment of polycyclic aromatic hydrocarbons in water bodies in seven basins of China[J]. Environmental Science, 2019, 40(5): 2101-2114. (in Chinese) |
| [12] |
KHAN M F S, WU J, LUI B, et al. Fluorescence and photophysical properties of xylene isomers in water: with experimental and theoretical approaches[J]. Royal Society Open Science, 2018, 5(2): 171719. DOI:10.1098/rsos.171719 |
| [13] |
CERVANTES-NAVARRO F, GLOSSMAN-MITNIK D. DFT study of the effect of substituents on the absorption and emission spectra of Indigo[J]. Chemistry Central Journal, 2012, 6(1): 70. DOI:10.1186/1752-153X-6-70 |
| [14] |
胡晓月, 屈泽华, 黄红香. 积分球测量荧光量子产率的最优测试条件研究[J]. 中国测试, 2021, 47(10): 59-62, 74. HU X Y, QU Z H, HUANG H X. Study of the optimized test conditions for fluorescence quantum yield measuring by integrating sphere[J]. China Measurement & Test, 2021, 47(10): 59-62, 74. (in Chinese) DOI:10.11857/j.issn.1674-5124.2020110073 |
| [15] |
GREINER G. The unusual temperature dependence of the fluorescence intensity and lifetime of anthracene in ethanol[J]. Journal of Photochemistry & Photobiology A: Chemistry, 2000, 137(1): 1-7. |
| [16] |
LANGELAAR J, RETTSCHNICK R P H, HOIJTINK G J. Studies on triplet radiative lifetimes, phosphorescence, and delayed fluorescence yields of aromatic hydrocarbons in liquid solutions[J]. The Journal of Chemical Physics, 1971, 54(1): 1-7. DOI:10.1063/1.1674576 |
| [17] |
DAWSON W R, WINDSOR M W. Fluorescence yields of aromatic compounds[J]. The Journal of Physical Chemistry, 1968, 72(9): 3251-3260. DOI:10.1021/j100855a027 |
| [18] |
黄量, 于德泉. 紫外光谱在有机化学中的应用[M]. 北京: 科学出版社, 1988. HUANG L, YU D Q. Application of ultraviolet spectroscopy in organic chemistry[M]. Beijing: Science Press, 1988. (in Chinese) |
| [19] |
LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 3rd ed. Heideberg: Springer-Verlag, 2006.
|
| [20] |
KAYA S, KAYA C. A new method for calculation of molecular hardness: a theoretical study[J]. Computational and Theoretical Chemistry, 2015, 1060: 66-70. DOI:10.1016/j.comptc.2015.03.004 |








