2. 北京化工大学 化学工程学院, 北京 100029
2. College of Chemical Engineering, Beijing University of Chemical Technology, Beijing 100029, China
奥曲肽(octreotide,OCT)是由8个氨基酸组成的环状多肽,是一种生长抑素类药物,能够选择性抑制生长激素、胰血糖素、胰岛素的分泌,是临床上治疗肢端肥大症的首选药物,此外还可用于治疗消化道出血、内分泌肿瘤等疾病[1-2]。OCT通常需要长期用药,且口服时药物稳定性差,目前主要的给药形式为静脉注射和皮下注射。长期频繁的注射导致患者依从性降低,并容易引发细胞组织感染,因此迫切需要非侵入性的给药方式及其制剂。
人体肺泡-毛细血管区域的吸收面积大、血流丰富、交换距离短、酶降解作用弱,因此肺部给药被认为是多肽药物理想的新型给药方式[3-4]。其中,干粉吸入制剂是利用吸入装置与患者呼吸的气流作用将微粉化药物递送至肺部的制剂形式,具有携带方便、操作简单、干扰因素少、药剂稳定性好、生物利用率高、递送剂量准确等优点,因此在新药及新剂型研发领域广受瞩目。目前,国内外OCT吸入制剂的相关研究较少,并且均处于起步阶段[5-6]。本课题组此前探索性开展了针对肢端肥大症的无载体OCT干粉吸入制剂研究,结果表明OCT吸入制剂能够达到与皮下注射几乎相同的生物利用度,证明这种新的给药途径与制剂形式具有可行性,但是由于该微粉制剂没有缓释作用,因此药物的半衰期较短[7]。利用载体材料负载OCT制备可吸入缓释制剂,能够同时结合吸入制剂和缓释制剂的优点,在避免侵入性给药的同时延长药物作用时间、减少给药频率。
近年来,将纳米碳酸钙(nCaCO3)用于药物载体的相关报道引起了研究者的关注[8-9],基于纳米碳酸钙的药物递送系统能够有效负载小分子药物[8]及蛋白[10]并实现缓释、控释的效果,但给药途径仍以传统的注射或口服方式为主。纳米碳酸钙具有生物相容性好、比表面积大、孔隙率高等优点,理论上是用于吸入制剂的理想载体材料,但目前尚无相关文献报道。复分解法是制备纳米碳酸钙最常用的方法,即利用水溶性钙盐与水溶性碳酸盐在溶液中反应得到纳米碳酸钙载体,通过引入聚丙烯酸(polyacrylic acid,PAA)、聚乙二醇(PEG)等添加剂,能够改变纳米碳酸钙的微观形貌与物相结构,进而可能会对吸入制剂的吸入性能与释放性能产生影响。
本研究采用复分解法制备用于干粉吸入制剂的纳米碳酸钙载体,创新性引入聚天冬氨酸钠(sodium of polyaspartic acid, PASP)等作为添加剂实现对碳酸钙载体形貌与晶型的调控;通过浸渍吸附-冷冻干燥工艺装载OCT,构建可吸入缓释微粉制剂;对载体材料与吸入制剂进行微观形貌、物相结构、递送与释放、生物效应等研究,以期为OCT提供一种新的药物递送方案。
1 实验部分 1.1 实验材料与仪器 1.1.1 实验材料奥曲肽,纯度99.1%,浙江湃肽生物有限公司,批号2018053003-1;吸入α-乳糖(粒径74μm)、十水碳酸钠、二水氯化钙、盐酸、氢氧化钠,化学纯,北京化工厂;聚丙烯酸(分子量2000)、聚天冬氨酸钠(分子量7000~8000),阿拉丁试剂(上海)有限公司;纳米氧化铜(nCuO,粒径40nm,球形,纯度99.5%)、3-氨丙基三乙氧基硅烷(APTES,纯度99%)、N-羟基琥珀酰亚胺(NHS,纯度98%)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,纯度98.5%)、L-酪氨酸(L-tyrosine,纯度99%)、1, 3, 4, 6-四氯-3α, 6α-二苯基甘脲(Iodogen,纯度44%),上海麦克林生化科技股份有限公司;Na125I,北京原子高科股份有限公司;THP-1细胞、RPMI-1640完全培养基(含10%胎牛血清(FBS)),武汉普诺赛生物科技有限公司;MTS细胞毒性试剂盒、ELISA检测试剂盒,上海钦诚生物科技有限公司;C57小鼠模型,雄性,北京思科诺思生物科技有限公司。
1.1.2 实验仪器LGJ-18S型真空冷冻干燥机,北京松源华兴科技发展有限公司;3H-2000PS2型比表面积及孔径分析仪,贝士德仪器科技(北京)有限公司;SU8020型扫描电子显微镜(SEM),日本日立公司;Tecnai G2型场发射透射电子显微镜(TEM),美国FEI公司;D8-ADVANCE型X射线衍射仪(XRD),德国布鲁克公司;Agilent 1260型高效液相色谱仪(HPLC),美国安捷伦公司;JMT-3型安德森级联撞击器(ACI),北京明杰蓝天科技有限公司;BT-90+型动态光散射纳米激光粒度仪,丹东百特仪器有限公司;ZS90型纳米粒度电位仪,英国马尔文仪器有限公司;U-SPECT+/CT型SPECT/CT成像系统,荷兰MILabs公司;371型细胞培育箱,美国Thermo Scientific公司。
1.2 碳酸钙载体的制备以在不加添加剂的条件下制备的碳酸钙A作为对比,同时选用PAA和PASP作为添加剂制备了3种不同微观形貌的纳米碳酸钙,并对交联时间、滴加速度、反应时间、离心时间等条件进行了优化,得到最佳制备条件如下:
菱方形碳酸钙A配制0.1mol/L碳酸钠溶液和0.1mol/L氯化钙溶液,取碳酸钠溶液和氯化钙溶液各20mL,在搅拌下将碳酸钠溶液以10mL/min的速度滴加至氯化钙溶液中。滴加结束后在1000r/min的转速下反应12h,反应结束后将悬浮液在12000r/min的转速下离心30min,用水和乙醇洗涤、离心后,在50℃下干燥至恒重。
棒形纳米碳酸钙B选用PAA作为添加剂加入碳酸钠溶液。取0.1mol/L碳酸钠溶液和0.1mol/L氯化钙溶液各20mL,向碳酸钠溶液中加入53mg的PAA并搅拌交联30min,然后在搅拌下将添加PAA的碳酸钠溶液以10mL/min的速度滴加至氯化钙溶液中。滴加结束后于室温在1000r/min的转速下反应12h,反应结束后将悬浮液在12000r/min的转速下离心30min,用水和乙醇洗涤、离心后,在50℃下干燥至恒重。
球形纳米碳酸钙C选用PASP作为添加剂与氯化钙交联。取0.1mol/L碳酸钠溶液和0.1mol/L氯化钙溶液各20mL,向氯化钙溶液中加入666mg的PASP并搅拌交联30min,然后在搅拌下将碳酸钠溶液以10mL/min的速度滴加至添加PASP的氯化钙溶液中。滴加结束后于室温在1000r/min的转速下反应12h,反应结束后将悬浮液在12000r/min的转速下离心30min,用水和乙醇洗涤、离心后,在50℃下干燥至恒重。
球棒混杂状纳米碳酸钙D选用PASP作为添加剂与氯化钙交联,PAA作为添加剂加入碳酸钠溶液。取0.1mol/L碳酸钠溶液和0.1mol/L氯化钙溶液各20mL,向氯化钙溶液中加入666mg的PASP,向碳酸钠溶液中加入106mg的PAA并搅拌交联30min,然后在搅拌下将添加PAA的碳酸钠溶液以10mL/min的速度滴加至添加PASP的氯化钙溶液中。滴加结束后于室温在1000r/min的转速下反应12h,反应结束后将悬浮液在12000r/min的转速下离心30min,用水和乙醇洗涤、离心后,在50℃下干燥至恒重。
1.3 碳酸钙载体的测试与表征采用纳米激光粒度仪测定反应结束后悬浮液中碳酸钙颗粒的Z均粒径和多分散指数(PDI),以水为分散介质,平衡温度为25℃;采用扫描电子显微镜观察碳酸钙粉末的微观形貌;采用场发射透射电子显微镜表征干燥后碳酸钙粉末的微观形貌与结构;采用X射线衍射仪表征碳酸钙粉末的物相结构,操作电压40kV,操作电流40mA,Cu靶,波长0.15406nm,扫描范围10°~70°,扫描速率2(°)/min;采用比表面积及孔径分析仪测定碳酸钙粉末的比表面积与孔径;采用纳米粒度电位仪测量碳酸钙粉末的Zeta电势,以水为分散介质,平衡温度为25℃。
1.4 可吸入缓释微粉制剂的制备配制30mg/mL的OCT水溶液,取50mL的OCT溶液分别加入750mg不同的碳酸钙载体,超声30min,然后在1000r/min的转速下持续吸附24h。将OCT溶液与纳米碳酸钙的混合物过滤,分离固体后用超纯水洗涤3次,冷冻干燥,得到碳酸钙负载OCT的微粉制剂。将碳酸钙A、B、C、D制备的微粉制剂分别记为J1、J2、J3、J4。
1.5 可吸入缓释微粉制剂的性能分析 1.5.1 载药量称取少量微粉制剂置于烧杯中,加入超纯水后以1000r/min的转速搅拌2h,然后超声30min。静置后吸取上清液,通过0.45μm滤膜过滤后,采用HPLC进行定量分析[11]。色谱柱为安捷伦Eclipse plus C18柱,流动相为乙腈与0.25%(体积分数)高氯酸水溶液的混合液(二者体积比为30∶70),检测波长为210nm。根据式(1)计算载药量DL。
| $ D_{\mathrm{L}}=\frac{m_{\mathrm{d}}}{m_{\mathrm{t}}} \times 100 \% $ | (1) |
式中:mt为微粉制剂的质量,mg;md为微粉制剂中所含药物的质量,mg。
1.5.2 体外释放曲线以超纯水(37±0.5℃)作为溶出介质,称取适量微粉制剂置于透析袋中并加水至充满,用夹子封紧两端后浸没于200mL溶出介质,在37℃下以100r/min的转速搅拌。搅拌开始后在1、10、30、60、240、720、1440、2880min取样并补充溶出介质[12],通过HPLC对样品进行定量分析。根据式(2)计算微粉制剂的溶出度Q,并绘制时间-溶出度体外释放曲线。
| $ Q=\frac{C_n V_2+V_1 \sum\limits_{i=1}^{n-1} C_i}{m_{\mathrm{t}} D_{\mathrm{L}}} \times 100 \% $ | (2) |
式中:Ci、Cn分别为第i次取样时和第n次(最后一次)取样时药物的质量浓度,mg/mL;V1为各时间点的固定取样体积,mL;V2为溶出介质的体积,mL。
1.5.3 排空率和有效部位沉积率采用安德森级联撞击器ACI测定微粉制剂的排空率(emitted dose,Ed)和有效部位沉积率(fine particle fraction,Fp)。将微粉制剂与适量的乳糖混合均匀后装入胶囊中,称取5粒胶囊(约500mg)置于吸入器后连接ACI。刺破胶囊并以28.3L/min的气流流速抽吸8s,间隔1s后复吸8s,重复3次[12]。用超纯水回收被ACI中各级截留的微粉制剂,通过HPLC进行定量分析,根据式(3) 和式(4)计算Ed和Fp。
| $ E_{\mathrm{d}}=\frac{\sum\limits_{i=0}^{10} C_i V_i}{\sum\limits_{i=0}^{11} C_i V_i} \times 100 \% $ | (3) |
| $ F_{\mathrm{p}}=\frac{\sum\limits_{i=2}^8 C_i V_i}{\sum\limits_{i=0}^{11} C_i V_i} \times 100 \% $ | (4) |
式中:Ci为ACI中收集到的第i级的OCT质量浓度,mg/mL;Vi为收集到的第i级的OCT体积,mL。
1.6 纳米碳酸钙载体的生物效应测定 1.6.1 细胞毒性载体进入肺部后会在肺部与巨噬细胞发生相互作用,产生生物学效应。选用THP-1细胞系为细胞模型,经诱导分化后,用RPMI-1640完全培养基(含10% FBS)分别配制质量浓度为12.5、25、50、100、200μg/mL的纳米碳酸钙D和纳米氧化铜悬浮液。将细胞在37℃、5% CO2培育箱中在10000个细胞/孔、培养基50μL/孔的条件下培育16h。培育结束后吸取孔板中的上清液并弃掉,向其中分别加入纳米碳酸钙D悬浮液、纳米氧化铜悬浮液和培养基,在相同条件下培育24h后通过MTS细胞毒性试剂盒检测细胞活性。以未加入任何颗粒物的细胞为空白对照,以细胞毒性很强的纳米氧化铜为阳性对照,通过细胞活性分析纳米碳酸钙D的细胞毒性。
1.6.2 炎性效应巨噬细胞是体内炎症调控的重要单元,当外来物突破机体的物理屏障(如皮肤、黏膜等)时,细胞膜表面Toll样受体激活,经由NF-κB通路指导mRNA的合成,在细胞核指导细胞因子(如白介素IL-6、IL-β及肿瘤坏死因子TNF-α等)的合成,产生免疫细胞应答。选择IL-1β和TNF-α两种细胞因子作为免疫炎症的标志物,研究纳米碳酸钙D引发的肺部炎性效应。将配制的纳米碳酸钙D悬浮液与细胞孵育48h后,吸取细胞上清液并用ELISA检测试剂盒检测其中的TNF-α和IL-1β含量。
1.6.3 体内分布碳酸钙具有丰富的表面羟基,可运用Iodogen法将放射性125I标记在颗粒物表面,具体的标记策略如图 1所示。在清洗掉游离的125I后,以C57小鼠为动物模型,将核素标记的颗粒物通过肺部滴灌的方式,按照100μCi/只的剂量递送至小鼠肺部。通过SPECT/CT成像系统观察纳米碳酸钙D进入肺部后在不同时间的体内分布情况。
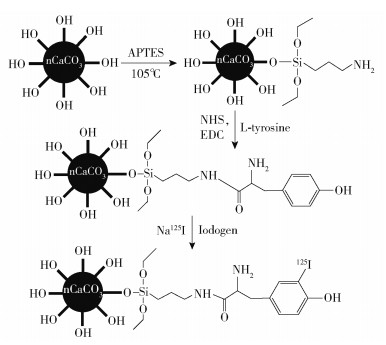
|
图 1 纳米碳酸钙的核素标记策略 Fig.1 Nuclide labeling strategy for nano-calcium carbonate |
采用复分解法制备纳米碳酸钙时,添加剂可与钙离子或碳酸根离子耦合形成复合物,复合物随着交联时间的延长而形成胶体粒子[13],添加剂在结晶过程中影响晶胞的形成,诱导形成具有不同晶型与形貌的碳酸钙并抑制其向其他晶型转化。PAA是合成纳米碳酸钙常用的添加剂,有关机理的研究较为成熟[14]。PASP是工业上常用的阻垢剂,能够与钙离子螯合抑制钙盐结垢[15]。以PASP作为添加剂制备纳米碳酸钙C的过程如图 2所示,碳酸钙A~D在反应体系中的Z均粒径与多分散指数如表 1所示。碳酸钙A的Z均粒径大于纳米碳酸钙B、C、D,且多分散指数偏大(PDI>0.4),粒径均一性较差。
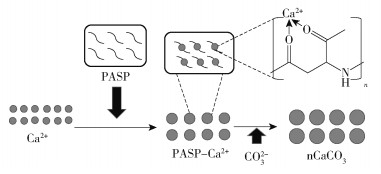
|
图 2 纳米碳酸钙C的制备过程 Fig.2 Preparation process of nano-calcium carbonate C |
| 下载CSV 表 1 不同碳酸钙载体材料的Z均粒径及多分散指数 Table 1 Z-average particle size and polydispersity index of different calcium carbonate carrier materials |
不同碳酸钙载体材料的微观形貌如图 3所示。碳酸钙A由粒径约2.4μm的实心菱方形碳酸钙组成;纳米碳酸钙B由长约487nm、宽约135nm的棒形碳酸钙组成,棒形碳酸钙中存在孔道结构;纳米碳酸钙C由粒径约430nm的球形碳酸钙组成,球形碳酸钙由更细小的颗粒紧密堆积而成,颗粒之间存在缝隙;纳米碳酸钙D由粒径约230nm的球形碳酸钙和长约280nm、宽约90nm的棒形碳酸钙混合组成。以上结果表明添加剂的引入成功实现了对纳米碳酸钙载体形貌的调控。

|
图 3 不同碳酸钙载体材料的SEM图 Fig.3 SEM images of different calcium carbonate carrier materials |
不同碳酸钙载体材料的XRD谱图如图 4所示,4种碳酸钙具有不同的物相结构。自然界中的碳酸钙以方解石型、文石型、球霰石型和非晶态等多种形式存在,其中方解石是最稳定的晶型,菱方形是方解石的典型形貌,在没有其他物质的影响下碳酸钙多以方解石晶型存在。球霰石是热力学不稳定的碳酸钙晶型,具有良好的生物相容性、无毒性、可降解性以及较大的比表面积[16],有利于药物的负载,可作为蛋白质[17]、药物[18]及疫苗[19]的载体。添加剂参与了结晶过程并进入碳酸钙的晶胞,导致晶格的缺陷和畸变,诱导形成较为稳定的球霰石晶型,球形是球霰石的典型形貌。4种碳酸钙中,碳酸钙A的粒径较大,衍射峰较强,为纯净的方解石。对XRD谱图进行精修后,通过Jade6.5软件进行物相组成分析,结果表明:纳米碳酸钙B中包含36%(质量分数,下同)的球霰石和64%的方解石;纳米碳酸钙C中包含77%的球霰石和23%的方解石;纳米碳酸钙D中包含57%的球霰石和43%的方解石。载体材料的物相结构比较稳定,添加剂的引入成功实现了对纳米碳酸钙载体物相结构的调控。
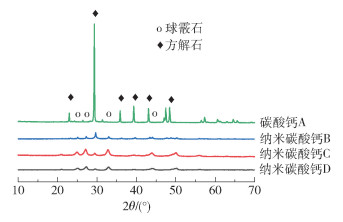
|
图 4 不同碳酸钙载体材料的XRD谱图 Fig.4 XRD patterns of different calcium carbonate carrier materials |
不同碳酸钙载体材料的Zeta电势、比表面积和比孔容如表 2所示。由结果可以看出:所有碳酸钙载体材料的Zeta电势均为负值;与未加入添加剂相比,添加剂的引入明显提高了碳酸钙载体材料的比表面积和比孔容;碳酸钙A的平均孔径较大,可能是菱方形的碳酸钙之间相互堆叠形成的缝隙所致。
| 下载CSV 表 2 不同碳酸钙载体材料的Zeta电势、比表面积和比孔容 Table 2 Zeta potential, specific surface area and specific pore volume of different calcium carbonate carrier materials |
在药物装载过程中,除碳酸钙A外,载体材料均能良好地分散在溶液中,冻干后得到的微粉制剂均为白色粉末。碳酸钙载体材料在载药前后的TEM图如图 5所示。与载药前的载体碳酸钙相比,碳酸钙载药后微粉制剂的形态无显著改变,保持了原有形貌;微粉制剂J1中OCT附着在载体碳酸钙A的表面;微粉制剂J2、J3、J4中载体碳酸钙的颜色加深,药物装载于载体内部的缝隙与孔道之中。

|
图 5 不同碳酸钙载体材料在载药前后的TEM图 Fig.5 TEM images of different calcium carbonate carrier materials before and after drug loading |
不同碳酸钙载体制备的微粉制剂的载药量如图 6所示。4种载体材料均成功装载药物,其中微粉制剂J4的载药量最高,为31.3%;制剂J1的载药量最低,为3.25%。经测定,OCT水溶液的Zeta电势为正值,碳酸钙载体的Zeta电势为负值,因此碳酸钙载体除了通过孔道装载OCT以外,还可以通过静电作用对OCT进行吸附装载。由于载体碳酸钙A几乎不具备孔道结构,OCT只能通过静电作用吸附在载体表面,因此制剂J1的载药量较低;纳米级载体碳酸钙B、C、D在孔道装载以及静电吸附的共同作用下对OCT进行负载,因此相比于微米级载体碳酸钙A具有更高的载药量。
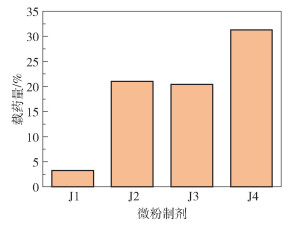
|
图 6 不同碳酸钙载体制备的微粉制剂的载药量 Fig.6 Drug loading of micro-powder preparations prepared by different calcium carbonate carriers |
不同碳酸钙载体制备的微粉制剂的体外溶出曲线如图 7所示。微粉制剂J1的溶出曲线与纯OCT的溶出曲线基本一致,不具有缓释作用;微粉制剂J2、J3、J4均有效延长了溶出时间,具有一定的缓释效果。由于制剂J1中药物只能附着在载体碳酸钙A的表面,因此在溶出介质中迅速释药,释放速率快于制剂J2、J3、J4。制剂J2、J3、J4中药物装载于碳酸钙载体内部,在溶出介质中释放速率较慢。制剂J2、J3、J4在48h内持续溶出,在48h时溶出度分别达到98%、100%、99%。以上结果表明纳米级碳酸钙载体有效延长了释药时间,实现了缓释作用。
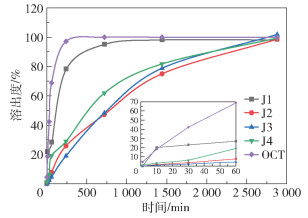
|
图 7 不同碳酸钙载体制备的微粉制剂的体外溶出曲线 Fig.7 In vitro dissolution curves of micro-powder preparations prepared by different calcium carbonate carriers |
排空率Ed用于评估制剂从吸入装置中排出的能力,有效部位沉积率Fp用于评估制剂在人体肺部进行深肺沉积的能力。表 3为不同碳酸钙载体制备的微粉制剂的Ed和Fp。微粉制剂J2、J4的Ed达到100%,表明其可以从吸入装置中全部排出;微粉制剂J1、J3的Ed稍小,但也达到93%以上。制剂J2的Fp最小,仅为7.95%,大部分颗粒被预分离器截留,原因可能是棒形的碳酸钙B载药后颗粒团聚,造成流动性降低,从而被预分离器截留;制剂J3和J4的Fp均达到40%以上,制剂J3的Fp略小于制剂J4,制剂J4中载体纳米碳酸钙D的粒径最小,在ACI中达到的层级最多,因此FP最大;制剂J1的Fp(34.9%)稍小于制剂J3和J4,原因是载体碳酸钙A的粒径较大,在同等流速的气流作用下流动性较差。
| 下载CSV 表 3 不同碳酸钙载体制备的微粉制剂的排空率Ed和有效部位沉积率Fp Table 3 Emitted dose and fine particle fraction of micro-powder preparations prepared by different calcium carbonate carriers |
以上结果表明,由载体纳米碳酸钙D制备的微粉制剂J4具有最佳的综合性能:载药量最高(DL=31.3%),体外吸入沉积性能最好(Ed=100%,Fp=42%),缓释性能良好(持续释药48h),因此纳米碳酸钙D具有作为可吸入缓释制剂载体的潜力。
2.4 纳米碳酸钙D载体的生物效应 2.4.1 细胞毒性纳米碳酸钙D的细胞毒性如图 8所示。结果表明,纳米碳酸钙D未表现出较为显著的细胞毒性,甚至在一定程度上还促进了细胞的增殖,细胞活性均高于100%。纳米氧化铜具有较为明显的细胞毒性,导致了细胞的死亡。
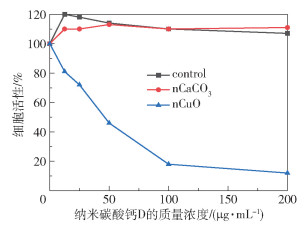
|
图 8 纳米碳酸钙D的细胞毒性 Fig.8 Cytotoxicity of nano-calcium carbonate D |
载体材料纳米碳酸钙D所造成炎症效应的结果如图 9所示。纳米碳酸钙引发了少量细胞炎症,具体表现为:TNF-α含量随碳酸钙颗粒的增加无明显变化,但高浓度的碳酸钙颗粒诱发了少量IL-1β的分泌。IL-1β细胞因子分泌增加的原因可能是大量纳米碳酸钙被摄入后,引起溶酶体的损伤,导致组织蛋白酶(cathepsin B)的释放,从而激活NLRP3炎性小体;同时,大量纳米碳酸钙被分解后使钙离子浓度上升,线粒体大量摄入钙离子后导致线粒体的损伤,诱发了线粒体活性氧的释放,同样激活了NLRP3炎症小体。在两者的共同作用下大量纳米碳酸钙导致IL-1β的分泌增加[20]。

|
图 9 TNF-α与IL-1β含量随纳米碳酸钙D质量浓度的变化 Fig.9 Changes of TNF-α and IL-1β contents with the mass concentration of nano-calcium carbonate D |
纳米碳酸钙D载体的体内分布示踪结果如图 10所示。通过核素标记的纳米碳酸钙D均经由呼吸道进入小鼠肺部,在进入小鼠的12h时,肺部出现很强的放射性信号。碳酸钙载体在肺部具有滞留效应,具体表现为:在肺部滞留7d左右,在这个过程中放射性信号逐渐减弱;在9d时信号完全消失,说明碳酸钙通过气血屏障缓慢进入血液循环而逐步代谢。在12h时,小鼠的胃部出现了放射性信号,原因可能是在肺部滴注过程中部分碳酸钙颗粒被小鼠误吞咽至消化道,但很快通过消化道被排出体外(3d后信号消失)。
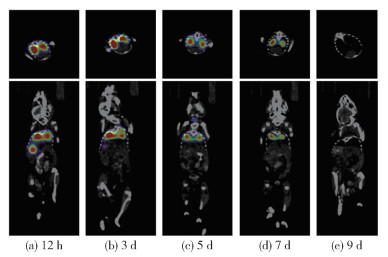
|
图 10 不同时间下纳米碳酸钙D在小鼠体内的分布 Fig.10 In vivo distribution of nano-calcium carbonate D in mice at different times |
(1) 采用复分解法,通过引入添加剂PAA和PASP成功制备了纳米级碳酸钙载体,实现了对碳酸钙载体晶型与形貌的调控。纳米碳酸钙仅由球霰石与方解石组成,其中纳米碳酸钙B、C、D中球霰石含量分别为36%、77%、57%,形貌分别为棒形、球形以及球形与棒形的混合。
(2) 相比于微米级碳酸钙载体A,纳米级碳酸钙载体B、C、D具有更高的载药量以及更好的缓释效果,因此更适合作为药物载体。由球形与棒形混杂状纳米碳酸钙D制备的微粉制剂J4的综合性能最佳,其载药量为31.3%,排空率为100%,有效部位沉积率达到42%,持续释药时间达到48h。纳米碳酸钙D无细胞毒性,低浓度时不会引起炎症效应,并且可以将药物有效地递送至肺部并在肺部滞留7d,因此纳米碳酸钙D具有作为可吸入缓释制剂载体的潜力。
本研究利用纳米碳酸钙载体装载OCT制备了可吸入缓释制剂,该方法结合了吸入制剂和缓释制剂的优点,在治疗肢端肥大症及内分泌性肿瘤方面具有明显的优势,可以为OCT及其他多肽药物的可吸入缓释制剂设计提供一种新的药物递送方案,具有较好的发展潜力。今后的工作将对纳米碳酸钙载体材料的载药性能与吸入性能进行设计优化,对负载药物后微粉制剂的体内生物学效应进行进一步研究。
| [1] |
LAMBERTS S W J, HOFLAND L J. Octreotide, 40 years later[J]. European Journal of Endocrinology, 2019, 181(5): R173-R183. DOI:10.1530/EJE-19-0074 |
| [2] |
KATO R, NISHIMURA A, MATSUMURA K, et al. Successful treatment of adult-onset nesidioblastosis by continuous subcutaneous octreotide infusion in a patient on hemodialysis[J]. Clinical Case Reports, 2020, 9(1): 278-281. |
| [3] |
SMALDONE G, BERKLAND C, GONDA I, et al. Ask the experts: the benefits and challenges of pulmonary drug delivery[J]. Therapeutic Delivery, 2013, 4(8): 905-913. DOI:10.4155/tde.13.76 |
| [4] |
SANDERS M. Pulmonary drug delivery: an historical overview[M]//SMYTH H D C, HICKEY A J. Controlled pulmonary drug delivery. New York: Springer, 2011: 51-73.
|
| [5] |
HOU A L, LI L, HUANG Y, et al. Fragmented particles containing octreotide acetate prepared by spray drying technique for dry powder inhalation[J]. Drug Delivery and Translational Research, 2018, 8(3): 693-701. DOI:10.1007/s13346-018-0515-7 |
| [6] |
YANG L K, LUO J, SHI S J, et al. Development of a pulmonary peptide delivery system using porous nanoparticle-aggregate particles for systemic application[J]. International Journal of Pharmaceutics, 2013, 451(1-2): 104-111. DOI:10.1016/j.ijpharm.2013.04.077 |
| [7] |
向童欣. 奥曲肽可吸入微粉制备及其性能研究[D]. 北京: 军事科学院, 2021. XIANG T X. Preparation and characterization of octreotide inhalable micropowders[D]. Beijing: Academy of Military Sciences, 2021. (in Chinese) |
| [8] |
窦佳红. 瞬时纳米沉淀法制备球霰石型碳酸钙及其负载抗癌药物缓控释的研究[D]. 上海: 华东理工大学, 2020. DOU J H. Preparation of vaterite CaCO3 particles by flash nano-precipitation technique for targeted and extended anticancer drug delivery[D]. Shanghai: East China University of Science and Technology, 2020. (in Chinese) |
| [9] |
DONG Z L, FENG L Z, ZHU W W, et al. CaCO3 nanoparticles as an ultra-sensitive tumor-pH-responsive nanoplatform enabling real-time drug release monitoring and cancer combination therapy[J]. Biomaterials, 2016, 110: 60-70. DOI:10.1016/j.biomaterials.2016.09.025 |
| [10] |
VOLODKIN D V, LARIONOVA N I, SUKHORUKOV G B. Protein encapsulation via porous CaCO3 microparticles templating[J]. Biomacromolecules, 2004, 5(5): 1962-1972. DOI:10.1021/bm049669e |
| [11] |
向童欣, 黄永鹏, 唐慧, 等. 高效液相色谱法定量分析奥曲肽[J]. 化学分析计量, 2020, 29(2): 79-82. XIANG T X, HUANG Y P, TANG H, et al. Quantitative analysis of octreotide by high performance liquid chromatography[J]. Chemical Analysis and Meterage, 2020, 29(2): 79-82. (in Chinese) |
| [12] |
国家药典委员会. 中华人民共和国药典: 四部[M]. 北京: 中国医药科技出版社, 2020: 132-141. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China: Volume 4[M]. Beijing: China Medical Science Press, 2020: 132-141. (in Chinese) |
| [13] |
HUANG S C, NAKA K, CHUJO Y. A carbonate controlled-addition method for amorphous calcium carbonate spheres stabilized by poly(acrylic acid)s[J]. Langmuir, 2007, 23(24): 12086-12095. DOI:10.1021/la701972n |
| [14] |
OUHENIA S, CHATEIGNER D, BELKHIR M A, et al. Synthesis of calcium carbonate polymorphs in the presence of polyacrylic acid[J]. Journal of Crystal Growth, 2008, 310(11): 2832-2841. DOI:10.1016/j.jcrysgro.2008.02.006 |
| [15] |
王玉江, 方洪波, 姚明修. 碳酸钙阻垢剂研究进展及阻垢作用机理[J]. 应用化工, 2021, 50(12): 3430-3435. WANG Y J, FANG H B, YAO M X. The development and scale inhibition mechanism of scale inhibitor for calcium carbonate[J]. Applied Chemical Industry, 2021, 50(12): 3430-3435. (in Chinese) DOI:10.3969/j.issn.1671-3206.2021.12.043 |
| [16] |
蒋久信, 吴月, 何瑶, 等. 亚稳态球霰石相碳酸钙的调控制备进展[J]. 无机材料学报, 2017, 32(7): 681-690. JIANG J X, WU Y, HE Y, et al. Progress in tuning of metastable vaterite calcium carbonate[J]. Journal of Inorganic Materials, 2017, 32(7): 681-690. (in Chinese) |
| [17] |
DE TEMMERMAN M L, DEMEESTER J, DE VOS F, et al. Encapsulation performance of layer-by-layer microcapsules for proteins[J]. Biomacromolecules, 2011, 12(4): 1283-1289. DOI:10.1021/bm101559w |
| [18] |
李洁. 功能化石墨烯为模板仿生矿物材料的可控构筑及载药研究[D]. 哈尔滨: 哈尔滨工程大学, 2016. LI J. Design, fabrication and controlled drug release of biomimetic mineral materials by functionalized graphene[D]. Harbin: Harbin Engineering University, 2016. (in Chinese) |
| [19] |
DE COCK L J, DE KOKER S, DE GEEST B G, et al. Polymeric multilayer capsules in drug delivery[J]. Angewandte Chemie International Edition, 2010, 49(39): 6954-6973. DOI:10.1002/anie.200906266 |
| [20] |
张磊. 工程纳米羟基磷灰石佐剂的免疫调控能力研究[D]. 大连: 大连理工大学, 2021. ZHANG L. Immunomodulatory potentials of engineered nano-hydroxyapatite adjuvants[D]. Dalian: Dalian University of Technology, 2021. (in Chinese) |








