2. 北京化工大学 有机无机复合材料国家重点实验室, 北京 100029;
3. 北京化工大学 材料科学与工程学院, 北京 100029;
4. 南昌大学第一附属医院皮肤科, 南昌 330006;
5. 北京化工大学 高新技术研究院, 北京 100029
2. State Key Laboratory of Organic-Inorganic Composites, Beijing University of Chemical Technology, Beijing 100029;
3. College of Materials Science and Engineering, Beijing University of Chemical Technology, Beijing 100029;
4. Department of Dermatology, The First Affiliated Hospital of Nanchang University, Nanchang 330006;
5. High-Tech Research Institute, Beijing University of Chemical Technology, Beijing 100029, China
黄褐斑是一种常见的损容性皮肤病,主要表现为累及面颊、前额及下颌的对称性褐色斑片,发病率高,育龄女性中发病率达30%[1]。黄褐斑容易复发、难以根治,对患者的日常生活和工作常产生消极影响,严重时可导致精神心理疾病。有研究表明,黄褐斑患者中焦虑症的患病率为39%,抑郁症的患病率为25%,部分患者甚至有自杀倾向[2-3]。及时有效地治疗黄褐斑是减少该疾病产生的不良社会影响的关键措施。目前,临床上可供选择的治疗方案有多种,包括外用药、系统用药、光电治疗、中医中药治疗等[4],但这些方法的整体疗效欠佳,因此需要开发治疗黄褐斑的新思路和方法。
氨甲环酸是治疗黄褐斑的一线药物,使用时需将药物应用于皮肤表面,药物经角质层到达表皮深层及真皮层而产生治疗作用,但是氨甲环酸的起效缓慢,患者常对治疗失去耐心而中断治疗。有效透皮吸收量是影响外用药疗效的关键因素,为了提高氨甲环酸对黄褐斑的治疗效果,需要设法提高其外用后的透皮吸收量。透皮给药技术是提高药物渗透性、促进药物经皮吸收的重要手段[5-6]。目前,透皮给药技术大致可分为化学方法和物理方法两类,常用的化学方法包括使用化学促渗剂、设计低共熔混合物、添加透皮肽;物理方法有离子导入技术、电致孔导入技术、超声导入法、激光预处理、热致孔等[7]。但在实际应用中,这些方法均存在不同程度的缺陷,例如,化学促渗法可能会增加不良反应的发生率,影响药物性状,降低疗效;物理促渗法需要特定的医疗设备,给患者带来经济负担的同时,也增加医疗机构的物力人力成本。
近年来,随着微机电加工技术的发展及经皮给药系统的成熟,科研人员开发出了基于固体微针的新型促渗技术,可大幅提高药物的皮肤透过率[8]。固体微针作用于皮肤后,会相应地在皮肤表面形成物理性微孔道,药物通过微孔道可直达皮肤深层,从而大大提高经皮吸收量,尤其适合水溶性药物及分子量较大的药物。相较于传统透皮给药系统,微针系统具有明显的优势:(1)对皮肤深层血管和神经无刺激,不出血、无痛感,不会对皮肤造成伤害;(2)使用简单,便于患者自我管理;(3)高度可灵活设计,可根据病变性质将药物靶向递送至皮肤特定深度;(4)提升药物的皮肤渗透率,减少药物损耗,延长作用时间;(5)微针采用可生物降解的高分子材料(如聚乳酸)制备而成,组织相容性良好,并且可减少生物性医疗垃圾的产生[9-10]。
本课题组在前期设计和开发了聚乳酸微针,通过动物实验证实了该微针能够增强外用药物治疗常见皮肤病的效果,同时摸索出微针应用于人体的最佳高度和密度,评估了微针对人体的安全性[10-12]。在此基础上,本研究将聚乳酸微针应用于临床,考察了聚乳酸微针联合氨甲环酸精华液治疗黄褐斑的效果,为后续高分子微针在医学美容领域的应用提供参考。
1 实验部分 1.1 实验材料聚乳酸颗粒,50~60kDa,Lakeshore Biomaterials公司;2.9%氨甲环酸精华液,鲁青械备20190154,青岛溯博生物技术有限公司。
1.2 微针的制备首先利用激光雕刻机(VLS 3.5,美国Universal公司)制备具有圆锥形微针状型腔的聚二甲基硅氧烷模板,随后将聚乳酸颗粒放置在模板上,以圆形掩模固定形状。然后将其放入200℃的真空干燥箱中,保持2h至聚乳酸颗粒完全熔融,取出后压模成型。最后,将其冷却至室温,完成脱模。对制得的微针进行紫外灭菌30min,灭菌结束后,采用无菌黏合的方式将单个微针独立包装。聚乳酸微针的高度为400μm,阵列为10×10,密度为100根/cm2,微针实物图如图 1所示。

|
图 1 聚乳酸微针实物图 Fig.1 View of the polylactic acid microneedles |
本研究系前瞻性自身对照临床研究。选取2021年5月至2021年10月就诊于中日友好医院皮肤科门诊的黄褐斑患者,所有患者由两位副主任及以上医师根据患者病史及典型临床表现做出诊断。共招募患者18名,最后完成随访12名,其中男性患者1名,女性患者11名,Fitzpatrick皮肤分型均为Ⅲ~Ⅳ型。年龄28~55岁,平均(41.917±8.989)岁;病程1~17年,平均(7.000±5.460)年。
纳入标准:(1)双侧面颊部皮损对称,依据黄褐斑面积和严重程度指数(melasma area and severity index, MASI)评分表(表 1),两侧面颊部位皮损得分相同;(2)年龄18~60岁;(3)首诊患者,或者此前3个月内未使用过任何方案治疗本病的患者;(4)3个月内未服用过避孕药;(5)研究部位未合并其他皮肤病;(6)能够坚持完成随访,依从性良好。排除标准:(1)孕妇或哺乳期妇女;(2)合并糖尿病、甲状腺功能亢进等内分泌系统疾病、自身免疫性疾病或严重心、肺、肾功能不全者;(3)皮肤划痕征阳性及敏感性皮肤者;(4)瘢痕体质者;(5)从事户外工作或不能做到严格防晒者;(6)无法耐受此治疗或者对氨甲环酸精华液中的任何成分过敏者。向受试者告知研究内容和目的并征得其同意,本研究获得中日友好医院伦理委员会批准。
| 下载CSV 表 1 MASI评分表 Table 1 MASI rating scale |
根据随机对照表对入选患者编号,单数患者左侧面颊部为实验侧、右侧面颊部为对照侧,双数患者左侧面颊部为对照侧、右侧面颊部为实验侧。基线时向患者示范聚乳酸微针的使用方法:充分洁面后,用拇指及食指夹取聚乳酸微针片尾端,将微针垂直轻贴于皮损处,同时用食物与中指轻压微针背面,并以适当力度向皮肤表面垂直施压即可,确保每位患者均能正确使用。对于实验侧皮损处,使用聚乳酸微针预处理皮肤后,外用0.1mL 2.9%氨甲环酸精华液;对于对照侧皮损处,仅外用0.1mL 2.9%氨甲环酸精华液。告知患者微针使用后局部会出现淡红斑,20~30min后可自行消退。患者每日早晚充分洁面后按照上述方法外用微针及氨甲环酸精华液,避开眼周,无皮损处正常护肤。每次治疗所用的微针均为一次性。治疗一共持续8周,结束时患者来院复诊,观察各项评估指标。治疗期间嘱患者严格保湿防晒,使用日光防护指数(SPF)≥30、紫外线A防晒指数(PA)为“+++”的广谱防晒霜,外出时加用物理性遮挡(如戴宽檐遮阳帽、撑遮阳伞等);同时嘱患者清淡饮食,避免熬夜,保持心情舒畅。
1.5 疗效评估 1.5.1 MASI评分由固定接诊医师(不参与研究设计及患者分组工作)根据表 1对患者面部皮损情况进行MASI评分。
1.5.2 患者满意度评价以问卷形式调查患者对疗效的满意度,满意度分为4个等级:非常满意(改善程度>75%)、满意(改善程度为50%~75%)、一般(改善程度为25%~49%)、不满意(改善程度<25%),统计满意率(即前三项患者例数占患者总例数的百分比)。
1.5.3 无创性皮肤生理功能检测采用多功能皮肤测试仪(MPA580,德国CK公司),利用Mexameter MX18检测探头定量测定皮肤黑素指数(melanin index, MI)和红斑指数(erythema index,EI)水平。选择双侧面颊皮损处对称性分布的色素沉着区为目标区域,嘱患者放松不做表情,选择检查部位,测定检查部位距同侧口角、外眦及耳廓下缘的距离,以便固定随访时的检查部位,确保每次随访时测试点为同一部位。每个点测量3次,结果取平均值。
1.5.4 CBS云镜检查采用4K UHD超高清云镜(MindScan系列,武汉博视电子有限公司)对面部进行多光谱检测。每次检测时使用统一光源、角度拍摄左侧和右侧面部的超高像素影像,使用CBS皮肤镜图像管理系统软件(版本1.0)量化分析褐色区域、红色区域(浓度)和红色区域(面积)。
1.5.5 不良反应与患者保持联系,一旦发生不良反应,患者立即到医院复诊并进行相应处理。
1.6 统计学方法连续性变量资料以平均值±标准差(x±SD)表示,分类变量资料以数字(N)和百分比(%)表示。对于连续性变量,实验侧和对照侧的比较采用独立样本t检验,单侧治疗前后的比较采用配对样本t检验。分类变量采用卡方检验进行比较,由于总例数<40,采用Fisher确切概率法直接计算P值。所有数据均采用SPSS统计软件(版本22.0)进行分析,P < 0.05表示差异具有统计学意义。
2 结果与讨论 2.1 MASI得分表 2为实验侧和对照侧在治疗前后的MASI得分,图 2和图 3分别为实验侧和对照侧在治疗前后黄褐斑皮损的临床图片、褐色区域图片和红色区域图片。由结果可以看出,治疗前和治疗后实验侧和对照侧的MASI评分均无统计学差异(P>0.05);与治疗前相比,治疗后两侧的MASI评分均有所下降,差异具有统计学意义(实验侧P<0.001,对照侧P=0.003);实验侧和对照侧在治疗前后MASI评分的差值可以反映病情的改善情况,实验侧MASI评分的差值(9.167)大于对照侧(4.500),差异具有统计学意义(P=0.045)。以上结果显示,聚乳酸微针联合氨甲环酸精华液和单纯外用氨甲环酸精华液对黄褐斑均有治疗效果,聚乳酸微针联合氨甲环酸精华液的疗效更佳。
| 下载CSV 表 2 实验侧和对照侧在治疗前后的MASI得分(x±SD) Table 2 MASI scores of the experimental side and control side before and after treatment(x±SD) |
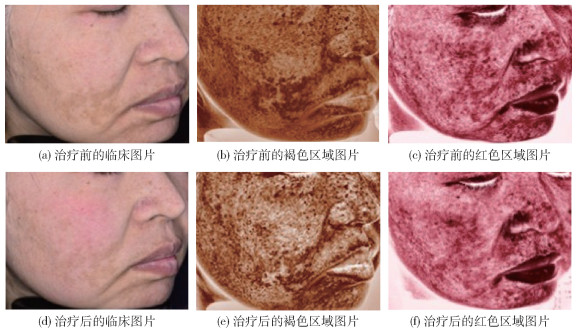
|
图 2 实验侧在治疗前后黄褐斑皮损的临床图片、褐色区域图片和红色区域图片 Fig.2 Clinical images, brown area images and red area images of melasma lesions on the experimental side before and after treatment |
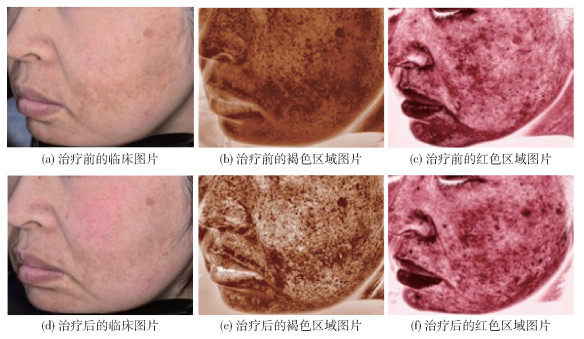
|
图 3 对照侧在治疗前后黄褐斑皮损的临床图片、褐色区域图片和红色区域图片 Fig.3 Clinical images, brown area images and red area images of melasma lesions on the control side before and after treatment |
表 3为患者对实验侧和对照侧治疗效果的满意度。患者对实验侧治疗的满意率(83.33%)大于对照侧(41.67%),二者的差异具有统计学意义(P=0.045)。结果显示,与单纯外用氨甲环酸精华液相比,患者对聚乳酸微针联合氨甲环酸精华液的治疗满意率更高,接受度也更高。
| 下载CSV 表 3 患者对实验侧和对照侧治疗效果的满意度 Table 3 Patient satisfaction with the treatment effect on the experimental side and control side |
表 4为实验侧和对照侧在治疗前后的黑素指数MI。由结果可以看出,治疗前实验侧与对照侧的MI无统计学差异(P=0.833);与治疗前相比,治疗后两侧的MI均有所下降,差异具有统计学意义(P<0.05);治疗后实验侧的MI低于对照侧,差异具有统计学意义(P=0.039);实验侧和对照侧在治疗前后MI的差值可以反映色斑的减少情况,实验侧MI的差值(97.083)大于对照侧(49.444),二者的差异具有统计学意义(P<0.001)。以上结果显示,聚乳酸微针联合氨甲环酸精华液和单纯外用氨甲环酸精华液均能有效降低黄褐斑皮损的黑色素水平,使用聚乳酸微针预处理能够更大程度地降低黑色素水平。
| 下载CSV 表 4 实验侧和对照侧在治疗前后的黑素指数(x±SD) Table 4 Melanin indices of the experimental side and control side before and after treatment(x±SD) |
表 5为实验侧和对照侧在治疗前后的红斑指数EI。由结果可以看出,治疗前和治疗后实验侧和对照侧的EI均无统计学差异(P>0.05);与治疗前相比,治疗后两侧的EI均有所下降,差异具有统计学意义(P<0.05);实验侧和对照侧在治疗前后EI的差值可以反映血管病变的改善情况,实验侧EI的差值(73.833)大于对照侧(48.889),二者的差异具有统计学意义(P=0.032)。以上结果显示,聚乳酸微针联合氨甲环酸精华液和单纯外用氨甲环酸精华液均能有效改善黄褐斑皮损处的血管病变,使用聚乳酸微针预处理能够更大程度地改善血管病变。
| 下载CSV 表 5 实验侧和对照侧在治疗前后的红斑指数(x±SD) Table 5 Erythema indices of the experimental side and control side before and after treatment(x±SD) |
表 6为实验侧和对照侧在治疗前后的黄褐斑相关CBS参数。治疗前和治疗后实验侧和对照侧的褐色区域、红色区域(浓度)、红色区域(面积)均无统计学差异(P>0.05);与治疗前相比,治疗后两侧的这3个参数均有所下降,差异具有统计学意义(P<0.05)。实验侧和对照侧在治疗前后CBS参数的差值可以反映色素和炎症的改善情况,实验侧褐色区域的差值(63.966)大于对照侧(37.397),二者的差异具有统计学意义(P=0.042),提示实验侧色素的改善情况更佳。两侧炎症相关参数的红色区域(浓度和面积)的差值无统计学差异(P>0.05),两侧局部炎症差异不明显的原因可能与黄褐斑患者的入组标准有关,入组时本研究更关注患者的面部色素沉着斑片,并未对炎症情况进行限制;此外,患者入组时所处的分期也不同,并非所有患者均处于稳定期。以上结果显示,与单纯外用氨甲环酸精华液相比,使用聚乳酸微针能够提高氨甲环酸精华液对黄褐斑色素的治疗效果,但对局部炎症无明显改善作用。
| 下载CSV 表 6 实验侧和对照侧在治疗前后的黄褐斑相关CBS参数(x±SD) Table 6 CBS parameters related to melasma of the experimental side and control side before and after treatment(x±SD) |
仅有一名患者的实验侧皮肤出现脱屑,停用微针并加强保湿后情况好转,1周后患者再次尝试使用微针治疗,直至观察期结束,未再发生类似情况。
3 结论(1) 与仅外用氨甲环酸精华液相比,高分子聚乳酸微针联合氨甲环酸精华液能够明显改善黄褐斑皮损的整体情况;聚乳酸微针可以进一步提高氨甲环酸精华液对黄褐斑皮损处黑色素水平和血管病变的疗效,但对局部炎症没有进一步改善作用。
(2) 患者对聚乳酸微针的整体接受度较高,对聚乳酸微针联合氨甲环酸精华液治疗黄褐斑的满意度高于单一外用氨甲环酸精华液,并且在治疗过程中未发现明显的不良反应。
本研究也存在一定局限性:纳入研究的受试者例数偏少,观察时间相对较短。后期将进一步扩大样本量,延长随访时间,观察聚乳酸微针联合氨甲环酸精华液治疗黄褐斑的长期疗效。
| [1] |
KWOH S H, NA J I, CHOI J Y, et al. Melasma: updates and perspectives[J]. Experimental Dermatology, 2019, 28(6): 704-708. DOI:10.1111/exd.13844 |
| [2] |
ESPÓSITO M C C, ESPÓSITO A C C, JORGE M F S, et al. Depression, anxiety, and self-esteem in women with facial melasma: an internet-based survey in Brazil[J]. International Journal of Dermatology, 2021, 60(9): e346-e347. |
| [3] |
HANDEL A C, MIOT L D, MIOT H A. Melasma: a clinical and epidemiological review[J]. Anais Brasileiros de Dermatologia, 2014, 89(5): 771-782. DOI:10.1590/abd1806-4841.20143063 |
| [4] |
MCKESEY J, TOVAR-GARZA A, PANDYA A G. Melasma treatment: an evidence-based review[J]. Ameri- can Journal of Clinical Dermatology, 2020, 21(2): 173-225. DOI:10.1007/s40257-019-00488-w |
| [5] |
YANG D, CHEN M L, SUN Y, et al. Microneedle-mediated transdermal drug delivery for treating diverse skin diseases[J]. Acta Biomaterialia, 2021, 121: 119-133. DOI:10.1016/j.actbio.2020.12.004 |
| [6] |
PRAUSNITZ M R, LANGER R. Transdermal drug delivery[J]. Nature Biotechnology, 2008, 26(11): 1261-1268. DOI:10.1038/nbt.1504 |
| [7] |
MARWAH H, GARG T, GOYAL A K, et al. Permeation enhancer strategies in transdermal drug delivery[J]. Drug Delivery, 2016, 23(2): 564-578. DOI:10.3109/10717544.2014.935532 |
| [8] |
JIN X, ZHU D D, CHEN B Z, et al. Insulin delivery systems combined with microneedle technology[J]. Advanced Drug Delivery Reviews, 2018, 127: 119-137. DOI:10.1016/j.addr.2018.03.011 |
| [9] |
VAN DER MAADEN K, JISKOOT W, BOUWSTRA J. Microneedle technologies for (trans)dermal drug and vaccine delivery[J]. Journal of Controlled Release, 2012, 161(2): 645-655. DOI:10.1016/j.jconrel.2012.01.042 |
| [10] |
RUAN S Y, ZHANG Y T, FENG N P. Microneedle-mediated transdermal nanodelivery systems: a review[J]. Biomaterials Science, 2021, 9(24): 8065-8089. DOI:10.1039/D1BM01249E |
| [11] |
CHEN B Z, LIU J L, LI Q Y, et al. Safety evaluation of solid polymer microneedles in human volunteers at different application sites[J]. ACS Applied Bio Materials, 2019, 2(12): 5616-5625. DOI:10.1021/acsabm.9b00700 |
| [12] |
HAO Y Y, YANG Y, LI Q Y, et al. Effect of polymer microneedle pre-treatment on drug distributions in the skin in vivo[J]. Journal of Drug Targeting, 2020, 28(7-8): 811-817. DOI:10.1080/1061186X.2020.1757101 |








