随着社会对化石燃料需求的不断增长和全球环境的恶化,人们迫切希望开发出一种可持续发展的清洁能源[1]。在各种形式的能源中,氢气具有清洁可再生、能量密度高的特点,被认为是最有潜力替代化石燃料的能源之一[2]。电解水析氢(HER)以大自然中广泛存在的水为原料,过程清洁可持续,因此具有良好的发展前景,但其析氢效率严重依赖于所使用的催化剂[3]。
目前,用于HER的高效催化剂仍为Pt基贵金属材料,但高成本和低储量限制了其大规模应用[4]。近年来,研究人员开发了多种HER催化剂,主要包括贵金属[5]、过渡金属硫族化合物(TMDs)[6]、过渡金属碳化物(TMCs)[7]、过渡金属氮化物(TMNs)[8]、过渡金属磷化物(TMPs)[9]、非贵金属及其合金[10]。其中,TMPs因其固有的催化活性高、结构和组成可调而受到科研人员的广泛关注。单金属磷化物Ni2P[11]、Ni5P4[12]、FeP[13]、CoP[14]已被证明是高效的HER催化剂,根据文献报道,在单金属磷化物中掺入第二种金属可以进一步提高催化剂的HER性能[15]。例如,Wang等[16]合成了双金属磷化物NiFeP薄膜,该催化剂在碱性条件下仅需99 mV的过电位即可使电流密度达到10 mA/cm2;Li等[17]将NiFeP薄片与三维海绵状石墨烯(3D SG)组合,合成的NiFeP/SG在电流密度为10 mA/cm2时所需过电位仅为115 mV;Hei等[18]合成了分层的自支撑电催化剂(NiFeP@N-CS),得益于双金属之间的协同效应和层次结构,该催化剂在碱性环境中表现出高效的HER性能。目前报道的双金属磷化物常负载于导电良好的载体上,这样可以有效避免催化剂的积聚,但这种方式制备出的磷化物颗粒较大,导致催化剂比表面积较小,催化活性位点暴露较少,限制了双金属磷化物性能的进一步提高[19-22]。介孔材料具有较高的孔隙率和较大的比表面积,被广泛应用于催化领域。Huang等[23]制备出三维有序介孔Co1-XFeXP(3DOM Co1-XFeXP)并将其应用于碱性HER,当电流密度达到10 mA/cm2时,3DOM Co0.75Fe0.25P所需的过电位仅为209 mV;Wu等[24]制备了CoP@3DOM FeP,其在碱性、中性、酸性电解质中均表现出优异的HER性能,当电流密度达到10 mA/cm2时,所需过电位分别为67.2、71.1、76.5 mV。在催化剂中引入介孔结构能够有效地避免颗粒积聚,同时减小颗粒粒径,从而提高催化性能[25]。因此,设计简单的方法制备三维有序介孔双金属磷化物并评价其HER性能具有重要意义。
本文采用硬模板法通过高温磷化成功合成了不同Ni、Fe物质的量比的三维有序介孔镍铁双金属磷化物(3DOM NiXFe1-XP),通过多种物理表征手段对其形貌和结构进行分析,并利用电化学测试探究不同物质的量比的Ni/Fe双金属结合后对HER性能的影响,得到HER性能最佳的Ni、Fe物质的量比。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料六水合硝酸镍(Ni(NO3)2 ·6H2O,纯度98%)、九水合硝酸铁(Fe(NO3)3 ·9H2O,纯度98%)、一水合次磷酸钠(NaH2PO2 ·H2O,纯度98%)、氢氧化钠(NaOH,纯度98%)、L-赖氨酸(C6H14N2O2,纯度98%),阿拉丁试剂有限公司;正硅酸乙酯(TEOS,分析纯)、无水乙醇(C2H5OH,分析纯)、浓硫酸(H2SO4,纯度98%),北京通广精细化工公司;氮气(N2,纯度99.999%)、氩气(Ar,纯度99.999%),北京顺安奇特气体公司;5%(质量分数)Nafion溶液,Sigma-Aldrich公司;JM 20%铂碳(Pt/C),Johnson Matthey公司。
1.1.2 实验仪器ZNC L-GS190*90型数显恒温油浴锅,北京星德精仪实验仪器有限公司;BF51866KC-1型马弗炉,美国Thermo公司;RXL-15型管式炉,全硕电炉有限公司;TGL-16C型离心机,上海安亭科学仪器厂;Gamry Reference 600型电化学工作站,Gamry仪器公司;CPR型旋转圆盘电极,Pine仪器公司;玻碳电极(裸电极),天津艾达恒晟科技发展有限公司;Hitachi-7700型透射电子显微镜(TEM),日本Hitachi公司;Rigaku D/max2500 VB2+/PC型X射线衍射仪(XRD),日本Rigaku公司;ASAP 2460型物理吸附仪(BET),美国麦克公司;Agilent ICPOES730型电感耦合等离子体分析仪(ICP),美国安捷伦公司;Thermo ESCALAB 250Xi型X射线光电子能谱分析仪(XPS),美国Thermo公司。
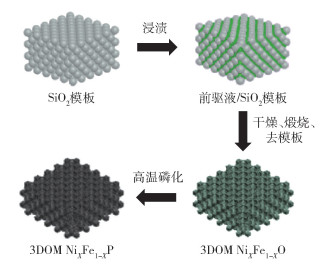
1.2 3DOM NiXFe1-XP的制备3DOM NiXFe1-XP的制备流程如图 1所示,其详细制备过程如下。
|
图 1 3DOM NiXFe1-XP的制备流程图 Fig.1 Flow chart for the preparation of 3DOM NiXFe1-XP |
依次称量0.127 g L-赖氨酸、120 mL去离子水、8 g无水乙醇于三口烧瓶中,放置于油浴锅中,仪器参数设置为500 r/min、90 ℃。称取15 g TEOS,预热至90 ℃后加入三口烧瓶中,反应24 h后得到SiO2胶体。然后对所得SiO2胶体在室温下进行自然沉降,待溶液挥发完全后得到三维有序排列的SiO2胶体晶体。最后在马弗炉中将SiO2胶体晶体于550 ℃下煅烧12 h,得到SiO2模板。
1.2.2 3DOM NiXFe1-XO的制备称量总物质的量为10 mmol的Ni(NO3)2 ·6H2O、Fe(NO3)3 ·9H2O(Ni与Fe物质的量比分别为9 ∶1,7 ∶3,5 ∶5,3 ∶7,1 ∶9)、10 mL H2O于烧杯中,搅拌至硝酸盐完全溶解。然后称取1 g SiO2模板加入上述前驱液中,先在室温下浸渍2 h,然后在80 ℃下蒸发水分5 h使前驱液浓缩,之后取出充满前驱体的SiO2模板,放入80 ℃烘箱中干燥。将干燥后的样品在管式炉中以1 ℃/min的速率升温至300 ℃,在Ar气氛下煅烧3 h,得到NiO/SiO2复合物。最后用2 mol/L NaOH溶液在80 ℃下去除SiO2模板,经水、无水乙醇交替清洗产物数次,干燥后得到3DOM NiXFe1-XO。
1.2.3 3DOM NiXFe1-XP的制备称取0.5 g NaH2PO2 ·H2O以及0.05 g 3DOM NiXFe1-XO,分别置于石英管上游和下游,以1 ℃/min的速率升温至300 ℃,并在Ar气氛下保持3 h,随后自然冷却至室温。经过水、无水乙醇交替清洗产物数次,干燥后得到3DOM NiXFe1-XP。
1.3 3DOM Ni2P、3DOM FeP、Ni0.7Fe0.3P纳米颗粒的制备3DOM Ni2P和3DOM FeP的制备方法与3DOM NiXFe1-XP相似,仅需要在前驱液中分别去除Fe(NO3)3 ·9H2O和Ni(NO3)2 ·6H2O。Ni0.7Fe0.3P纳米颗粒(Ni0.7Fe0.3P NPs)的制备与3DOM NiXFe1-XP相似,但无需加入和去除SiO2模板。
1.4 结构及形貌表征采用透射电子显微镜表征样品的微观形貌;采用物理吸附仪表征样品的比表面积及孔径分布;采用电感耦合等离子体分析仪测定样品的元素含量;采用X射线衍射仪分析样品的晶型结构;采用X射线光电子能谱分析仪分析样品的表面元素状态。
1.5 电化学性能测试采用三电极体系对催化剂进行电化学性能测试。其中,工作电极为催化剂涂覆的玻碳电极,对电极为Pt片,参比电极为Ag/AgCl电极。工作电极的制备过程为:取5 mg待测催化剂分散于1 mL无水乙醇中,超声至催化剂分散均匀,向其中加入20 μL 5%Nafion溶液,随后超声30 min。用微量进样器移取5 μL催化剂墨水滴加在清洗干净的玻碳电极表面,待催化剂在电极表面均匀成膜后即可用于电化学测试。
采用电化学工作站进行电化学测试。在每次测试开始前,先向电解质溶液(0.5 mol/L H2SO4)中通入N2约30 min以除去其中溶解的O2。首先通过循环伏安(CV)测试对电极进行活化以使电极保持稳定状态。本实验用于活化的电位区间设置为0.00~-0.60 V(vs. RHE),扫描速率为100 mV/s,扫描圈数为30圈。随后对其进行线性扫描(LSV)测试,电位区间设置为0.00~-0.60 V(vs. RHE),扫描速率为10 mV/s。利用不同扫描速率下的CV测试计算得到双电层电容,扫描速率分别设置为20、40、60、80、100 mV/s,电位区间为0.07~0.22 V(vs. RHE)。电化学阻抗(EIS)测试的电位为-0.14 V(vs. RHE),交流电压频率为100 kHz~0.1 Hz。利用计时电流和加速退化测试来表征催化剂的稳定性,设置的电位为-0.132 V(vs.RHE)。使用电解液电阻R对所有电化学数据进行iR校正。本实验所测电位均需换算为可逆氢电位(ERHE),换算公式如下。
| $ E_{\mathrm{RHE}}=E_{\mathrm{Ag} / \mathrm{AgCl}}+0.059 \mathrm{pH}+0.197 $ |
式中:EAg/AgCl为Ag/AgCl标准电极电位。
2 结果与讨论 2.1 表征结果图 2(a)为SiO2模板的TEM图,该SiO2纳米球排列紧密,形貌整齐有序,球径均匀,约为20 nm。图 2(b)、2(c)、2(d)分别为3DOM Ni2P、3DOM FeP、3DOM Ni0.7Fe0.3P的TEM图。由结果可见,所得的样品成功地反向复制了SiO2模板的有序介孔结构,并且孔道之间相互贯通,排列整齐,孔径约为12 nm,相较于SiO2纳米球球径减小了约40%,这可能是金属框架在高温下出现收缩所致[26]。这种相互连通的大介孔结构不仅可以暴露更多的催化活性位点,还能够促进HER过程中的质量和电子传递[27-28]。此外,还可以观察到催化剂颗粒的粒径约为10 nm,较小的粒径有利于催化剂活性位点更多地暴露出来,从而加快HER进程[25]。

|
图 2 SiO2模板、3DOM Ni2P、3DOM FeP、3DOM Ni0.7Fe0.3P的TEM图 Fig.2 TEM images of the SiO2 template, 3DOM Ni2P, 3DOM FeP and 3DOM Ni0.7Fe0.3P |
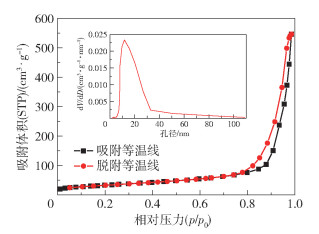
图 3为3DOM Ni0.7Fe0.3P的氮气吸脱附等温线和孔径分布曲线,氮气吸脱附等温线存在明显的滞后环,说明材料中形成了介孔结构[29]。通过计算得到3DOM Ni0.7Fe0.3P的比表面积为117.75 m2/g,孔容为0.835 cm3/g,较大的比表面积和孔容能够使催化剂暴露更多的活性位点,从而加快HER过程的进行。由3DOM Ni0.7Fe0.3P的Barret-Joyner-Halenda(BJH)孔径分布曲线可以看出,该曲线在11.3 nm处出现尖峰,说明其介孔尺寸集中于11.3 nm,这与TEM观察到的结果大致相同。
|
图 3 3DOM Ni0.7Fe0.3P的氮气吸脱附等温线和孔径分布曲线 Fig.3 Nitrogen adsorption-desorption isotherms and pore size distribution curve for 3DOM Ni0.7Fe0.3P |
表 1为3DOM NiXFe1-XP的ICP测试结果,可以看出,3DOM NiXFe1-XP中Ni与Fe物质的量比的实际值与理论值相近。
| 下载CSV 表 1 3DOM NiXFe1-XP的ICP分析结果 Table 1 ICP analysis results for 3DOM NiXFe1-XP |
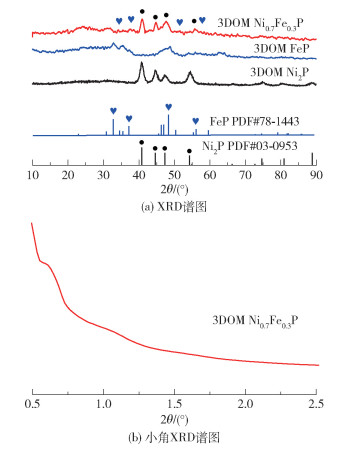
图 4(a)为3DOM Ni0.7Fe0.3P、3DOM Ni2P、3DOM FeP的XRD谱图。3DOM Ni2P、3DOM FeP的衍射峰与其标准卡片相符,3DOM Ni0.7Fe0.3P结合了以上两种磷化物的特征峰,说明通过本文的实验方法成功合成了镍铁双金属磷化物。利用谢乐公式计算其粒径,得到3种物质的粒径均约为10 nm,这与TEM观察到的结果相一致。图 4(b)为3DOM Ni0.7Fe0.3P的小角XRD谱图,可以看出该物质存在较为有序的介孔结构。
|
图 4 3DOM Ni0.7Fe0.3P、3DOM Ni2P、3DOM FeP的XRD谱图和3DOM Ni0.7Fe0.3P的小角XRD谱图 Fig.4 XRD patterns of 3DOM Ni0.7Fe0.3P, 3DOM Ni2P and 3DOM FeP, and the small angle XRD pattern of 3DOM Ni0.7Fe0.3P |
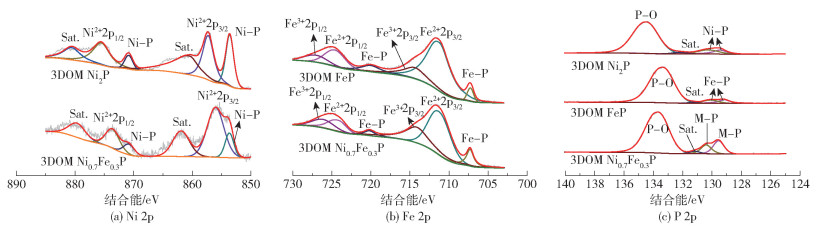
图 5为3DOM Ni0.7Fe0.3P、3DOM Ni2P和3DOM FeP的XPS谱图。图 5(a)中,3DOM Ni0.7Fe0.3P在结合能为853.6、870.9 eV处的特征峰对应于Ni—P键,相比于3DOM Ni2P,结合能降低了约0.1 eV;855.9、873.7 eV处的特征峰对应于Ni—O键中的Ni2+2p3/2、Ni2+2p1/2;861.9、879.9 eV处的特征峰为其相应的卫星峰(Sat.)[30]。类似地,图 5(b)中,3DOM Ni0.7Fe0.3P在结合能为707.3、720.1 eV处的特征峰对应于Fe—P键,其结合能相比于3DOM FeP同样降低了约0.1 eV;位于711.3、724.2 eV处的特征峰对应于Fe—O键中的Fe2+ 2p3/2、Fe2+ 2p1/2;714.1、726.1 eV处的特征峰对应于Fe—O键中的Fe3+ 2p3/2、Fe3+ 2p1/2[30]。其中,Ni 2p和Fe 2p中氧化峰的出现是由于其表面暴露在空气中被氧化或者氧化物磷化不完全所致[31],Ni—P、Fe—P键结合能的降低表明双金属的结合可以增加Ni、Fe的电子密度,提高金属位点对电子的捕获能力[32]。图 5(c)中,3DOM Ni0.7Fe0.3P在结合能为129.6、130.4 eV处的特征峰对应于金属Ni/Fe(M)—P键,相比于3DOM Ni2P和3DOM FeP,其结合能处于中间能态;133.7 eV处的特征峰对应于P—O键;131.2 eV处的特征峰为其相应的卫星峰[32]。与3DOM Ni2P、3DOM FeP相比,3DOM Ni0.7Fe0.3P的M—P键发生了一定程度的偏移,说明双金属结合会对催化剂的电子结构产生一定程度的影响,这有利于HER过程中的电荷转移[32]。
|
图 5 3DOM Ni0.7Fe0.3P、3DOM Ni2P和3DOM FeP的XPS谱图 Fig.5 XPS spectra of 3DOM Ni0.7Fe0.3P, 3DOM Ni2P and 3DOM FeP |
图 6为不同催化剂在0.5 mol/L H2SO4中测得的HER性能曲线,表 2为不同催化剂的HER性能数据。图 6(a)为各催化剂的LSV曲线,从图中可以得出,相较于其他镍铁磷化物催化剂,3DOM Ni0.7Fe0.3P表现出最优异的HER性能。在电流密度为10 mA/cm2时,3DOM Ni0.7Fe0.3P的过电位(η10)仅为132 mV,低于3DOM Ni0.9Fe0.1P(151 mV)、3DOM Ni0.5Fe0.5P(140 mV)、3DOM Ni0.3Fe0.7P(152 mV)、3DOM Ni0.1Fe0.9P(160 mV)。由结果分析可知,随着Fe含量的增加,不同Ni、Fe比例3DOM NiXFe1-XP的过电位η10呈现先降低后升高的趋势,且均低于3DOM Ni2P(172 mV)、3DOM FeP(197 mV)。这归因于Ni、Fe两种金属有效结合产生的协同效应,促进了HER过程中的电子转移[33]。同时,还可以观察到3DOM Ni0.7Fe0.3P的过电位η10明显低于Ni0.7Fe0.3P NPs(235 mV),这说明三维有序大介孔结构的形成有利于HER的进行。

|
图 6 不同催化剂在0.5 mol/L H2SO4中测得的HER性能曲线 Fig.6 HER performance curves of different catalysts measured in 0.5 mol/L H2SO4 |
| 下载CSV 表 2 不同催化剂的HER性能数据 Table 2 HER performance data of different catalysts |
利用由LSV结果得到的Tafel图(图 6(b))对各催化剂的HER催化动力学进行探讨。从图 6(b)中可以看出,相较于其他镍铁磷化物催化剂,3DOM Ni0.7Fe0.3P表现出最低的Tafel斜率(59 mV/dec),表明3DOM Ni0.7Fe0.3P具有优异的反应动力学。图 6(c)为各催化剂的Nyquist曲线(小图为等效电路图),半圆的直径代表其电荷转移阻力值(Rct)。3DOM Ni0.7Fe0.3P具有最小的Rct值(8 Ω),说明其具有最快的电荷转移速率。3DOM Ni0.7Fe0.3P与Ni0.7Fe0.3P NPs仅存在结构上的差异,但3DOM Ni0.7Fe0.3P的Tafel斜率和Rct都远小于Ni0.7Fe0.3P NPs,这说明三维有序大介孔结构可以提高传质速率,加快动力学进程[34]。催化剂的电化学活性面积(ECSA)与其双电层电容(Cdl)呈线性正相关关系。图 6(d)为各催化剂的双电层电容值,其中3DOM Ni0.7Fe0.3P的Cdl为19.8 mF/cm2,ECSA为495.0 cm2,大于其他催化剂。3DOM Ni0.7Fe0.3P的ECSA分别是Ni0.7Fe0.3P NPs、3DOM Ni2P、3DOM FeP的3.1、2.2、2.5倍,这可归因于有序介孔结构增加了催化活性位点的暴露数目[27]以及Ni、Fe两种金属的结合对催化剂的电子分布产生影响,使之产生更多的催化活性位点[35]。从表 2的HER性能数据中可以看出,各种3DOM NiXFe1-XP的HER性能均优于3DOM Ni2P和3DOM FeP,并且在n(Ni) ∶n(Fe)为7 ∶3时性能达到最佳。
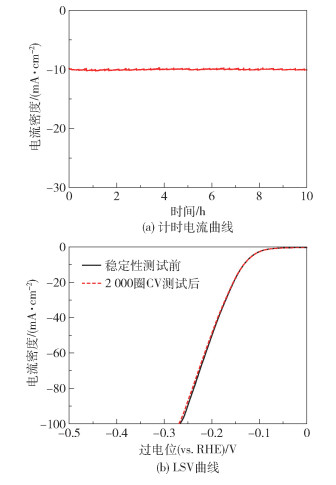
催化剂的稳定性是评价催化剂性能优劣的重要标准之一。图 7(a)为3DOM Ni0.7Fe0.3P在-0.132 V(vs. RHE)的过电位下测得的计时电流曲线,可以看出在10 h电化学测试后,其电流几乎没有衰减,表明3DOM Ni0.7Fe0.3P催化剂在长期电化学过程中具有良好的稳定性。图 7(b)为3DOM Ni0.7Fe0.3P在2 000圈CV测试前后的LSV曲线,可以观察到循环前后两条LSV曲线变化甚微,进一步证明了3DOM Ni0.7Fe0.3P在0.5 mol/L H2SO4中具有优越的稳定性。
|
图 7 3DOM Ni0.7Fe0.3P的计时电流曲线和CV稳定性测试前后的LSV曲线 Fig.7 Timing current curve and LSV curves before and after CV stability tests for 3DOM Ni0.7Fe0.3P |
(1) 采用硬模板法通过高温磷化制备了不同Ni与Fe物质的量比的3DOM NiXFe1-XP,这些样品成功地反向复制了SiO2模板的有序介孔结构,介孔之间排列整齐并相互贯通,孔径约为12 nm。
(2) 得益于双金属有效结合引起的协同增强效应,各种3DOM NiXFe1-XP的HER性能均优于3DOM Ni2P和3DOM FeP。
(3) 随着Fe含量的增加,3DOM NiXFe1-XP的HER性能呈现先升高后降低的趋势,在Ni与Fe物质的量比为7 ∶3时HER性能达到最优;当电流密度达到10 mA/cm2时,3DOM Ni0.7Fe0.3P所需的过电位为132 mV,Tafel斜率为59 mV/dec,并表现出优异的电化学稳定性。
| [1] |
LEI Q, WANG B G, WANG P C, et al. Hydrogen generation with acid/alkaline amphoteric water electrolysis[J]. Journal of Energy Chemistry, 2019, 38: 162-169. DOI:10.1016/j.jechem.2018.12.022 |
| [2] |
CHU S, CUI Y, LIU N. The path towards sustainable energy[J]. Nature Materials, 2017, 16(1): 16-22. DOI:10.1038/nmat4834 |
| [3] |
HOSSAIN A, SAKTHIPANDI K, ATIQUE ULLAH A K M, et al. Recent progress and approaches on carbon-free energy from water splitting[J]. Nano-Micro Letters, 2019, 11(1): 103. DOI:10.1007/s40820-019-0335-4 |
| [4] |
DU Y M, WANG W S, ZHAO H M, et al. Ni2P interlayer and Mn doping synergistically expedite the hydrogen evolution reaction kinetics of Co2P[J]. Chemistry-A European Journal, 2021, 27(10): 3536-3541. DOI:10.1002/chem.202005162 |
| [5] |
TSOUNIS C, SUBHASH B, KUMAR P V, et al. Pt single atom electrocatalysts at graphene edges for efficient alkaline hydrogen evolution[J]. Advanced Functional Materials, 2022, 32(38): 2203067. DOI:10.1002/adfm.202203067 |
| [6] |
GENG S, TIAN F Y, LI M G, et al. Activating interfacial S sites of MoS2 boosts hydrogen evolution electrocatalysis[J]. Nano Research, 2022, 15(3): 1809-1816. DOI:10.1007/s12274-021-3755-7 |
| [7] |
LASZCZYŃSKA A, TYLUS W, SZCZYGIEŁ I. Electrocatalytic properties for the hydrogen evolution of the electrodeposited Ni-Mo/WC composites[J]. International Journal of Hydrogen Energy, 2021, 46(44): 22813-22831. DOI:10.1016/j.ijhydene.2021.04.103 |
| [8] |
SUN J W, XU W J, LV C X, et al. Co/MoN hetero-interface nanoflake array with enhanced water dissociation capability achieves the Pt-like hydrogen evolution catalytic performance[J]. Applied Catalysis B: Environmental, 2021, 286: 119882. DOI:10.1016/j.apcatb.2021.119882 |
| [9] |
ZHANG H, LI W Q, FENG X, et al. A chainmail effect of ultrathin N-doped carbon shell on Ni2P nanorod arrays for efficient hydrogen evolution reaction catalysis[J]. Journal of Colloid and Interface Science, 2022, 607: 281-289. DOI:10.1016/j.jcis.2021.08.169 |
| [10] |
ZHANG T, DEBOW S, SONG F Z, et al. Interface catalysis of nickel molybdenum (NiMo) alloys on two-dimensional (2D) MXene for enhanced hydrogen electrochemistry[J]. The Journal of Physical Chemistry Letters, 2021, 12(46): 11361-11370. DOI:10.1021/acs.jpclett.1c02676 |
| [11] |
POPCZUN E J, MCKONE J R, READ C G, et al. Nanostructured nickel phosphide as an electrocatalyst for the hydrogen evolution reaction[J]. Journal of the American Chemical Society, 2013, 135(25): 9267-9270. DOI:10.1021/ja403440e |
| [12] |
DING G S, ZHANG Y X, DONG J, et al. Fabrication of Ni2P/Ni5P4 nanoparticles embedded in three-dimensional N-doped graphene for acidic hydrogen evolution reaction[J]. Materials Letters, 2021, 299: 130071. DOI:10.1016/j.matlet.2021.130071 |
| [13] |
JIANG P, LIU Q, LIANG Y H, et al. A cost-effective 3D hydrogen evolution cathode with high catalytic activity: FeP nanowire array as the active phase[J]. Angewandte Chemie International Edition, 2014, 53(47): 12855-12859. DOI:10.1002/anie.201406848 |
| [14] |
TIAN J Q, LIU Q, ASIRI A M, et al. Self-supported nanoporous cobalt phosphide nanowire arrays: an efficient 3D hydrogen-evolving cathode over the wide range of pH 0-14[J]. Journal of the American Chemical Society, 2014, 136(21): 7587-7590. DOI:10.1021/ja503372r |
| [15] |
ZHAO X D, KONG X L, LIU Z L, et al. The cutting-edge phosphorus-rich metal phosphides for energy storage and conversion[J]. Nano Today, 2021, 40: 101245. DOI:10.1016/j.nantod.2021.101245 |
| [16] |
WANG D W, ZHU Y D, LEI S, et al. Epitaxial growth of prussian blue analogue derived NiFeP thin film for efficient electrocatalytic hydrogen evolution reaction[J]. Journal of Solid State Chemistry, 2021, 293: 121779. DOI:10.1016/j.jssc.2020.121779 |
| [17] |
LI R Q, WANG B L, GAO T, et al. Monolithic electrode integrated of ultrathin NiFeP on 3D strutted graphene for bifunctionally efficient overall water splitting[J]. Nano Energy, 2019, 58: 870-876. DOI:10.1016/j.nanoen.2019.02.024 |
| [18] |
HEI J C, XU G C, WEI B, et al. NiFeP nanosheets on N-doped carbon sponge as a hierarchically structured bifunctional electrocatalyst for efficient overall water splitting[J]. Applied Surface Science, 2021, 549: 149297. DOI:10.1016/j.apsusc.2021.149297 |
| [19] |
SUN Q Q, ZHOU M, SHEN Y Q, et al. Hierarchical nanoporous Ni (Cu) alloy anchored on amorphous NiFeP as efficient bifunctional electrocatalysts for hydrogen evolution and hydrazine oxidation[J]. Journal of Catalysis, 2019, 373: 180-189. DOI:10.1016/j.jcat.2019.03.039 |
| [20] |
WANG S, CAI J G, LV C, et al. General and scalable preparation of Prussian blue analogues on arbitrary conductive substrates and their derived metal phosphides as highly efficient and ultra-long-life bifunctional electrocatalysts for overall water splitting[J]. Chemical Engineering Journal, 2021, 420: 129972. DOI:10.1016/j.cej.2021.129972 |
| [21] |
DU C, YANG L, YANG F L, et al. Nest-like NiCoP for highly efficient overall water splitting[J]. ACS Catalysis, 2017, 7(6): 4131-4137. DOI:10.1021/acscatal.7b00662 |
| [22] |
LIANG H F, GANDI A N, ANJUM D H, et al. Plasma-assisted synthesis of NiCoP for efficient overall water splitting[J]. Nano Letters, 2016, 16(12): 7718-7725. DOI:10.1021/acs.nanolett.6b03803 |
| [23] |
HUANG Y R, LI M G, YANG W W, et al. 3D ordered mesoporous cobalt ferrite phosphides for overall water splitting[J]. Science China Materials, 2020, 63(2): 240-248. DOI:10.1007/s40843-019-1171-3 |
| [24] |
WU Y C, WANG Y J, WANG Z W, et al. Highly dispersed CoP on three-dimensional ordered mesoporous FeP for efficient electrocatalytic hydrogen production[J]. Journal of Materials Chemistry A, 2021, 9(41): 23574-23581. DOI:10.1039/D1TA06574B |
| [25] |
SUN T T, SHAN N N, XU L B, et al. General synthesis of 3D ordered macro-/mesoporous materials by templating mesoporous silica confined in opals[J]. Chemistry of Materials, 2018, 30(5): 1617-1624. DOI:10.1021/acs.chemmater.7b04829 |
| [26] |
LIU H J, CUI W J, JIN L H, et al. Preparation of three-dimensional ordered mesoporous carbon sphere arrays by a two-step templating route and their application for supercapacitors[J]. Journal of Materials Chemistry, 2009, 19(22): 3661-3667. DOI:10.1039/b819820a |
| [27] |
LUO Z, MIAO R, HUAN T D, et al. Mesoporous MoO3-X material as an efficient electrocatalyst for hydrogen evolution reactions[J]. Advanced Energy Materials, 2016, 6(16): 1600528. DOI:10.1002/aenm.201600528 |
| [28] |
ZHANG C, GAO Z C, ZHAO L, et al. Periodically ordered mesoporous iron phosphide for highly efficient electrochemical hydrogen evolution[J]. Journal of Colloid and Interface Science, 2020, 569: 68-75. DOI:10.1016/j.jcis.2020.02.070 |
| [29] |
RAN W, DONG J, SUN T T, et al. Iron, cobalt, and nitrogen tri-doped ordered mesoporous carbon as a highly efficient electrocatalyst for oxygen reduction reaction[J]. ChemistrySelect, 2019, 4(26): 7728-7733. DOI:10.1002/slct.201901641 |
| [30] |
GAO M L, GAO P P, LEI T, et al. FeP/Ni2P nanosheet arrays as high-efficiency hydrogen evolution electrocatalysts[J]. Journal of Materials Chemistry A, 2022, 10(29): 15569-15579. DOI:10.1039/D2TA02499C |
| [31] |
LIANG H F, GANDI A N, XIA C, et al. Amorphous NiFe-OH/NiFeP electrocatalyst fabricated at low temperature for water oxidation applications[J]. ACS Energy Letters, 2017, 2(5): 1035-1042. DOI:10.1021/acsenergylett.7b00206 |
| [32] |
ZHANG Y, XU J, DING Y G, et al. Tuning the d-band center enables nickel-iron phosphide nanoprisms as efficient electrocatalyst towards oxygen evolution[J]. International Journal of Hydrogen Energy, 2020, 45(35): 17388-17397. DOI:10.1016/j.ijhydene.2020.04.213 |
| [33] |
ZHU Q H, QIU B C, DUAN H, et al. Electron directed migration cooperated with thermodynamic regulation over bimetallic NiFeP/g-C3N4 for enhanced photocatalytic hydrogen evolution[J]. Applied Catalysis B: Environmental, 2019, 259: 118078. DOI:10.1016/j.apcatb.2019.118078 |
| [34] |
KIM J, KANI K, KIM J, et al. Mesoporous Rh nanoparticles as efficient electrocatalysts for hydrogen evolution reaction[J]. Journal of Industrial and Engineering Chemistry, 2021, 96: 371-375. DOI:10.1016/j.jiec.2021.02.003 |
| [35] |
ZHANG H B, ZHOU W, DONG J C, et al. Intramolecular electronic coupling in porous iron cobalt (oxy)phosphide nanoboxes enhances the electrocatalytic activity for oxygen evolution[J]. Energy & Environmental Science, 2019, 12(11): 3348-3355. |








