能源是人类赖以生存的物质基础,是国民经济与社会发展的重要资源。目前,全球80%的能量需求来源于化石燃料,化石燃料不仅不可再生,而且在使用时容易造成环境污染。能源枯竭、环境污染已成为威胁人类生存发展的重要问题,对社会长期稳定发展造成重大影响,因此开发可再生的清洁能源已成为人们面临的首要任务。氢气作为一种清洁能源[1-2],具有能量密度高、可再生、清洁环保、使用方便等众多优点[3-4],因此受到人们的广泛关注,具有良好的发展前景。
目前,工业上制造氢气的方法主要有电解水制氢[5-7]和矿物燃料制氢,前者需要贵金属作为催化剂,而后者依赖于不可再生的化石能源,不利于大规模长期发展,因此寻找合适的催化剂显得尤为重要。团簇催化剂因具有较高的原子利用效率、独特的物理化学性质、优异的催化性能以及良好的可回收利用性等优点而受到广泛关注。团簇CrPS4作为一种优良的磁性材料,在磁学及光学领域中的研究较为深入。Diehl等[8]首次合成出CrPS4并对其晶体结构进行分析,发现CrPS4是一种层状结构,层间范德华力较弱,可以被剥离成单层结构。Lee等[9]对CrPS4的结构和光学性质进行了研究,发现单层CrPS4具有较高的光化学活性,对于原子级磁性半导体的研究和应用具有重要意义。Neal等[10]对CrPS4的近场红外光谱进行了研究,探究了近场响应随CrPS4层数变化的差异,发现CrPS4没有对称交叉现象出现,为该团簇在光学领域的发展奠定了基础。Zhuang等[11]对团簇CrPS4进行了密度泛函理论研究,提出单层CrPS4作为光催化剂在分解水生成氢气方面具有潜在的应用价值。目前,对团簇CrPS4在催化析氢方面的探索尚有诸多不足,现有研究仅从CrPS4单层结构带边位置的能量方面出发推测其具有良好的催化析氢能力,并没有对CrPS4的具体析氢过程进行分析。因此,本文基于密度泛函理论,对团簇CrPS4的催化析氢性能进行分析,以期为团簇CrPS4在催化析氢方面的研究和应用提供参考。
1 计算方法与催化析氢机理 1.1 计算方法根据拓扑学原理[11-15],利用密度泛函理论[16-18],采用B3LYP泛函和def2-tzvp基组[19-21],并运用Gaussian09对团簇CrPS4的基础构型分别在二重态和四重态下进行优化。需要满足的优化收敛条件为:最大作用力<0.000 45,均方根作用力<0.000 30,最大位移<0.001 80,均方根位移<0.001 20,最终排除相同构型和含有虚频的不稳定构型后,得到16种稳定构型,其中二重态和四重态各8种。然后利用内禀反应坐标(IRC)对这16种构型进行验证,描述在不考虑热运动因素下最理性的变化轨迹,证明了所得构型为最优构型,后期计算由Multiwfn程序辅助完成。以上所有运算和数据处理均在计算机hp-z440上完成。
1.2 催化析氢反应机理以团簇CrPS4(用M表示)为析氢反应的模拟对象,其催化水解析氢机理主要分为以下两步[22-23]。
第一步 M+e-+H2O
第二步 有两种反应途径:
| $ \begin{aligned} & \mathrm{M}-\mathrm{H}_{\text {ads }}+\mathrm{e}^{-}+\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{M}+\mathrm{H}_2+\mathrm{OH}^{-} \\ & 2 \mathrm{M}-\mathrm{H}_{\mathrm{ads}} \longrightarrow 2 \mathrm{M}+\mathrm{H}_2 \end{aligned} $ |
其中,Hads表示吸附在团簇CrPS4上的H原子,下文以M—H表示团簇吸附H原子后的(CrPS4)—Hads模型。
2 团簇CrPS4稳定性分析为了确保所研究的CrPS4催化析氢构型均能稳定存在,本文分别从结构方面与热力学方面对团簇CrPS4的稳定性进行分析。
2.1 团簇CrPS4的稳定构型本文以平面形、三角双锥带帽型、四角双锥型、五棱锥型这4种构型为基础,通过改变各原子之间的相对位置,设计出20种基础构型,利用Gaussian09运行优化后最终得到16种稳定构型,其中,平面形2种(构型1(4)和2(4)),四棱锥带帽型2种(构型5(4)和7(2)),四角双锥型1种(构型6(2)),其余11种均为三角双锥带帽型。以能量最低的构型1(4)为基准,其余构型的能量用相对值表示,将这16种构型按能量由低到高进行排列,结果如图 1所示,其中上角标括号内的数字表示构型的自旋多重度。
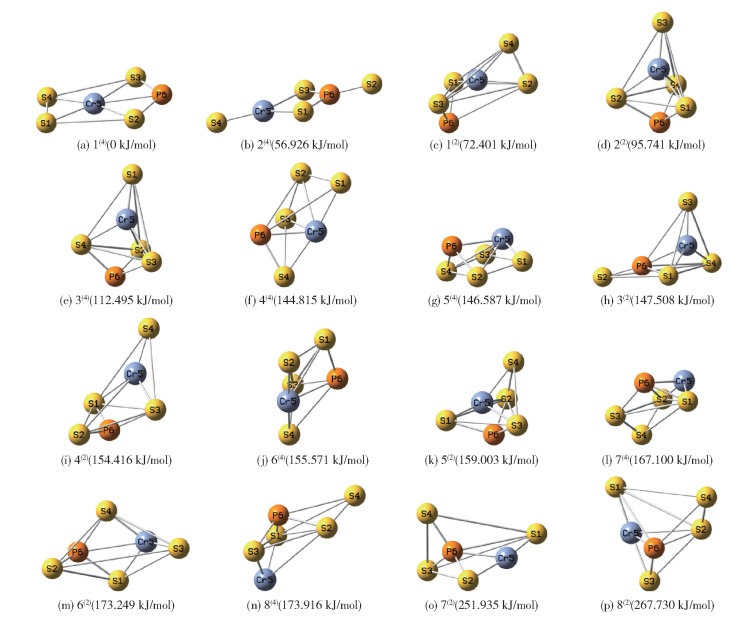
|
图 1 团簇CrPS4的优化构型图 Fig.1 Optimized configuration diagrams of the CrPS4 cluster |
能量是判定物质热力学稳定性的重要标准。本文计算了团簇CrPS4优化构型的能量参数,结果如表 1所示。具体计算方法为:以最稳定构型1(4)为基准,将其校正能(EZPE,粒子在绝对零度时振动所具有的能量)、吉布斯自由能(G)、结合能(EBE)均设为0 kJ/mol,其他构型的对应能量均以构型1(4)为基础用相对值表示;为便于分析,吉布斯自由能变(ΔG)的数据仍采用原始绝对值表示。各构型的EZPE和G的绝对数值均从优化构型数据中获得,而EBE和ΔG的绝对数值则由以下公式计算得到。
| $ \begin{array}{l} \;\;\;\;\;\;\;E_{\mathrm{BE}}=E_{\mathrm{ZPE}}(\mathrm{Cr})+E_{\mathrm{ZPE}}(\mathrm{P})+4 E_{\mathrm{ZPE}}(\mathrm{S})-E_{\mathrm{ZPE}} \\ \left(\mathrm{CrPS}_4\right) \\ \;\;\;\;\;\;\;\Delta G=G\left(\mathrm{CrPS}_4\right)-G(\mathrm{Cr})-G(\mathrm{P})-4 G(\mathrm{S}) \\ \end{array} $ |
| 下载CSV 表 1 团簇CrPS4优化构型的能量参数 Table 1 Energy parameters for the optimized configurations of the CrPS4 cluster |
各原子的EZPE和G均通过Gaussian09运行得到。
| $ \begin{aligned} & E_{\mathrm{ZPE}}(\mathrm{Cr})=-2\;741\;992.\;125\;\mathrm{kJ} / \mathrm{mol} \\ & E_{\mathrm{ZPE}}(\mathrm{P})=-896\;032.\;125\;\mathrm{kJ} / \mathrm{mol} \\ & E_{\mathrm{ZPE}}(\mathrm{S})=-1\;045\;296.\;621\;\mathrm{kJ} / \mathrm{mol} \\ & G(\mathrm{Cr})=-2\;742\;035.\;761\;\mathrm{kJ} / \mathrm{mol} \\ & G(\mathrm{P})=-896\;074.\;620\;\mathrm{kJ} / \mathrm{mol}\\ & G(\mathrm{S})=-1\;045\;338.\;454\;\mathrm{kJ} / \mathrm{mol} \end{aligned} $ |
由表 1校正能EZPE可知,16种构型按照热力学稳定性由低到高的顺序依次为:1(4) < 2(4) < 1(2) < 2(2) < 3(4) < 4(4) < 5(4) < 3(2) < 4(2) < 6(4) < 5(2) < 7(4) < 6(2) < 8(4) < 7(2) < 8(2)。可以看出,构型1(4)的能量最低,热力学稳定性最好;构型8(2)的能量最高,热力学稳定性最差;二者校正能的差值为267.730 kJ/mol。
结合能EBE是判断构型热力学稳定性的重要因素之一,粒子由自由态结合到一起必然要克服外力做功,对外做功越多,粒子做功释放到外界的能量越多,粒子间结合越紧密,物质越稳定,做功过程所释放的能量即为结合能。由此不难推出结合能越高,团簇分子越稳定;结合能越低,团簇分子结合越松散,越不稳定。由表 1中的EBE数据可知,构型1(4)的结合能最高,最为稳定,而构型8(2)的结合能最低,最不稳定,二者结合能的差值为267.730 kJ/mol,相差较大。
吉布斯自由能变ΔG的实质是热力学第二定律,可以作为反应进行方向的判定标准,ΔG<0时,物质可以通过反应自发生成。由表 1可知,所有构型的ΔG均小于0,说明在标准大气压下,当温度为298.15 K时(运行时所设气压为标准大气压,温度为298.15 K),这16种构型均可自发形成。ΔG越小,自发形成越容易,因此构型1(4)最易自发形成,构型8(2)最难自发形成。
EZPE、G和ΔG与构型的热力学稳定性成负相关,这三者的能量值越小,构型的稳定性越好;而EBE与构型的热力学稳定性成正相关,其能量值越大,构型越稳定。在这16种构型中,构型1(4)的EZPE、G和ΔG均最低,EBE最大,稳定性最好。
3 团簇CrPS4催化析氢性能分析 3.1 团簇CrPS4吸氢反应分析团簇CrPS4吸附氢原子形成M—H构型是完成析氢反应的第一步。在这个过程中,电子从团簇CrPS4的最高占据分子轨道(HOMO)流入水分子的最低未占据分子轨道(LUMO),CrPS4结合水分子中的氢原子形成M—H模型。
3.1.1 团簇CrPS4吸附氢原子后的稳定构型团簇CrPS4吸附氢原子形成(CrPS4)—H(M—H) 结构,经Gaussian09量子化学软件分析后,发现部分构型吸附氢原子后无法稳定存在,不利于后续反应进行,因此本文将此部分构型排除,不对其进行分析。能够稳定存在的M—H构型有10种,如图 2所示。其中四重态占比较高,存在7种构型,而二重态仅存3种,说明结合氢原子后,M—H的稳定性与自旋多重度有一定关系。在这10种构型中,有7种构型的H原子结合在S原子上,仅有3种构型的H原子结合在Cr或P原子上,说明S原子为团簇CrPS4的主要活性位点。
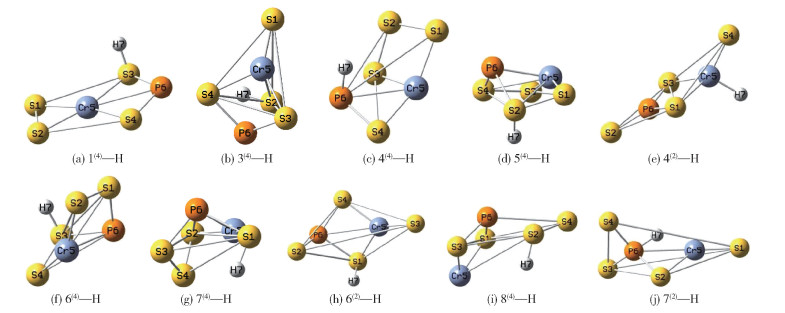
|
图 2 团簇CrPS4的(CrPS4)—H构型图 Fig.2 (CrPS4)—H configuration diagrams of the CrPS4 cluster |
3.1.1节对结合氢原子后CrPS4构型的稳定性进行了分析,这10种CrPS4构型结合氢原子的潜在能力不尽相同,本节利用团簇CrPS4的HOMO轨道与水分子LUMO轨道之间的能级差对10种不同构型CrPS4结合氢原子的难易程度进行分析:能级差越小,电子从该构型的HOMO轨道跃迁到水分子的LUMO轨道所需能量越小,吸附反应越容易发生;反之,吸附反应越不易发生。
表 2为团簇CrPS4各构型的HOMO轨道能级(EHOMO)、水分子的LUMO轨道能级(ELUMO)以及二者的能级差ΔE(ΔE=ELUMO-EHOMO)。可以看出,构型4(4)的HOMO轨道与水分子的LUMO轨道的能级差最小,为641.090 kJ/mol,因此构型4(4)最容易完成吸附氢原子的过程;而构型7(2)与水分子的能级差最大,为740.675 kJ/mol。各构型按照与水分子的能级差由小到大的顺序依次为:4(4) < 8(4) < 6(4) < 7(4) < 5(4) < 4(2) < 6(2) < 3(4) < 1(4) < 7(2)。其中,构型8(4)与构型6(4)的能级差相近,仅相差2.022 kJ/mol,吸附氢原子的能力差别不大。排在前5位构型的HOMO轨道与水分子的LUMO轨道的能级差均小于700 kJ/mol,而排在后5位构型的HOMO轨道与水分子的LUMO轨道的能级差均大于700 kJ/mol,并且3种二重态构型均排在后5位,分别为第6位、第7位和第10位。总体来看,二重态构型吸附氢原子的能力较弱。
| 下载CSV 表 2 团簇CrPS4的HOMO轨道与H2O的LUMO轨道之间的能级差 Table 2 Energy level difference between the HOMO of the CrPS4 cluster and the LUMO of H2O |
团簇CrPS4的HOMO轨道和水分子的LUMO轨道与吸附反应的发生密切相关,根据Fukui提出的前线轨道理论[24],HOMO轨道为能量最高电子占据轨道,LUMO轨道为能量最低电子未占轨道,位于HOMO轨道的电子能量高,距核远,所受约束力小,较活泼,易给出电子;而LUMO轨道在所有空轨道中能量最低,易接受电子。
图 3为团簇CrPS4各构型α电子及β电子的HOMO轨道图以及水分子的LUMO轨道图。通过观察水分子的LUMO轨道图可知,其外层全部被黑色区域包围,白色区域仅在氧原子周围占少部分,说明水分子LUMO轨道波函数的负相位更易接受电子。此外,只有当团簇CrPS4的HOMO轨道的波函数与水分子LUMO轨道的波函数相同时,才能实现轨道重叠成键,因此,团簇CrPS4的HOMO轨道波函数负相位所给出的电子更容易迁移到水分子的LUMO轨道,从而使团簇达到吸附氢原子的目的。
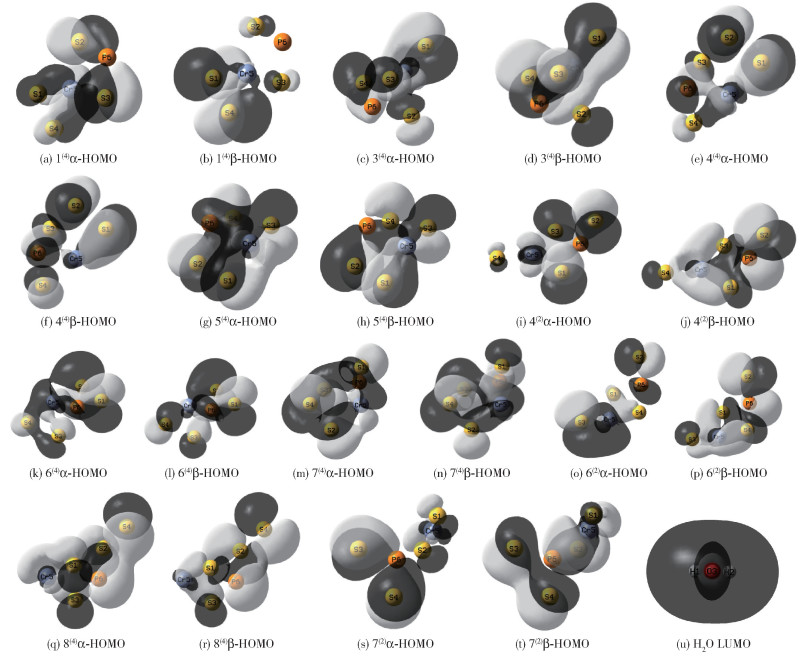
|
图中不规则区域为电子的离域空间,黑色部分代表轨道波函数的负相位,白色区域代表轨道波函数的正相位。 图 3 团簇CrPS4的HOMO轨道图与水分子的LUMO轨道图 Fig.3 HOMO orbital diagrams of the CrPS4 cluster and LUMO orbital diagram of the water molecule |
通过观察各构型α电子及β电子的HOMO轨道可知,这10种构型的离域空间各不相同。与其他构型相比,构型5(4)和7(4)轨道波函数的负相位离域空间较大,说明这两种构型更容易与水分子的LUMO轨道发生重叠从而吸附氢原子。进一步观察发现,相对于四重态构型,3种二重态构型的HOMO轨道黑色区域占位均较小,尤其是构型4(2)与6(2)的β-HOMO轨道,说明二重态构型较难与水分子发生重叠,不易吸附氢原子。构型1(4)与4(4)的α-HOMO轨道与β-HOMO轨道正负相位的对称性较好,且离域空间都较大,说明这两种构型作为催化剂使用时,无论是反应物的正相位占优势还是负相位占优势,其均能很好地发挥作用;同时结合3.1.2节可知,构型4(4)的HOMO轨道与水分子的LUMO轨道的能级差在所有构型中最小,说明该构型在吸附氢原子过程中具有明显优势。
3.2 (CrPS4)—H解吸过程分析 3.2.1 (CrPS4)—H与水分子间的轨道能级差团簇CrPS4结合氢原子形成M—H模型后,M—H继续与水分子反应吸附新的氢原子,新吸附的氢原子与原来的氢原子以氢分子的形式脱落下来,从而完成一次析氢过程,恢复原型的CrPS4构型可以继续吸附氢原子,从而实现催化剂的重复利用。M—H模型的HOMO轨道与水分子的LUMO轨道的能级差是判断反应难易程度的重要依据。
表 3为M—H的HOMO轨道能级、水分子的LUMO轨道能级以及二者的能级差。可以看出,构型4(2)—H、7(2)—H的能级差与未结合氢原子时相比均有不同程度的增大,说明这2种构型结合氢原子形成M—H模型后催化活性减弱;其他8种构型与结合氢原子前相比能级差均有一定程度的减小,说明这8种构型结合氢原子后催化活性增强。催化活性减弱的两种构型均为二重态,而催化活性增强的8种构型中,除构型6(2)外,其余均为四重态,说明结合氢原子形成M—H模型后,其催化活性与自旋多重度有关。比较这8种构型结合氢原子前后ΔE的差值,发现构型1(4)的ΔE差值最大(132.772 kJ/mol),构型6(2)的ΔE差值最小(7.115 kJ/mol),说明构型1(4)结合氢原子前后催化活性变化最大,构型6(2)结合氢原子前后催化活性变化最小。在所有M—H构型中,能级差最小的构型为7(4)—H(594.146 kJ/mol),说明在吸附氢原子的过程中构型7(4)—H的活性最强;而构型4(2)—H的HOMO轨道与水分子LUMO轨道的能级差最大(763.280 kJ/mol),催化活性最小。各构型按照能级差值由小到大的顺序依次为:7(4)—H < 1(4)—H < 8(4)—H < 5(4)—H < 6(4)—H < 4(4)—H < 3(4)—H < 6(2)—H < 7(2)—H < 4(2)—H,能级差越小,催化活性越大。
| 下载CSV 表 3 (CrPS4)—H构型的HOMO轨道与水分子的LUMO轨道之间的能级差 Table 3 Energy level difference between the HOMO of the (CrPS4)—H configuration and the LUMO of the water molecule |
键级又称键序,是反映两原子间成键强弱的重要参数,键级越大,两原子成键强度越大,越不易发生断裂;键级越小,两原子间成键强度越弱,越容易出现断键。团簇CrPS4吸附氢原子形成M—H模型后,M—H吸附的新氢原子与团簇CrPS4最先吸附的氢原子组成氢分子,而原来吸附的氢原子迅速与团簇CrPS4发生分离,形成氢气。团簇CrPS4与氢原子成键的强弱直接影响氢分子的脱离情况,键级越小,氢分子越易脱落;反之,越难脱落。
表 4为M—H构型中氢原子与所连接原子间的键级。可以看出,各构型按照键级由小到大的顺序依次为:7(2)—H < 8(4)—H < 4(2)—H < 5(4)—H < 6(4)—H < 3(4)—H < 1(4)—H < 6(2)—H < 7(4)—H < 4(4)—H。这10种构型的氢原子与相邻原子的键级在0.209~0.326之间,构型7(2)—H的键级最小,反应过程中氢分子最容易从该构型的CrPS4上脱落下来;而构型4(4)—H的键级最大,氢原子与团簇CrPS4的连接相对牢固,较难脱落。
| 下载CSV 表 4 (CrPS4)—H中氢原子与所连接原子的键级 Table 4 Bond levels between the hydrogen atom and the connected atom in (CrPS4)—H |
团簇CrPS4完成催化析氢需要经过氢原子的两次吸附以及氢分子的一次脱落,综合10种构型完成这3个过程的排序情况,对团簇CrPS4不同构型的析氢能力进行综合分析。
(1) 团簇CrPS4的HOMO轨道与水分子的LUMO轨道的能级差由小到大排序为:4(4) < 8(4) < 6(4) < 7(4) < 5(4) < 4(2) < 6(2) < 3(4) < 1(4) < 7(2);
(2) M—H构型的HOMO轨道与水分子的LUMO轨道的能级差由小到大排序为:7(4) < 1(4) < 8(4) < 5(4) < 6(4) < 4(4) < 3(4) < 6(2) < 7(2) < 4(2);
(3) M—H内氢原子与相邻原子的键级由小到大排序为:7(2) < 8(4) < 4(2) < 5(4) < 6(4) < 3(4) < 1(4) < 6(2) < 7(4) < 4(4)。
为方便观察,(2)和(3)中各构型的“—H”已省略,三者均是数值越小对团簇CrPS4催化析氢越有利。由(1)~(3)可以看出,排名第一的分别为构型4(4)、7(4)和7(2),但综合来看,这3种构型在吸附与解吸的过程中均有优势和劣势,其析氢能力并不很强,尤其是构型7(2),排名较为极端,在3种排序中位次相差很大,综合析氢能力不强。同理,不难发现构型4(4)和7(4)与构型7(2)有类似缺点。而构型8(4)的综合析氢能力在10种构型中最强,其次是构型5(4)和6(4),其析氢能力较强。除上述6种构型外,其余4种构型的析氢能力均较弱。
4 结论本文对团簇CrPS4的催化析氢能力进行了分析,主要得到以下结论。
(1) 团簇CrPS4可以作为催化物质从水分子中夺取氢原子,为与两个氢原子的结合提供条件,从而促进氢分子的形成。
(2) 不同构型的团簇CrPS4在催化析氢过程的不同阶段具有不同的优势,在与水反应形成M—H构型的过程中,与其他构型相比,构型4(4)的HOMO轨道与水分子的LUMO轨道的能级差最小并且负相位具有较大的离域空间,因此构型4(4)吸附氢原子的能力最强。
(3) 在解吸过程中,构型7(2)—H的键级最小,反应过程中氢分子最容易从该构型上脱落下来,因此在解吸过程中构型7(2)更占优势。
(4) 将各构型吸附与解吸氢原子的能力进行综合分析,发现构型8(4)的综合析氢能力在10种构型中最强,最适合用于催化水分子形成氢气,其次是构型5(4)和6(4)。
(5) 大多数构型所结合的氢原子均连接在S原子上,因此S原子是团簇CrPS4的主要活性位点。
(6) 结合氢原子后,能够稳定存在的四重态构型数量(7种)远大于二重态构型数量(3种),因此相对于二重态构型,四重态构型的稳定性较高,催化活性较强。
| [1] |
EDWARDS P P, KUZNETSOV V L, DAVID W I F. Hydrogen energy[J]. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, 2007, 365(1853): 1043-1056. DOI:10.1098/rsta.2006.1965 |
| [2] |
MOMIRLAN M, VEZIROGLU T N. Current status of hydrogen energy[J]. Renewable and Sustainable Energy Reviews, 2002, 6(1-2): 141-179. DOI:10.1016/S1364-0321(02)00004-7 |
| [3] |
MIDILLI A, AY M, DINCER I, et al. On hydrogen and hydrogen energy strategies I: current status and needs[J]. Renewable and Sustainable Energy Reviews, 2005, 9(3): 255-271. DOI:10.1016/j.rser.2004.05.003 |
| [4] |
TURNER J A. Sustainable hydrogen production[J]. Science, 2004, 305(5686): 972-974. DOI:10.1126/science.1103197 |
| [5] |
BAIBARS I O, ABD EL-MOGHNY M G, EL-DEAB M S. Boosted electrolytic hydrogen production at tailor-tuned nano-dendritic Ni-doped Co foam-like catalyst[J]. Electrochimica Acta, 2022, 410: 139992. DOI:10.1016/j.electacta.2022.139992 |
| [6] |
WEI Y P, LI W, LI D Z, et al. Amorphous-crystalline cobalt-molybdenum bimetallic phosphide heterostructured nanosheets as Janus electrocatalyst for efficient water splitting[J]. International Journal of Hydrogen Energy, 2022, 47(12): 7783-7792. DOI:10.1016/j.ijhydene.2021.12.106 |
| [7] |
URSÚA A, GANDÍA L M, SANCHIS P. Hydrogen production from water electrolysis: current status and future trends[J]. Proceedings of the IEEE, 2012, 100(2): 410-426. DOI:10.1109/JPROC.2011.2156750 |
| [8] |
DIEHL R, CARPENTIER C D. The crystal structure of chromium thiophosphate, CrPS4[J]. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry, 1977, 33(5): 1399-1404. DOI:10.1107/S0567740877006165 |
| [9] |
LEE J, KO T Y, KIM J H, et al. Structural and optical properties of single- and few-layer magnetic semiconductor CrPS4[J]. ACS Nano, 2017, 11(11): 10935-10944. DOI:10.1021/acsnano.7b04679 |
| [10] |
NEAL S N, O'NEAL K R, HAGLUND A V, et al. Exploring few and single layer CrPS4 with near-field infrared spectroscopy[J]. 2D Materials, 2021, 8(3): 035020. DOI:10.1088/2053-1583/abf251 |
| [11] |
ZHUANG H L, ZHOU J. Density functional theory study of bulk and single-layer magnetic semiconductor CrPS4[J]. Physical Review B, 2016, 94(19): 195307. DOI:10.1103/PhysRevB.94.195307 |
| [12] |
秦渝, 方志刚, 张伟, 等. 团簇Co3NiB催化析氢活性研究[J]. 江西师范大学学报(自然科学版), 2020, 44(1): 56-62. QIN Y, FANG Z G, ZHANG W, et al. The study on the catalytic properties of cluster Co3NiB in the hydrogen evolution reaction[J]. Journal of Jiangxi Normal University (Natural Science), 2020, 44(1): 56-62. (in Chinese) |
| [13] |
CAR R, PARRINELLO M. Unified approach for molecular dynamics and density-functional theory[J]. Physical Review Letters, 1985, 55(22): 2471-2474. DOI:10.1103/PhysRevLett.55.2471 |
| [14] |
秦渝, 方志刚, 赵璐璐, 等. 团簇Co3NiB2异构化反应的动力学与热力学研究[J]. 江西师范大学学报(自然科学版), 2021, 45(1): 67-74. QIN Y, FANG Z G, ZHAO L L, et al. The study on the dynamics and thermodynamics of isomeric transformation of cluster Co3NiB2[J]. Journal of Jiangxi Normal University (Natural Science), 2021, 45(1): 67-74. (in Chinese) |
| [15] |
郑新喜, 方志刚, 秦渝, 等. 团簇Fe3Ni3电子性质[J]. 贵州大学学报(自然科学版), 2021, 38(5): 7-12, 19. ZHENG X X, FANG Z G, QIN Y, et al. Electronic properties of cluster Fe3Ni3[J]. Journal of Guizhou University (Natural Sciences), 2021, 38(5): 7-12, 19. (in Chinese) |
| [16] |
方志刚, 王智瑶, 郑新喜, 等. 团簇Co3NiB2极化率、偶极矩及态密度研究[J]. 贵州大学学报(自然科学版), 2022, 39(1): 17-24. FANG Z G, WANG Z Y, ZHENG X X, et al. Study on the polarizability, dipole moment and density of states of cluster Co3NiB2[J]. Journal of Guizhou Umiversity (Natural Sciences), 2022, 39(1): 17-24. (in Chinese) |
| [17] |
方志刚, 许友, 王智瑶, 等. 基于量子化学的团簇Co4P非晶态合金析氢反应研究[J]. 江西师范大学学报(自然科学版), 2022, 46(3): 221-226. FANG Z G, XU Y, WANG Z Y, et al. The study on hydrogen evolution reaction of cluster Co4P amorphous alloy based on quantum chemistry[J]. Journal of Jiangxi Normal University (Natural Science), 2022, 46(3): 221-226. (in Chinese) |
| [18] |
温新竹, 刘明真, 彭玉颜. 不同氧化锆相的稳定性及电子结构的第一性原理研究[J]. 北京化工大学学报(自然科学版), 2021, 48(2): 16-22. WEN X Z, LIU M Z, PENG Y Y. First-principles study of the stability and electronic structure of different zirconia phases[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2021, 48(2): 16-22. (in Chinese) DOI:10.13543/j.bhxbzr.2021.02.003 |
| [19] |
DU J B, FENG Z F, ZHANG Q, et al. Molecular structure and electronic spectrum of MoS2 under external electric field[J]. Acta Physica Sinica, 2019, 68(17): 173101. DOI:10.7498/aps.68.20190781 |
| [20] |
KARGAR H, BEHJATMANESH-ARDAKANI R, TORABI V, et al. Synthesis, characterization, crystal structures, DFT, TD-DFT, molecular docking and DNA binding studies of novel copper (Ⅱ) and zinc (Ⅱ) complexes bearing halogenated bidentate N, O-donor Schiff base ligands[J]. Polyhedron, 2021, 195: 114988. DOI:10.1016/j.poly.2020.114988 |
| [21] |
LUO S C, NIE D, LI Z, et al. Effects of carboxylic acid auxiliary ligands on the magnetic properties of azido-Cu(Ⅱ) complexes: a density functional theory study[J]. Polyhedron, 2020, 182: 114506. DOI:10.1016/j.poly.2020.114506 |
| [22] |
WEI Z D, YAN A Z, FENG Y C, et al. Study of hydrogen evolution reaction on Ni-P amorphous alloy in the light of experimental and quantum chemistry[J]. Electrochemistry Communications, 2007, 9(11): 2709-2715. DOI:10.1016/j.elecom.2007.09.006 |
| [23] |
王倩, 方志刚, 吕孟娜, 等. 团簇Mo2S4的催化析氢活性计算分析[J]. 北京化工大学学报(自然科学版), 2021, 48(6): 9-16. WANG Q, FANG Z G, LV M N, et al. Calculation and analysis of the catalytic hydrogen evolution activity of the Mo2S4 cluster[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2021, 48(6): 9-16. (in Chinese) |
| [24] |
FUKUI K, YONEZAWA T, SHINGU H. A molecular orbital theory of reactivity in aromatic hydrocarbons[J]. The Journal of Chemical Physics, 1952, 20(4): 722-725. DOI:10.1063/1.1700523 |








