2. 宁夏中药材开发与应用工程技术研究中心, 银川 750002
2. Ningxia Research Center of Traditional Chinese Medicine Development and Utilization Engineering Technology, Yinchuan 750002, China
柴胡作为传统的中药材,在我国已有两千多年的药用历史[1]。《中华人民共和国药典》2020版收载的柴胡药材为伞形科植物柴胡(Bupleurum chinense DC.)或狭叶柴胡(Bupleurum scorzonerifolium Willd.)的干燥根[2],主要含有柴胡皂苷、挥发油、黄酮类、有机酸类及多糖类等化学成分[3],具有镇静止痛、抗菌消炎、保肝利胆、抗病毒等功效[4]。
目前,由于对柴胡的长期盲目采挖,其野生资源越来越少,柴胡现已被宁夏列为植物资源修复的重点品种。人工种植柴胡是修复生态、提高农民收入的一项重要举措,但是占柴胡整个植物干重70%~85%的地上部分被当成废料而大量丢弃,造成了严重的资源浪费[5]。有研究表明,柴胡地上部分具有解热镇痛、镇静抗炎、保肝利胆等药理活性,其含有丰富的黄酮类化合物并且含量高于地下部分[3, 6]。黄酮类成分是植物生存竞争、适应环境及提高自身保护能力的重要有效成分,同时也是人类医药健康事业发展的潜在资源[7-8],其具有抗炎、镇痛、抗病毒等功效[9]。目前,对柴胡地上部分黄酮类化合物的研究主要集中在含量测定、单体化合物分离、总黄酮的提取工艺等方面[10-12],而关于柴胡地上部分总黄酮的分离纯化工艺及抑菌活性的研究却鲜有报道。本文以宁夏栽培的柴胡地上部分为研究对象,采用大孔吸附树脂对其中的总黄酮进行分离纯化,并对纯化后的总黄酮进行体外抑菌活性研究,以期为进一步扩大柴胡的药用部位提供科学的理论依据。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料柴胡地上部分,采自固原市隆德县柴胡种植基地,经鉴定为北柴胡地上部分,自然晾干,粉碎过二号筛(筛孔孔径850 μm);芦丁对照品,纯度98.62%,中国食品药品检定研究院;大孔吸附树脂(D101、AB-8、ADS-7、XDA-1、DM130、X-5、HPD100、DM301、LX-36、NKA-II、HPD600、HPD400型),郑州和成新材料科技有限公司;96孔培养板,康宁3599型,Corning公司;无水乙醇,分析纯,西安化学试剂厂;亚硝酸钠、硝酸铝,分析纯,上海广诺化学仪器有限公司;氢氧化钠,分析纯,烟台市双双化工有限公司;α-萘酚,分析纯,广州市江顺化工科技有限公司;浓硫酸,分析纯,烟台远东精细化工有限公司;氨苄青霉素钠,纯度96%,武汉纯度生物科技有限公司;特比萘酚,纯度97.82%,成都迈恩凯化工有限公司;营养肉汤培养基,含有10 g/L蛋白胨、3 g/L牛肉膏、5 g/L氯化钠,pH=7.2±0.2,121 ℃高压灭菌15 min。
表皮葡萄球菌(Staphylococcus epidermidis,ATCC12228)、福氏志贺菌(Shigella flexneri,CMCC51572)、大肠埃希菌(Escherichia coli, ATCC25922)、鼠伤寒沙门氏菌(Salmonella typhimurium,ATCC14028),宁夏医科大学临床医学院检验中心馈赠;糠秕马拉色菌(Malassezia furfur,CBS1878)、球形马拉色菌(Malassezia globosa, CBS9597)、钝形马拉色菌(Malassezia obtusa, CBS7876)、合轴马拉色菌(Malassezia sympodialis, CBS9593),购自中国医学科学院皮肤病研究所。
1.1.2 实验仪器TYS-400A型高速多功能粉碎机,浙江省永康市红太阳机电有限公司;EL204型电子天平,梅特勒-托利多仪器(上海)有限公司;RE-52A型真空旋转蒸发仪,上海亚荣生化仪器厂;SIB-III型循环式多用真空泵,郑州长城科工贸有限公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;SHY-2A型水浴恒温振荡器,常州国宇制造有限公司;YXQ-LS8-50S型立式压力蒸汽灭菌器,上海博讯实业有限公司;YJ-875型超净工作台,苏州安泰空气技术有限公司;DHG-9123A型电热恒温培养箱,上海一恒科技有限公司。
1.2 总黄酮含量测定方法建立 1.2.1 对照品溶液配制精密称取芦丁对照品10.40 mg,用30%(体积分数,下同)乙醇溶解,转移至50 mL容量瓶中,定容,得到质量浓度为0.208 0 mg/mL的芦丁标准液,置于4 ℃冰箱中备用。
1.2.2 标准曲线绘制[13-14]分别准确移取0.4、0.8、1.4、2.0、2.6、3.2 mL芦丁对照品溶液于10 mL容量瓶中,加入0.05 g/mL NaNO2溶液0.4 mL,摇匀,静置6 min,然后加入0.1 g/mL Al(NO3)3溶液0.4 mL,摇匀,静置6 min。然后加入0.04 g/mL NaOH溶液4 mL,摇匀,最后用30%乙醇定容,静置10 min。以30%乙醇作为空白参比,使用紫外可见分光光度计在510 nm波长处测定吸光度A,以A为纵坐标,芦丁的质量浓度ρ(mg/mL)为横坐标,制作标准曲线,得到标准曲线方程:A=9.823ρ-0.000 8,决定系数R2=0.999 9,结果表明在0.008 32~0.066 56 mg/mL的范围内芦丁的质量浓度与吸光度的线性关系良好。
1.2.3 总黄酮含量测定精密吸取待测溶液适量,置于10 mL容量瓶中,按照标准曲线的绘制方法操作,依次加入显色剂(0.05 g/mL NaNO2溶液0.4 mL、0.1 g/mL Al(NO3)3溶液0.4 mL、0.04 g/mL NaOH溶液4 mL),用30%乙醇定容至刻度,摇匀。以30%乙醇作为空白参比,使用紫外可见分光光度计在510 nm波长处测定吸光度A,利用总黄酮的标准曲线方程计算得到总黄酮含量。
1.3 柴胡地上部分总黄酮的提取取粉碎的柴胡地上部分粗粉200 g,按照1 g药材加入10 mL溶液的比例(即料液比1∶10)加入55%乙醇浸泡60 min。然后加热回流提取72 min,过滤。使用相同方法将滤渣再次加热回流提取2次,合并3次滤液,使用旋转蒸发仪于60 ℃下减压浓缩,得到浸膏,称重,然后用蒸馏水定容至500 mL,每毫升药液相当于生药0.4 g(即0.4 g/mL),于4 ℃冰箱中保存备用。
1.4 大孔吸附树脂的筛选 1.4.1 预处理[15-16]称取大孔吸附树脂适量,放入具塞的250 mL三角瓶中,用95%乙醇在室温下浸泡24 h,过滤。将树脂湿法上柱,用95%乙醇以每小时2倍柱体积(2 BV/h)的体积流量冲洗,洗至洗脱液与蒸馏水以1∶5(体积比)混合时无浑浊。然后用蒸馏水以2 BV/h的体积流量冲洗至无醇味,即可使用。
1.4.2 静态吸附试验[17]取大孔吸附树脂3 g,按1.4.1节的方法进行预处理。然后置于100 mL具塞锥形瓶中,加入0.08 g/mL供试样品提取液40 mL,置于25 ℃的恒温水浴振荡器中,以110 r/min的速度振摇22 h。过滤,吸取续滤液适量,按照1.2.3节的方法测定各平衡液中总黄酮的含量,分别采用式(1)和(2)计算树脂对总黄酮的静态吸附量Ca和吸附率Ra。
| $ C_{\mathrm{a}}=\left(\rho_0-\rho_1\right) V / m $ | (1) |
| $ R_{\mathrm{a}}=\left[\left(\rho_0-\rho_1\right) / \rho_0\right] \times 100 \% $ | (2) |
式中:ρ0为初始时总黄酮的质量浓度,ρ1为吸附平衡后总黄酮的质量浓度,V为吸附液的体积,m为干树脂的质量。
1.4.3 静态解吸附试验[17]选取“静态吸附试验”中吸附量和吸附率较高的吸附饱和的大孔吸附树脂,用30 mL蒸馏水清洗后,分别加入70%乙醇50 mL,在25 ℃下用恒温水浴振荡器振荡22 h进行静态解吸。过滤,取续滤液适量,按照1.2.3节的方法测定总黄酮含量,分别采用式(3)和(4)计算树脂的静态解吸率Rd和解吸量Cd。
| $ R_{\mathrm{d}}=\frac{\rho_2 V_1}{\left(\rho_0-\rho_1\right) V} \times 100 \% $ | (3) |
| $ C_{\mathrm{d}}=C_{\mathrm{a}} R_{\mathrm{d}} $ | (4) |
式中:ρ2为解吸后总黄酮的质量浓度,V1为解吸液的体积。
1.5 柴胡地上部分总黄酮的动态分离纯化取NKA-II大孔吸附树脂3 g,按照1.4.1节的方法进行预处理,湿法装入洁净的玻璃色谱柱(15 mm×180 mm)中。将1.3节制备的提取液稀释后,以一定的流速上样,使树脂达到吸附饱和。吸附饱和的判断方法为:取两支试管分别加入1 mL上样流出液和1 mL上样原液,然后依次加入0.05 g/mL NaNO2溶液、0.1 g/mL Al(NO3)3溶液和0.04 g/mL NaOH溶液适量,当上样流出液的颜色与上样原液的颜色相当时,说明树脂柱已达到吸附饱和。然后用蒸馏水以2 BV/h的流速洗涤至α-萘酚浓硫酸反应无紫色环,即说明水溶性杂质已清洗完全,共用水3 BV。然后用70%乙醇溶液以一定的流速进行解吸附,至最后的流出液中用显色反应检测无总黄酮为止。分别收集上样流出液、水洗液和解吸液,合并上样流出液和水洗液,分别精密吸取少量合并液和解吸液,按照1.2.3节的方法测定总黄酮含量。将解吸液在60 ℃下减压浓缩成干浸膏,称重。分别按照式(5)~(7)计算动态吸附量Cb、解吸率Rb和干浸膏中总黄酮含量c。
| $ C_{\mathrm{b}}=\left(\rho_3 V_3-\rho_4 V_4-\rho_5 V_5\right) / m $ | (5) |
| $ R_{\mathrm{b}}=\left(\rho_6 V_6 / C_{\mathrm{b}}\right) \times 100 \% $ | (6) |
| $ c=\left(\rho_6 V_6 / m_0\right) \times 100 \% $ | (7) |
式中:ρ3为初始上样液中总黄酮的质量浓度,ρ4为上样过程的流出液中总黄酮的质量浓度,ρ5为上样后水流出液中总黄酮的质量浓度,ρ6为乙醇洗脱液中总黄酮的质量浓度,V3为上样总体积,V4为上样过程中流出液的体积,V5为上样后水洗液的体积,V6为乙醇洗脱液的体积,m为干树脂的质量,m0为乙醇洗脱液的干浸膏的质量。
1.6 分离纯化工艺放大验证称取NKA-II大孔吸附树脂30 g,按照1.4.1节的方法进行预处理,湿法装柱。色谱柱内树脂的径高比为2∶7,上样质量浓度为0.08 g/mL,上样流速为3.0 BV/h,上样量为16 BV。然后用水以2 BV/h的流速洗涤至α-萘酚浓硫酸反应无紫色环,共用水3 BV。然后用10 BV的70%乙醇以2.5 BV/h的流速进行解吸附。收集上样流出液、水洗液和洗脱液,分别精密吸取各收集液适量,测定总黄酮含量,实验重复3次,考察放大后的工艺对柴胡地上部分总黄酮的分离纯化效果。
1.7 总黄酮的抑菌活性测定[18]向96孔板的1~9号孔中加入空白营养肉汤培养基90 μL,再向每排的第一孔中加入98.39 mg/mL纯化后的总黄酮90 μL。然后将样品液依次稀释2倍,向每孔中加入菌落浓度为1.0×106 CFU/L的不同受试菌悬液20 μL,此时1~9号孔样品液中总黄酮的最终质量浓度分别为:49.20、24.60、12.30、6.15、3.07、1.54、0.77、0.38、0.19 mg/mL。同时向10号孔中加入180 μL培养基和20 μL菌悬液作为菌液对照,向11号孔中加入200 μL培养基作为空白对照1,向12号孔中加入100 μL培养基和药液作为空白对照2。然后将96孔板放入37 ℃恒温培养箱中,培养16 h后取出观察。如果小孔内澄清,表明该供试样品完全抑制细菌或真菌生长,澄清小孔中所对应的最低药物浓度即为供试样品对该菌的最低抑菌浓度(MIC)。同时设置氨苄青霉素钠组作为细菌的阳性对照组,设置特比萘酚组作为真菌的阳性对照组,实验方法同样品组,但其初始质量浓度为0.050 mg/mL。每个样品重复实验3次,结果取平均值。
2 结果与讨论 2.1 不同类型大孔吸附树脂的静态吸附与解吸附试验结果表 1为不同类型大孔吸附树脂对柴胡地上部分总黄酮的静态吸附与解吸附结果。从吸附能力来看,NKA-II、XDA-1、HPD100、DM301、HPD400、AB-8、ADS-7、LX-36这8种大孔吸附树脂对柴胡地上部分总黄酮的吸附能力较强,吸附率均在80%以上,其中NKA-II和XDA-1的吸附能力最强,吸附量分别为40.07 mg/g和39.44 mg/g,吸附率分别为93.38%和91.92%。本文对这8种树脂进行了解吸附试验,可以看出,NKA-II、HPD100、DM301、HPD400、AB-8、ADS-7、LX-36这7种大孔吸附树脂对柴胡地上部分总黄酮的解吸附能力较强,解吸率均在80%以上,其中NKA-II和AB-8大孔吸附树脂对总黄酮的解吸附能力更为突出,其解吸量分别为35.82 mg/g和30.55 mg/g,解吸率分别为89.38%和85.75%。综合分析表 1的数据可知,不同大孔吸附树脂对柴胡地上部分总黄酮的静态吸附和解吸附能力有所不同,这可能与树脂的比表面积、孔径、极性等因素有关。其中,比表面积影响树脂的吸附量,孔径影响分子的扩散,极性影响树脂与被吸附物之间的吸附力。
| 下载CSV 表 1 不同类型大孔吸附树脂对柴胡地上部分总黄酮的静态吸附与解吸附结果 Table 1 Static adsorption and desorption results of total flavonoids from the aboveground parts of Bupleurum chinense for different types of macroporous adsorption resins |
由表 1可知,NKA-II大孔吸附树脂对柴胡地上部分总黄酮的静态吸附和解吸附能力均优于其他大孔吸附树脂。由于大孔吸附树脂的动态和静态吸附行为有所不同,在一般工业生产中动态吸附应用较多且效率较高,因此本实验选取静态吸附率和解吸率都较高的NKA-II大孔吸附树脂进行动态分离纯化工艺研究。
2.2 吸附条件对NKA-Ⅱ树脂分离纯化总黄酮的影响 2.2.1 上样质量浓度在上样流速为4 BV/h、洗脱剂为70%乙醇、洗脱流速为4 BV/h的条件下,考察不同上样质量浓度对吸附量和解吸率的影响,结果如图 1所示。由结果可知,在质量浓度小于0.08 g/mL的稀溶液中,随着上样质量浓度增大,NKA-II大孔吸附树脂对柴胡地上部分总黄酮的吸附量和解吸率均增大。本实验只选择了0.1 g/mL以下的稀溶液进行实验,主要原因为:药材提取液本来浓度较低,这样便于浓缩和工业化应用;浓度过高时,杂质含量也高,从而形成竞争吸附,反而不利于树脂对总黄酮的吸附[19]。综合分析图 1的数据,当上样质量浓度为0.08 g/mL时,NKA-II大孔吸附树脂的吸附量和解吸率相对都较高,故本文选择上样质量浓度为0.08 g/mL,即每mL药液相当于生药0.08 g。
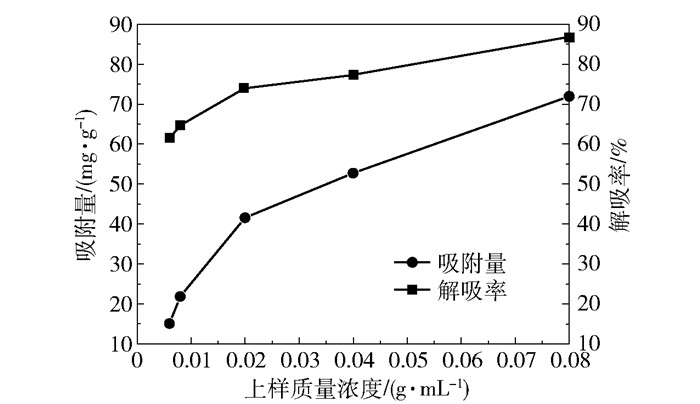
|
图 1 上样质量浓度对吸附量和解吸率的影响 Fig.1 Effect of loading mass concentration on adsorption capacity and desorption rate |
在上样质量浓度为0.08 g/mL、洗脱剂为70%乙醇、洗脱流速为4 BV/h的条件下,考察不同上样流速对吸附量和解吸率的影响,结果如图 2所示。由结果可知,NKA-II大孔吸附树脂对柴胡地上部分总黄酮的吸附量与上样流速有很大的关系,当上样流速大于3.0 BV/h时,随着流速增大,吸附量显著减小,这可能是由于树脂对总黄酮的吸附需要一定的时间,如果上样流速过快就会缩短二者接触的时间,所以吸附量会降低;当上样流速大于3.0 BV/h时,随着流速增大,解吸率的变化幅度相对较小。综合考虑,当上样流速为3.0 BV/h时,吸附量和解吸率均相对较高,故本文选择上样流速为3.0 BV/h。
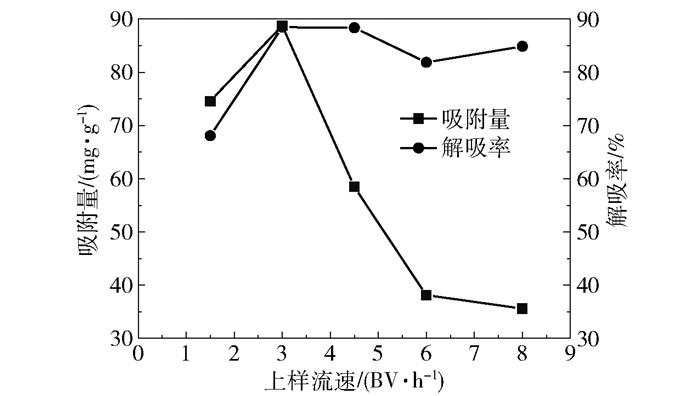
|
图 2 上样流速对吸附量和解吸率的影响 Fig.2 Effect of loading flow rate on adsorption capacity and desorption rate |
在上样质量浓度为0.08 g/mL、上样流速为3.0 BV/h、洗脱剂为70%乙醇、洗脱流速为4 BV/h的条件下,考察色谱柱内树脂的直径和高度之比(树脂径高比)对吸附量和解吸率的影响,结果如表 2所示。由表 2可知,NKA-II大孔吸附树脂对柴胡地上部分总黄酮的吸附量与树脂径高比有一定的关系,当树脂径高比为2∶7时,吸附量和解吸率相对较高,因此,本文选择树脂径高比为2∶7进行装柱。
| 下载CSV 表 2 树脂径高比对吸附量和解吸率的影响 Table 2 Effect of diameter-height ratio of the resin on adsorption capacity and desorption rate |
在上样质量浓度为0.08 g/mL、上样流速为3.0 BV/h、树脂径高比为2∶7的条件下,以1 BV(9 mL)为1份收集上样流出液,直到树脂吸附饱和,共收集20份,测定每份上样流出液中总黄酮的含量,绘制吸附流出曲线,如图 3所示。由结果可知,当上样量为2 BV时色谱柱开始泄漏,当上样量为16 BV时树脂基本达到吸附饱和,故本文选择16 BV作为最佳上样量。
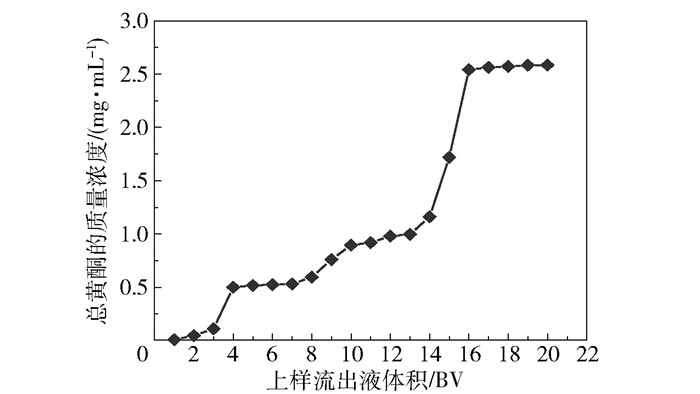
|
图 3 吸附流出曲线 Fig.3 Adsorption outflow curve |
在上样质量浓度为0.08 g/mL、上样流速为3.0 BV/h、树脂径高比为2∶7、洗脱流速为4 BV/h的条件下,考察不同浓度的洗脱剂(乙醇)对解吸率及洗脱所得浸膏中总黄酮含量的影响,结果如表 3所示。可以看出,当乙醇浓度为70%和80%时解吸率较高,分别为95.87%和95.89%;乙醇浓度为70%时干浸膏中总黄酮含量为70.1%,稍高于80%乙醇洗脱时干浸膏中总黄酮含量(68.96%),因此本文选择70%乙醇作为洗脱剂。
| 下载CSV 表 3 不同浓度乙醇对解吸率及总黄酮含量的影响 Table 3 Effects of different concentrations of ethanol on desorption rate and total flavonoids content |
在上样质量浓度为0.08 g/mL、上样流速为3.0 BV/h、树脂径高比为2∶7、上样量为16 BV、洗脱剂为70%乙醇的条件下,考察不同洗脱流速对解吸率及洗脱所得浸膏中总黄酮含量的影响,结果如图 4所示。由结果可知,当洗脱剂流速大于2.5 BV/h时,洗脱流速越快,解吸率越小,这可能是由于在洗脱过程中总黄酮需要有足够的时间在大孔吸附树脂和洗脱剂之间达到分配平衡,如果洗脱流速较快,总黄酮很难充分地从大孔树脂分配至洗脱剂中,从而导致总体解吸率较低。总体上看,当洗脱流速为2.5 BV/h时,解吸率和洗脱液干浸膏中总黄酮含量较高,分别为95.95%和73.66%,故本文选用洗脱流速为2.5 BV/h进行洗脱。
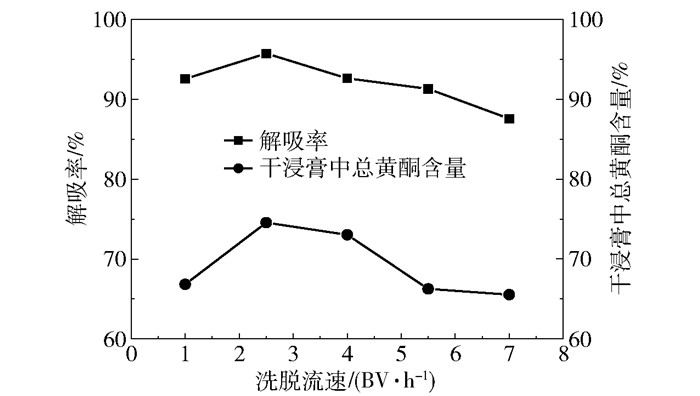
|
图 4 洗脱流速对解吸率及干浸膏中总黄酮含量的影响 Fig.4 Effects of elution flow rate on desorption rate and total flavonoid content in the dry extract |
在上样质量浓度为0.08 g/mL、上样流速为3.0 BV/h、树脂径高比为2∶7、上样量为16 BV、洗脱剂为70%乙醇、洗脱流速为2.5 BV/h的条件下,按树脂床体积收集洗脱流出液,共12份,测定每份流出液中总黄酮含量,绘制洗脱流出曲线,如图 5所示。由结果可知,当洗脱流出液体积为2 BV时,洗脱液中总黄酮含量最高;当洗脱流出液体积大于4 BV时,洗脱曲线趋于平缓,说明在该洗脱条件下总黄酮的洗脱较集中;当洗脱流出液体积为10 BV时,总黄酮含量几乎为0,说明此时大部分总黄酮已经被洗脱下来。因此,本文选择洗脱剂用量为10 BV。
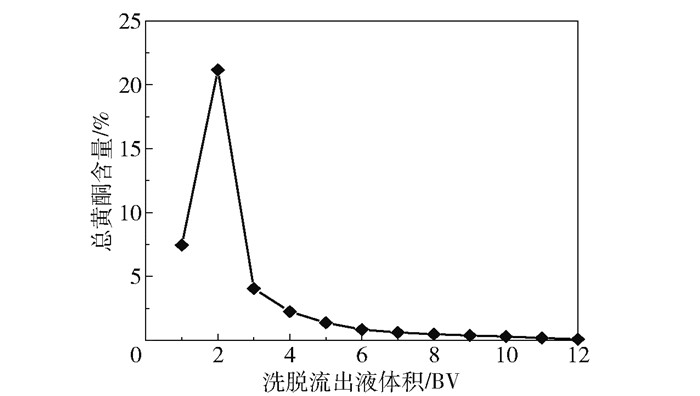
|
图 5 洗脱流出曲线 Fig.5 Elution flow curve |
在以上确定的最佳分离纯化工艺的条件下,取NKA-II大孔吸附树脂30g进行工艺放大验证,结果如表 4所示。由结果可知,当工艺放大10倍时,吸附量、解吸率及干浸膏中总黄酮含量的平均值分别为80.46 mg/g、95.72%和65.71%,与以上小试试验的结果基本一致。纯化前柴胡地上部分总黄酮含量为3.62%,经NKA-II大孔吸附树脂纯化后总黄酮含量为65.71%,总黄酮含量提高了17.15倍。因此,NKA-II大孔吸附树脂对柴胡地上部分总黄酮的分离纯化有较好的效果,该工艺可靠、稳定,可为工业化生产提供参考。
| 下载CSV 表 4 分离纯化工艺放大验证结果 Table 4 Scale-up verification results of separation and purification processes |
表 5为柴胡地上部分总黄酮纯化后对不同细菌和真菌的最低抑菌浓度。由表 5可知:纯化后总黄酮对供试的4种细菌和4种真菌均有一定的抑菌活性;对表皮葡萄球菌和鼠伤寒沙门菌的抑菌活性最强,MIC均为6.15 mg/mL;对球形马拉色菌的抑菌活性较强,MIC为12.30 mg/mL;相对于阳性对照组特比萘酚,总黄酮对糠秕马拉色菌的抑菌活性也较强,二者的MIC分别为12.5 mg/mL和24.60 mg/mL。因此,本文推测柴胡地上部分抑菌活性的主要成分可能为总黄酮类化合物。
| 下载CSV 表 5 柴胡地上部分总黄酮纯化后的最低抑菌浓度 Table 5 The minimum inhibitory concentration of total flavonoids from the aboveground parts of Bupleurum chinense after purification |
(1) 静态吸附与解吸附试验结果表明,在12种大孔吸附树脂中,NKA-II大孔吸附树脂对柴胡地上部分总黄酮的吸附及解吸附效果最好。
(2) 考察了吸附和洗脱条件对NKA-II树脂分离纯化总黄酮的影响,确定最佳的分离纯化工艺为:树脂径高比为2∶7、上样质量浓度为0.08 g/mL、上样流速为3.0 BV/h,上样量为16 BV,洗脱剂为70%乙醇,洗脱流速为2.5 BV/h,洗脱剂用量为10 BV。
(3) 工艺放大验证结果表明,在最佳的分离纯化工艺条件下,吸附量、解吸率及干浸膏中总黄酮含量分别为80.46 mg/g、95.72%和65.71%,分离纯化的效果较好。
(4) 抑菌活性测试结果表明,柴胡地上部分总黄酮经纯化后对供试的4种细菌和4种真菌均有一定的抑菌活性。其中,总黄酮对表皮葡萄球菌和鼠伤寒沙门菌的抑菌活性较强,MIC均为6.15 mg/mL;对球形马拉色菌和糠秕马拉色菌的抑真菌活性较强,MIC分别为12.30 mg/mL和24.60 mg/mL。
| [1] |
罗文蓉, 王雪岩, 杨扶德. 柴胡栽培品与野生品的生药学比较研究[J]. 西部中医药, 2011, 24(10): 11-14. LUO W R, WANG X Y, YANG F D. Study on the comparison of pharmacognosy between cultivated and wild Bupleurum goods[J]. Western Journal of Traditional Chinese Medicine, 2011, 24(10): 11-14. (in Chinese) DOI:10.3969/j.issn.1004-6852.2011.10.004 |
| [2] |
国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2020: 293. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(Volume 1)[M]. Beijing: China Medical Science Press, 2020: 293. (in Chinese) |
| [3] |
袁小晶, 程雪丹, 余马, 等. 柴胡地上部分成分分析及其解热镇痛活性研究[J]. 西南科技大学学报, 2019, 34(3): 86-89. YUAN X J, CHENG X D, YU M, et al. Analysis of the components of the aerial part of radix bupleuri and its antipyretic and analgesic activity[J]. Journal of Southwest University of Science and Technology, 2019, 34(3): 86-89. (in Chinese) DOI:10.3969/j.issn.1671-8755.2019.03.016 |
| [4] |
马艳芝. 不同柴胡品种抗氧化活性的比较与评价[J]. 时珍国医国药, 2017, 28(4): 968-970. MA Y Z. Comparison and evaluation of antioxidant activities of different Bupleurum species[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(4): 968-970. (in Chinese) |
| [5] |
王瑞娟, 王辉, 晋小军. 甘肃中部柴胡适宜采收期研究[J]. 甘肃农业科技, 2018, 1(1): 54-58. WANG R J, WANG H, JIN X J. Study on suitable harvesting time of Bupleurum in central Gansu province[J]. Gansu Agricultural Science and Technology, 2018, 1(1): 54-58. (in Chinese) DOI:10.3969/j.issn.1001-1463.2018.01.017 |
| [6] |
王宁. 北柴胡地上部分生物活性成分的研究[D]. 沈阳: 沈阳药科大学, 2005. WANG N. Studies on the bioactive constituents from aerial parts of Bupleurum chinense[D]. Shenyang: Shenyang Pharmaceutical University, 2005. (in Chinese) |
| [7] |
颜美玲, 杨柳, 侯阿娇, 等. 柴胡化学成分及药理作用研究进展[J]. 中医药信息, 2018, 35(5): 103-109. YAN M L, YANG L, HOU A J, et al. Research progress on chemical composition and pharmacological effect of Bupleurum chinense[J]. Information on Traditional Chinese Medicine, 2018, 35(5): 103-109. (in Chinese) |
| [8] |
杨林林, 赵钰, 韩梅, 等. 北柴胡和狭叶柴胡中黄酮类成分及其关键酶基因表达的组织差异分析[J]. 中草药, 2019, 50(1): 88-194. YANG L L, ZHAO Y, HAN M, et al. Analysis of tissues difference of flavonoids and key enzyme genes expression in Bupleurum chinense and B. scorzonerifolium[J]. Chinese Traditional and Herbal Drugs, 2019, 50(1): 88-194. (in Chinese) |
| [9] |
冯煦, 王鸣, 赵友谊, 等. 北柴胡茎叶总黄酮抗流感病毒的作用[J]. 植物资源与环境学报, 2002, 11(4): 15-18. FENG X, WANG M, ZHAO Y Y, et al. Effects of total flavonoid from the aerial part of Bupleurum chinense DC. on infected mice by influenza virus[J]. Journal of Plant Resources and Environment, 2002, 11(4): 15-18. (in Chinese) DOI:10.3969/j.issn.1674-7895.2002.04.003 |
| [10] |
袁王俊, 张维瑞, 吴宏欣, 等. HPLC法测定柴胡不同部位4种黄酮类成分[J]. 中成药, 2013, 35(4): 797-800. YUAN W J, ZHANG W R, WU H X, et al. Determination of four flavonoids in different parts of Bupleurum chinense by HPLC[J]. Chinese Traditional Patent Medicine, 2013, 35(4): 797-800. (in Chinese) DOI:10.3969/j.issn.1001-1528.2013.04.038 |
| [11] |
黄金, 刘艳, 潘娟, 等. 北柴胡地上部分正丁醇层的化学成分研究[J]. 中医药学报, 2020, 48(1): 38-41. HUANG J, LIU Y, PAN J, et al. Chemical constituents of n-butanol layer from the overground part of Bupleurum chinese DC.[J]. Acta Chinese Medicine and Pharmacology, 2020, 48(1): 38-41. (in Chinese) |
| [12] |
郝彩琴, 冷晓红, 郭鸿雁, 等. 不同溶剂和方法对柴胡地上部分总黄酮提取率的影响[J]. 现代医药卫生, 2018, 34(21): 3279-3282. HAO C Q, LENG X H, GUO H Y, et al. Study on the effects of different extraction solvents and extraction methods on the extraction rate of total flavonoids from the aerial part of Bupleurum chinense[J]. Journal of Modern Medicine & Health, 2018, 34(21): 3279-3282. (in Chinese) DOI:10.3969/j.issn.1009-5519.2018.21.005 |
| [13] |
贾可敬, 李湘洲, 殷凯. 长沙青皮竹叶中黄酮类化合物的提取工艺条件[J]. 经济林研究, 2014(2): 125-129. JIA K J, LI X Z, YIN K. Extraction techniques of flavonoids in Bambusa textilis leaves[J]. Nonwood Forest Research, 2014(2): 125-129. (in Chinese) |
| [14] |
王宗成, 蒋涛, 蒋小琴, 等. 樟树叶中总黄酮提取工艺的正交试验设计优化[J]. 时珍国医国药, 2015, 26(12): 2892-2894. WANG Z C, JIANG T, JIANG X Q, et al. Optimization on extraction technology of total flavonoids from leaves of camphor tree leaves by orthogonal experiment[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(12): 2892-2894. (in Chinese) |
| [15] |
荆常亮. 紫花苜蓿总黄酮的提取、纯化及其抗氧化活性研究[D]. 北京: 中国农业科学院, 2016. JING C L. Extraction, purification and antioxidant activities of flavonoids from alfalfa[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese) |
| [16] |
郝彩琴, 冷晓红, 李军, 等. 秦艽环烯醚萜苷类成分分离纯化工艺及抑菌活性研究[J]. 天然产物研究与开发, 2017, 29(12): 2104-2111, 2062. HAO C Q, LENG X H, LI J, et al. Separation, purification and antibacterial activity of iridoid glycosides from Gentiana macrophylla Pall.[J]. Natural Product Research and Development, 2017, 29(12): 2104-2111, 2062. (in Chinese) |
| [17] |
戴宇, 宋川霞, 陈红梅, 等. 大孔吸附树脂纯化胡芦巴提取物中4-羟基异亮氨酸的研究[J]. 世界科学技术—中医药现代化, 2015, 17(1): 283-287. DAI Y, SONG C X, CHEN H M, et al. Study on purification of 4-hydroxyisoleucine in Trigonella foenum-graecum L. extract using different macroporous resins[J]. World Science and Technology—Modernization of Traditional Chinese Medicine and Materia Medica, 2015, 17(1): 283-287. (in Chinese) |
| [18] |
陈小强, 张鹤, 杨逢建, 等. 向日葵茎髓提取物的抑菌活性及机制[J]. 精细化工, 2019, 36(4): 649-657. CHEN X Q, ZHANG H, YANG F J, et al. Antibacterial activity and mechanism of sunflower stalk pith extracts[J]. Fine Chemicals, 2019, 36(4): 649-657. (in Chinese) |
| [19] |
刘斌, 石任兵, 余超. 影响大孔吸附树脂吸附分离中草药化学成分的因素[J]. 中草药, 2002, 33(5): 475-476. LIU B, SHI R B, YU C. Factors affecting the adsorption and separation of chemical components of Chinese herbal medicine by macroporous adsorption resin[J]. Chinese Traditional and Herbal Drugs, 2002, 33(5): 475-476. (in Chinese) |








