2. 中国科学院 武汉植物园, 武汉 430074;
3. 天津大学 精密仪器与光电子工程学院, 天津 300072;
4. 上海大学 生命科学学院, 上海 200444
2. Wuhan Botanical Garden, Chinese Academy of Sciences, Wuhan 430074;
3. School of Precision Instrument and Opto-electronics Engineering, Tianjin University, Tianjin 300072;
4. School of Life Sciences, Shanghai University, Shanghai 200444, China
羽扇豆醇是一种重要的五环三萜化合物,广泛存在于西洋参、乳木果、大戟、木棉、阿兰藤黄以及绿玉树等药用植物中[1]。该化合物具有抗肿瘤、抗糖尿病、抗感染、抑菌、降血脂、降血压等多种药理活性,并且可以用于治疗肝损害和肾毒症等疾病[2-6]。在生物体内,羽扇豆醇由三萜化合物和植物甾醇的共同前体——2, 3-氧化鲨烯,在羽扇豆醇合酶的催化下经过一系列反应环化而成[7]。目前,已有AtLUP1(拟南芥,Arabidopsis thaliana)[8]、RcLUS(蓖麻,Ricinus communis)[9]、KdLUS(落地生根,Kalanchoe daigremontiana)[10]、GgLUP(光果甘草,Glycyrrhiza glabra)[11]和OeLUP(油橄榄,Olea europaea)[12]等多种来源于不同物种的羽扇豆醇合酶在酵母中获得异源表达并进行了功能验证。
非洲药用植物绿玉树(Euphorbia tirucalli L.)是大戟科大戟属植物,其提取物被证实具有抗病毒、抗氧化、抑菌、消炎和治疗关节炎等多种功效[13-17]。研究表明,绿玉树中存在大戟二烯醇、表大戟二烯醇、羽扇豆醇、α-香树脂醇、β-香树脂醇、蒲公英甾醇等多种三萜化合物[18-20],其中与大戟二烯醇、表大戟二烯醇、β-香树脂醇和蒲公英甾醇合成相关的基因已经被分离并进行了功能验证[21-22],而关于绿玉树中羽扇豆醇合酶基因的研究工作尚未见报道。本课题组在前期工作中通过绿玉树转录组学分析,从中筛选出7条假定的氧化鲨烯环化酶编码基因,并推测EtOSC7基因与羽扇豆醇的合成相关[23]。在此基础上,本文克隆了绿玉树EtOSC7基因的cDNA全长,并在酿酒酵母(Saccharomyces cerevisiae)中进行了功能验证;以EtOSC7基因为基础,在大肠杆菌(Escherichia coli)和酿酒酵母两种模式菌株中进行了羽扇豆醇生物合成的尝试。
1 实验部分 1.1 实验材料绿玉树的根、茎和叶采集自中国科学院武汉植物园温室(自然光照,25~28 ℃,相对湿度35%~55%)。每个部位的样品设置3个生物学重复,样品采集后用液氮速冻,于-80 ℃保存备用。
羽扇豆醇标准品(纯度≥94%),Sigma-Aldrich公司;大戟二烯醇(纯度≥98%)和蒲公英甾醇(纯度≥94%),上海源叶生物科技有限公司;表大戟二烯醇(纯度≥98%),成都瑞芬思生物科技有限公司;β-香树脂醇(纯度≥97%),上海甄准生物科技有限公司;甲醇、乙醇、乙酸乙酯、丙酮,均为分析纯,国药集团化学试剂有限公司;卡那霉素、氨苄青霉素、氯霉素、异丙基-β-D-硫代半乳糖苷(IPTG),北京鼎国昌盛生物技术有限公司。
EASYspin植物RNA提取试剂盒,北京艾德莱生物科技有限公司;DNase I和Revert Aid Reverse Transcriptase,Thermo Fisher Scientific公司;FastStart Universal SYBR Green Master Mix,Roche Diagnostics公司;ClonExpressⓇ II One Step Cloning Kit试剂盒,南京诺唯赞生物科技股份有限公司;TB培养基、酵母缺陷型培养基SD-Ura、酵母缺陷型培养基SD-Leu- Ura,北京索莱宝科技有限公司。本实验所用的菌株与质粒如表 1所示。
| 下载CSV 表 1 本实验所用的菌株与质粒 Table 1 Strains and plasmids used in this work |
将保存的绿玉树样品从-80 ℃冰箱中取出,用液氮研磨成粉末。将样品粉末转移至2 mL螺纹离心管中,加入1 mL提取试剂(V(乙酸乙酯)∶V(乙醇)=4∶1),重悬,超声萃取60 min。12 000 r/min离心10 min后,取上清液放入高通量溶剂工作站(miVac QUATTRO,Genevac公司)中旋蒸。将提取物溶于500 μL甲醇,用0.22 μm有机滤膜过滤。
1.3 总RNA的提取及实时荧光定量PCR(RT-qPCR)分析将绿玉树样品从-80 ℃冰箱中取出,用液氮研磨成粉末。使用EASYspin植物RNA提取试剂盒从样品粉末中提取总RNA,并用DNase I进一步消化以去除基因组DNA。然后用Revert Aid Reverse Transcriptase将RNA逆转录成cDNA。RT-qPCR分析所用的荧光核苷酸染料为FastStart Universal SYBR Green Master Mix,使用荧光定量PCR仪(Applied BiosystemsⓇ 7500,Applied Biosystems公司)进行基因表达的检测。采用2-ΔΔCt法计算EtOSC7基因的相对表达量,以actin为内参基因,以根组织的表达量为标准(设定为1)。使用Primer Express(版本5.0),基于转录序列设计用于mRNA定量的内含子跨越引物,所用引物如表 2所示。
| 下载CSV 表 2 本实验所用的引物 Table 2 Primers used in this work |
以绿玉树cDNA为模板进行PCR扩增,所用引物如表 2所示。将纯化后的扩增产物用ClonExpressⓇ Ⅱ One Step Cloning Kit试剂盒分别克隆至pET30a和pESC-Ura载体上。连接产物转化至E. coli DH5α,挑取单克隆经PCR扩增后,使用水平电泳仪(DYCZ-31BN,北京六一生物科技有限公司)进行琼脂糖凝胶电泳鉴定,采用恒压模式,电压为120 V,运行30 min。选取阳性克隆送至北京擎科生物科技有限公司测序。
1.5 绿玉树EtOSC7基因在酿酒酵母中的诱导表达采用醋酸锂法将载体pESC-Ura-EtOSC7转化至羊毛甾醇缺陷型酿酒酵母GIL77中[26]。将转基因酵母接种至SD-Ura液体培养基(含2%葡萄糖、0.5% Tween 80、3 μg/mL氯化血红素以及20 μg/mL麦角甾醇)中,于30 ℃、250 r/min过夜培养。次日使用紫外分光光度仪(UV-1200,上海美谱达仪器有限公司)在600 nm波长处测定光密度(OD600),以初始OD600为0.4将种子液稀释至30 mL SD-Ura液体培养基(含2%半乳糖、0.5% Tween 80、3 μg/mL氯化血红素以及20 μg/mL麦角甾醇)中。于30 ℃、250 r/min的条件下诱导培养48 h,取4 mL培养物用于产物检测。
采用醋酸锂法将载体pESC-Ura-EtOSC7和PESC-Leu2d-AaCPR-tSQS-rSE共转至酿酒酵母EPY300中[26]。将转基因酵母接种至SD-Leu-Ura液体培养基(含2%葡萄糖)中,于30 ℃、250 r/min过夜培养,次日使用紫外分光光度仪在600 nm波长处测量OD600,以初始OD600为0.4将种子液稀释至30 mL SD-Leu-Ura液体培养基(含2%半乳糖)中。于30 ℃、250 r/min条件下诱导培养72 h,取4 mL培养物用于产物检测。
1.6 绿玉树EtOSC7基因在大肠杆菌中的诱导表达采用热激法(42 ℃水浴90 s,冰浴2 min)将构建的PET30a-EtOSC7转入CaCl2处理后的大肠杆菌BL21(DE3)-tSQS-AaCPR-rSE-Mev感受态细胞中,获得菌株B02。将重组菌株接种至TB培养基(含20 mmol/L MgSO4、50 μg/mL卡那霉素、80 μg/mL氨苄青霉素以及34 μg/mL氯霉素)中,于37 ℃、220 r/min过夜培养。次日将种子液以1∶100(体积比)转接至30 mL TB培养基中。于30 ℃、220 r/min条件下培养4 h(OD600达到0.4),添加终浓度为0.4 mmol/L的IPTG进行诱导表达。在30 ℃、220 r/min的条件下培养4 d,取4 mL培养物用于产物检测。
1.7 重组菌株中羽扇豆醇的提取及测定将培养物置于真空冷冻干燥仪(LGJ-10,北京松源华兴科技发展有限公司)中冻干。向冻干后的大肠杆菌培养物中加入1 mL丙酮,酿酒酵母培养物中加入1 mL丙酮和200 μL酸洗玻璃珠。用组织研磨仪(SCIENTZ-48,施耐德电气公司)研磨震荡30 min后,离心收集上清液,放入高通量溶剂工作站中旋蒸。将提取物溶于200 μL甲醇,用0.22 μm有机滤膜过滤。
使用气相色谱-质谱联用仪(GC-MS)(7890A/7000C,安捷伦公司)对提取物进行分析。气相色谱柱为HP-5 MS(30 m×0.25 mm×0.25 μm,安捷伦公司),载气(氦气)流速0.8 mL/min,进样口温度250 ℃,进样量1 μL。分析程序为:80 ℃保持2 min,20 ℃/min升至310 ℃,保持15 min。采用全扫描模式,扫描范围为50~600 m/z。
1.8 EtOSC7在大肠杆菌中的表达产物的凝胶电泳检测添加终浓度为0.4 mmol/L的IPTG对重组菌株B02进行诱导表达,同时设置不添加IPTG的对照组,在30 ℃、220 r/min的条件下培养6 h。收集菌体并用缓冲液(50 mmol/L Tris-HCl,300 mmol/L NaCl,pH7.5)重悬。使用超声破碎仪(JY92-IIN,宁波新艺生物科技股份有限公司)进行超声破碎后,12 000 r/min离心15 min,分别收集上清和沉淀。使用垂直电泳仪(DYCZ-24DH,北京六一生物科技有限公司),分别对重组菌株B02未诱导的全细胞样品、IPTG诱导的全细胞样品、IPTG诱导的超声上清样品和IPTG诱导的超声沉淀样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测。电泳程序为:恒压模式,电压80 V,运行30 min,随后改为120 V,运行90 min。
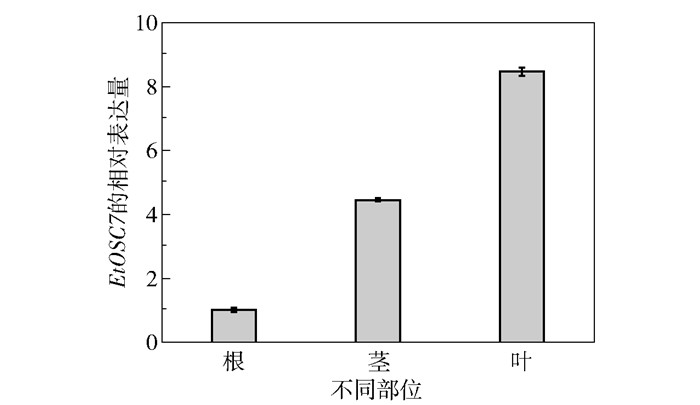
2 结果与讨论 2.1 绿玉树三萜化合物组分及EtOSC7基因转录水平分析结果通过GC-MS对绿玉树的根、茎及叶中三萜化合物的组成进行测定,结果如表 3所示。可以看出,绿玉树的茎中三萜化合物成分占总化合物的含量最高,可达41.8%;叶和根中三萜化合物的含量较低,分别为11.2%和10.9%。在叶中羽扇豆醇的含量较高,可达1.1%,根中羽扇豆醇的含量最低。采用RT-qPCR进一步对羽扇豆醇合酶候选基因EtOSC7在绿玉树不同部位中的表达差异进行分析,结果如图 1所示。EtOSC7基因在叶中的表达水平最高,其次是茎,在根中的表达水平最低,这与绿玉树不同部位中的羽扇豆醇含量情况一致。通过分析绿玉树根、茎、叶中的羽扇豆醇含量与候选基因EtOSC7的基因表达水平,初步确定EtOSC7为绿玉树中羽扇豆醇的关键合成基因。
| 下载CSV 表 3 绿玉树的根、茎、叶中三萜化合物成分分析结果 Table 3 Analysis results of triterpenoids in roots, stems and leaves of E. tirucalli |
|
图 1 绿玉树的EtOSC7基因在根、茎、叶中的表达差异分析 Fig.1 Differential expression analysis of EtOSC7 gene in roots, stems and leaves of E. tirucalli |
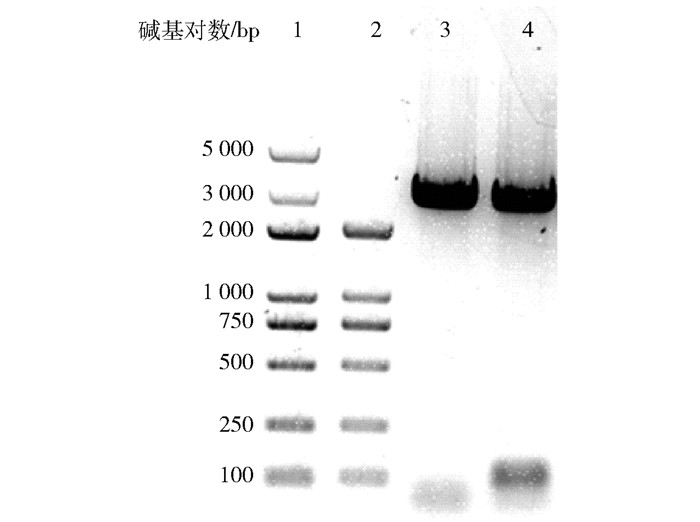
以绿玉树cDNA为模板进行PCR扩增后获取目的基因,将其克隆至pET30a和pESC-Ura载体上,进行凝胶电泳鉴定,结果如图 2所示。阳性克隆的测序结果表明,绿玉树EtOSC7基因全长为2 301 bp,编码766个氨基酸。通过在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(https://www.ncbi.nlm.nih.gov/)中与目前已确定功能的三萜环化酶进行序列比对,结果显示EtOSC7与来源于其他植物的羽扇豆醇合酶具有一定同源性,其中与来源于蓖麻的RcLUS和来源于木览(Bruguiera gymnorhiza)的BgLUS的相似度分别为78%和76%。
|
1—DNA marker DL 5000;2—DNA marker DL 2000;3—pET30a-EtOSC7; 4—pESC-Ura-EtOSC7。 图 2 菌落PCR产物的凝胶电泳图 Fig.2 Gel electrophoresis of colony PCR products |
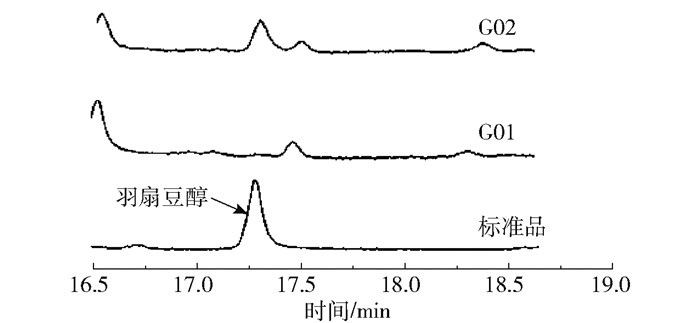
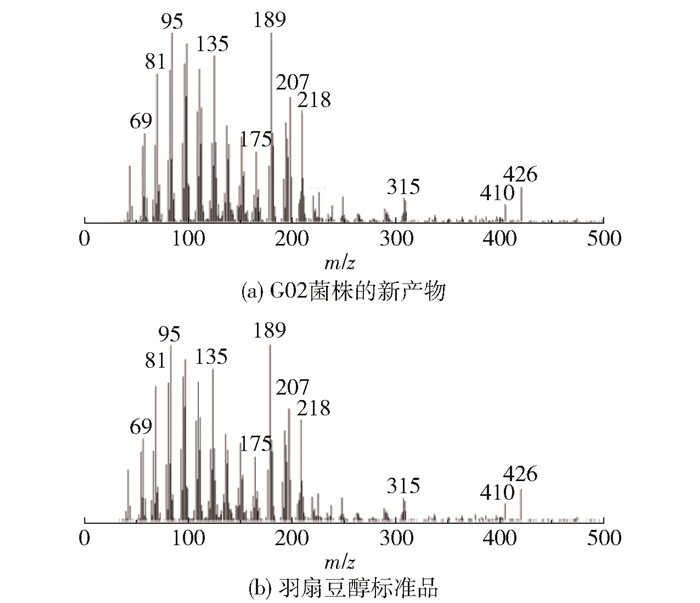
分别将酵母表达载体pESC-Ura和pESC-Ura-EtOSC7转入羊毛甾醇缺陷型酵母菌株GIL77中,获得G01(对照菌株)和G02菌株。提取半乳糖诱导表达48 h后的萜类产物并使用GC-MS进行检测,结果如图 3和图 4所示。由结果可以看出,与G01菌株相比,G02在保留时间17.4 min处有新的产物出现,并且该产物与羽扇豆醇标准品的保留时间和质谱离子碎片峰相一致,说明本研究分离的绿玉树EtOSC7基因的编码蛋白具有羽扇豆醇合酶的活性。
|
图 3 G01和G02菌株表达产物的总离子色谱图 Fig.3 Total ion chromatograms of the expression products of G01 and G02 strains |
|
图 4 G02菌株的新产物与羽扇豆醇标准品的离子碎片峰 Fig.4 Ion fragment peaks of the new product of G02 strain and lupeol standard |
转录组学分析表明,绿玉树中参与三萜化合物合成的氧化鲨烯环化酶的编码基因总共有7条[23],其中EtOSC3、EtOSC5和EtOSC6分别被证实参与β-香树脂醇、大戟二烯醇和表大戟二烯醇以及β-香树脂醇和蒲公英甾醇的合成[21-22]。羽扇豆醇合酶EtOSC7的发现将进一步为绿玉树氧化鲨烯环化酶的多态化研究提供参考。
2.3 羽扇豆醇的生物合成BL21(DE3)-tSQS-AaCPR-rSE-Mev是本实验室构建的一株优化三萜合成通路的重组菌株[24],该菌株能够为羽扇豆醇的合成提供重组的前体物质——2, 3-氧化鲨烯。分别将表达载体pET30a和pET30a-EtOSC7转入该重组菌株,获得B01和B02菌株。提取ITPG诱导表达96 h后的萜类产物并使用GC-MS进行检测,B01和B02菌株在羽扇豆醇标准品的保留时间处均未检测到新的产物,说明本研究分离的绿玉树EtOSC7基因的编码蛋白不能在大肠杆菌中正常表达。
酿酒酵母菌株EPY300是一株萜类高产菌株,能够为萜类的合成提供充足的前体物质法尼基焦磷酸[26]。为了能够高效地生物合成羽扇豆醇,本研究将3个上游基因tSQS[27]、rSE[28]和AaCPR[29]与EtOSC7一起在EPY300菌株中进行了共表达,获得E02菌株。另外将pESC-Leu2d-AaCPR-tSQS-rSE和空载pESC-Ura转入该重组菌株,获得对照菌株E01。将重组酵母菌株E01和E02在30 ℃下诱导培养72 h,通过GC-MS测定羽扇豆醇产量,结果显示在E01菌株中未检测到羽扇豆醇,在E02菌株中测得羽扇豆醇的产量为0.55 mg/L,这与本实验室报道的酿酒酵母工程菌株ECHHOe尚有很大差距,其羽扇豆醇的产量最高可达200 mg/L[24],原因可能为:来源于油橄榄的羽扇豆醇合酶OeLUP的活性高于EtOSC7;OeLUP进行了酿酒酵母密码子偏好性优化,而EtOSC7则是直接克隆于绿玉树cDNA。后续可以通过对EtOSC7进行酿酒酵母密码子偏好性优化,增加基因拷贝数或者替换强启动子来提高EtOSC7表达水平,以及通过优化代谢合成途径来增加前体供应,从而提高羽扇豆醇产量。
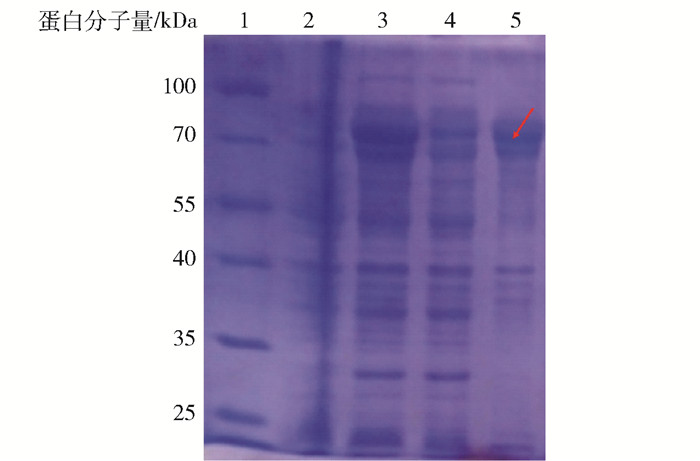
酿酒酵母和大肠杆菌是两种公认的“微生物工厂”,很多天然产物的生物合成都是以二者作为平台。酿酒酵母中的麦角甾醇与三萜类化合物有着共同的前体——2, 3-氧化鲨烯,同时酿酒酵母还具有完整的膜系统。目前,三萜化合物的生物合成大多以酿酒酵母作为宿主细胞[30]。而大肠杆菌系统缺乏2, 3-氧化鲨烯的代谢途径,因此与酿酒酵母相比,在代谢流中没有甾醇合成的旁路竞争。通过在大肠杆菌系统中构建真核来源的MVA途径和优化鲨烯合成途径,可以使鲨烯产量最高达200 mg/L[24]。因此,在大肠杆菌中人工合成三萜化合物同样具有很大的潜力。本研究分别在酿酒酵母和大肠杆菌中进行了生物合成羽扇豆醇的尝试,通过在重组酵母EPY300菌株中优化羽扇豆醇的合成途径,使得羽扇豆醇产量为0.55 mg/L。然而,在大肠杆菌中没有成功合成羽扇豆醇,这可能与EtOSC7在大肠杆菌细胞中的蛋白错误折叠而形成包涵体有关。图 5为重组蛋白EtOSC7在大肠杆菌中的表达情况分析,结果显示在ITPG诱导后的超声沉淀样品中检测到目的蛋白,说明EtOSC7在大肠杆菌中以包涵体的形式存在。目前,在大肠杆菌中生物合成三萜化合物的研究相对较少,仅有达玛二烯醇、β-香树脂醇和环阿屯醇被报道[31-32]。
|
1—蛋白marker;2—重组菌株B02未诱导的全细胞样品;3—IPTG诱导的全细胞样品;4—IPTG诱导的超声上清样品;5—IPTG诱导的超声沉淀样品。红色箭头表示目的蛋白所在位置。 图 5 EtOSC7在大肠杆菌中的表达产物的SDS-PAGE电泳图 Fig.5 SDS-PAGE electropherogram of the expression product of EtOSC7 in E. coli |
本研究首次从绿玉树中分离获得催化羽扇豆醇合成的氧化鲨烯环化酶基因EtOSC7,测序结果表明该基因全长2 301 bp,编码766个氨基酸;将EtOSC7基因在羊毛甾醇缺陷型酵母GIL77菌株中进行了异源表达,结果证明该基因能够编码羽扇豆醇合酶;此外,以EtOSC7基因为基础,在大肠杆菌和酿酒酵母中进行了羽扇豆醇生物合成的尝试,结果表明,在大肠杆菌中没有成功合成羽扇豆醇,而在重组酵母EPY300菌株中测得羽扇豆醇的产量为0.55 mg/L。本文的研究结果可以为构建三萜化合物微生物细胞工厂提供新的基因元件,并为羽扇豆醇的生物合成提供理论支持。
| [1] |
SALEEM M. Lupeol, a novel anti-inflammatory and anti-cancer dietary triterpene[J]. Cancer Letters, 2009, 285(2): 109-115. DOI:10.1016/j.canlet.2009.04.033 |
| [2] |
FERNÁNDEZ M A, DE LAS HERAS B, GARCÍA M D, et al. New insights into the mechanism of action of the anti-inflammatory triterpene lupeol[J]. Journal of Pharmacy & Pharmacology, 2001, 53(11): 1533-1539. |
| [3] |
PRASAD S, KUMAR Y V, SRIVASTAVA S, et al. Protective effects of lupeol against benzo[a]pyrene induced clastogenicity in mouse bone marrow cells[J]. Molecular Nutrition & Food Research, 2008, 52(10): 1117-1120. |
| [4] |
SETZER W N, SETZER M C. Plant-derived triterpenoids as potential antineoplastic agents[J]. Mini Reviews in Medicinal Chemistry, 2003, 3(6): 540-556. DOI:10.2174/1389557033487854 |
| [5] |
SUDHARSAN P T, MYTHILI Y, SELVAKUMAR E, et al. Lupeol and its ester exhibit protective role against cyclophosphamide-induced cardiac mitochondrial toxicity[J]. Journal of Cardiovascular Pharmacology, 2006, 47(2): 205-210. DOI:10.1097/01.fjc.0000200658.89629.ba |
| [6] |
YAMASHITA K, LU H, LU J, et al. Effect of three triterpenoids, lupeol, betulin, and betulinic acid on the stimulus-induced superoxide generation and tyrosyl phosphorylation of proteins in human neutrophils[J]. Clinica Chimica Acta, 2002, 325(1-2): 91-96. DOI:10.1016/S0009-8981(02)00252-8 |
| [7] |
ABE I. Enzymatic synthesis of cyclic triterpenes[J]. Natural Product Reports, 2007, 24(6): 1311-1331. DOI:10.1039/b616857b |
| [8] |
HERRERA J B R, BARTEL B, WILSON W K, et al. Cloning and characterization of the Arabidopsis thaliana lupeol synthase gene[J]. Phytochemistry, 1998, 49(7): 1905-1911. DOI:10.1016/S0031-9422(98)00366-5 |
| [9] |
BASYUNI M, OKU H, TSUJIMOTO E, et al. Triterpene synthases from the Okinawan mangrove tribe, Rhizophoraceae[J]. FEBS Journal, 2007, 274(19): 5028-5042. DOI:10.1111/j.1742-4658.2007.06025.x |
| [10] |
WANG Z, YEATS T, HAN H, et al. Cloning and characterization of oxidosqualene cyclases from Kalanchoe daigremontiana: enzymes catalyzing up to 10 rearrangement steps yielding friedelin and other triterpenoids[J]. Journal of Biological Chemistry, 2010, 285(39): 29703-29712. DOI:10.1074/jbc.M109.098871 |
| [11] |
HAYASHI H, HUANG P, TAKADA S, et al. Differential expression of three oxidosqualene cyclase mRNAs in Glycyrrhiza glabra[J]. Biological & Pharmaceutical Bulletin, 2004, 27(7): 1086-1092. |
| [12] |
SHIBUYA M, ZHANG H, ENDO A, et al. Two branches of the lupeol synthase gene in the molecular evolution of plant oxidosqualene cyclases[J]. European Journal of Biochemistry, 1999, 266(1): 302-307. DOI:10.1046/j.1432-1327.1999.00875.x |
| [13] |
DE OLIVEIRA L F S, FUENTEFRIA A M, KLEIN F S, et al. Antifungal activity against Cryptococcus neoformans strains and genotoxicity assessment in human leukocyte cells of Euphorbia tirucalli L.[J]. Brazilian Journal of Microbiology, 2014, 45(4): 1349-1355. DOI:10.1590/S1517-83822014000400027 |
| [14] |
BANI S, KAUL A, KHAN B, et al. Anti-arthritic activity of a biopolymeric fraction from Euphorbia tirucalli[J]. Journal of Ethnopharmacology, 2007, 110(1): 92-98. DOI:10.1016/j.jep.2006.09.021 |
| [15] |
YADAV R, SRIVASTAVA V K, CHANDRA R, et al. Larvicidal activity of latex and stem bark of Euphorbia tirucalli plant on the mosquito Culex quinquefasciatus[J]. The Journal of Communicable Diseases, 2002, 34(4): 264-269. |
| [16] |
BETANCUR-GALVIS L A, MORALES G E, FORERO J E, et al. Cytotoxic and antiviral activities of colombian medicinal plant extracts of the Euphorbia genus[J]. Memórias do Instituto Oswaldo Cruz, 2002, 97(4): 541-546. DOI:10.1590/S0074-02762002000400017 |
| [17] |
JURBERG P, CABRAL NETO J B, SCHALL V T. Molluscicide activity of the "avelós" plant (Euphorbia tirucalli, L.) on Biomphalaria glabrata, the mollusc vector of schistosomiasis[J]. Memórias do Instituto Oswaldo Cruz, 1985, 80(4): 423-427. DOI:10.1590/S0074-02761985000400007 |
| [18] |
KHAN A Q, AHMED Z, KAZML N U, et al. Further triterpenes from the stem bark of Euphorbia tirucalli[J]. Planta Medica, 1987, 53(6): 577. DOI:10.1055/s-2006-962820 |
| [19] |
KHAN A Q, KAZMI S N, AHMED Z, et al. Euphorcinol: a new pentacyclic triterpene from Euphorbia tirucalli[J]. Planta Medica, 1989, 55(3): 290-291. DOI:10.1055/s-2006-962008 |
| [20] |
FÜRSTENBERGER G, HECKER E. New highly irritant euphorbia factors from latex of Euphorbia tirucalli L.[J]. Experientia, 1977, 33(8): 986-988. DOI:10.1007/BF01945920 |
| [21] |
QIAO W B, FENG W, YANG L, et al. De novo biosynthesis of the anticancer compound euphol in Saccharomyces cerevisiae[J]. ACS Synthetic Biology, 2021, 10(9): 2351-2358. DOI:10.1021/acssynbio.1c00257 |
| [22] |
KAJIKAWA M, YAMATO K T, FUKUZAWA H, et al. Cloning and characterization of a cDNA encoding β-amyrin synthase from petroleum plant Euphorbia tirucalli L.[J]. Phytochemistry, 2005, 66(15): 1759-1766. DOI:10.1016/j.phytochem.2005.05.021 |
| [23] |
QIAO W B, LI C F, MOSONGO I, et al. Comparative transcriptome analysis identifies putative genes involved in steroid biosynthesis in Euphorbia tirucalli[J]. Genes, 2018, 9(1): 38. DOI:10.3390/genes9010038 |
| [24] |
QIAO W B, ZHOU Z L, LIANG Q, et al. Improving lupeol production in yeast by recruiting pathway genes from different organisms[J]. Scientific Reports, 2019, 9(1): 2992. DOI:10.1038/s41598-019-39497-4 |
| [25] |
KUSHIRO T, SHIBUYA M, EBIZUKA Y. Beta-amyrin synthase—cloning of oxidosqualene cyclase that catalyzes the formation of the most popular triterpene among higher plants[J]. European Journal of Biochemistry, 1998, 256(1): 238-244. DOI:10.1046/j.1432-1327.1998.2560238.x |
| [26] |
NGUYEN T D, MACNEVIN G, RO D K. De novo synthesis of high-value plant sesquiterpenoids in yeast[J]. Methods in Enzymology, 2012, 517: 261-278. |
| [27] |
THOMPSON J F, DANLEY D E, MAZZALUPO S, et al. Truncation of human squalene synthase yields active, crystallizable protein[J]. Archives of Biochemistry and Biophysics, 1998, 350(2): 283-290. DOI:10.1006/abbi.1997.0502 |
| [28] |
ABE I, ABE T, LOU W, et al. Site-directed mutagenesis of conserved aromatic residues in rat squalene epoxidase[J]. Biochemical and Biophysical Research Communications, 2007, 352(1): 259-263. DOI:10.1016/j.bbrc.2006.11.014 |
| [29] |
YIN H, ZHUANG Y B, LI E E, et al. Heterologous biosynthesis of costunolide in Escherichia coli and yield improvement[J]. Biotechnology Letters, 2015, 37(6): 1249-1255. DOI:10.1007/s10529-015-1784-6 |
| [30] |
朱明, 王彩霞, 李春. 工程化酿酒酵母合成植物三萜类化合物[J]. 化工学报, 2015, 66(9): 3350-3356. ZHU M, WANG C X, LI C. Engineered Saccharomyces cerevisiae for biosynthesis of plant triterpenoids[J]. CIESC Journal, 2015, 66(9): 3350-3356. (in Chinese) |
| [31] |
TAKEMURA M, TANAKA R, MISAWA N. Pathway engineering for the production of β-amyrin and cycloartenol in Escherichia coli—a method to biosynthesize plant-derived triterpene skeletons in E. coli[J]. Applied Microbiology and Biotechnology, 2017, 101(17): 6615-6625. DOI:10.1007/s00253-017-8409-z |
| [32] |
LI D S, ZHANG Q, ZHOU Z J, et al. Heterologous biosynthesis of triterpenoid dammarenediol-Ⅱ in engineered Escherichia coli[J]. Biotechnology Letters, 2016, 38(4): 603-609. DOI:10.1007/s10529-015-2032-9 |








