微生物燃料电池(microbial fuel cell, MFC)是一种利用产电微生物自身的新陈代谢过程,将有机物燃料中的化学能转化为电能的装置[1-4]。MFC具有无污染、无需外界供能、运行条件适中等优势,可以用于废水处理、发电和海水淡化等领域,是一种应用前景广阔的绿色生物能源[5-7]。但是,MFC存在由于电子传递慢等原因所导致的性能差和效率低等问题[8]。
目前,提高MFC性能的主要方法有筛选与改造微生物[9]、研制新型电极材料[10-11]以及改进MFC装置结构等[12-13]。由于产电微生物是MFC系统的核心,因此从自然界中筛选新的产电微生物是提高MFC产电效率的重要手段之一[14-15]。此外,将微生物应用在MFC阴极时,MFC启动的成本较低,且无需添加外介质,能够保证MFC持续稳定地高效运行[16-18]。生物阴极的应用可以扩宽MFC的研究思路,增加能源储备和提高MFC能量输出率[19-22]。Rabaey等[23]在MFC阴极室接种纯培养的鞘脂杆菌(Sphingobacterium)、不动杆菌(Acinetobacter)和嗜酸菌(Acidovorax),与阴极未接种菌株的对照组对比,MFC的电功率密度提高了226.67%。杨茜等[24]利用高盐浓度废水构建了双室硝化细菌(nitrobacter)生物阴极MFC,最大电功率密度为2.72 W/m3,氨氮的最高降解率达92.89%。谢珊等[25]在MFC阴极室接种硝化细菌,最大输出功率密度可达45.5 W/m3。Cho等[26]利用MFC阴极受体的原理,在单室空气阴极MFC中接种光合细菌——球形红细菌(Rhodobacter sphaeroides),细菌光合作用产生的氢气被营养物质利用,电池的输出功率密度可达790 mW/m2。为了进一步扩展生物阴极微生物的菌种范围,提高MFC的产电性能,本文从自然环境中筛选了一株具有光依赖性生长的菌株,经鉴定为门多萨假单胞菌(Pseudomonas mendocina),并将该菌株应用在双室MFC的阴极室中,测试了其产电性能。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料供试菌种采自北京化工大学昌平校区湖水及周边土壤;大肠杆菌E. coli-BL21(DE3),天根生化科技(北京)有限公司;N-117型质子交换膜,Dupont公司;细菌基因组DNA抽提试剂盒、DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;BG11培养基,青岛海博生物技术有限公司。
BG11液体培养基 取1.7 g BG11培养基溶解于1 000 mL蒸馏水中,121 ℃高压灭菌30 min。
BG11固体培养基 在BG11液体培养基的基础上添加10 g/L琼脂。
阳极液 葡萄糖3 g/L(营养物质),氯化铵0.19 g/L,氯化钠0.5 g/L,二水合氯化钙0.03 g/L,七水合硫酸镁0.03 g/L,碳酸氢钠1 g/L,磷酸二氢钾5 g/L,三水合磷酸氢二钾3.86 g/L,微量元素12.5 mL/L。
阴极液 BG11培养基1.7 g/L,氯化钠0.5 g/L,二水合氯化钙0.03 g/L,七水合硫酸镁0.03 g/L,碳酸氢钠1 g/L,磷酸二氢钾5 g/L,三水合磷酸氢二钾3.86 g/L,硝酸钠0.3 g/L,微量元素12.5 mL/L。
微量元素 氨三乙酸1.5 g/L,七水合硫酸镁6.14 g/L,硫酸锰0.5 g/L,氯化钠1 g/L,七水合硫酸亚铁0.1 g/L,二水合氯化钙0.1 g/L,氯化钴0.1 g/L,氯化锌0.13 g/L,五水硫酸铜0.01 g/L,硫酸铝钾0.01 g/L,硼酸0.01 g/L,钼酸钠0.03 g/L。
1.1.2 实验仪器G154TW型高压灭菌锅(致微(厦门)仪器有限公司),PGX-350B型智能光照培养箱(宁波赛福实验仪器有限公司),SW-CJ-1FD型单人单面垂直净化工作台(苏州博莱尔净化设备有限公司),2720 Thermal Cycler型PCR仪(Applied Biosystems公司),BHWY-100B型摇床(宁波赛福实验仪器有限公司),Nikon Eclipse E100型正置光学显微镜(日本尼康株式会社),P4型紫外可见分光光度计(上海美谱达仪器有限公司),100 mL MFC装置(Wenoote公司),1 000 Ω电阻(深圳市柒鑫微科技有限公司),EM9636型电压采集器(北京中泰联创科技有限公司),CH1660E型电化学工作站(上海辰华仪器有限公司),XC-200型消解仪(杭州陆恒生物科技有限公司),LH-T725型多参数水质分析仪(杭州陆恒生物科技有限公司)。
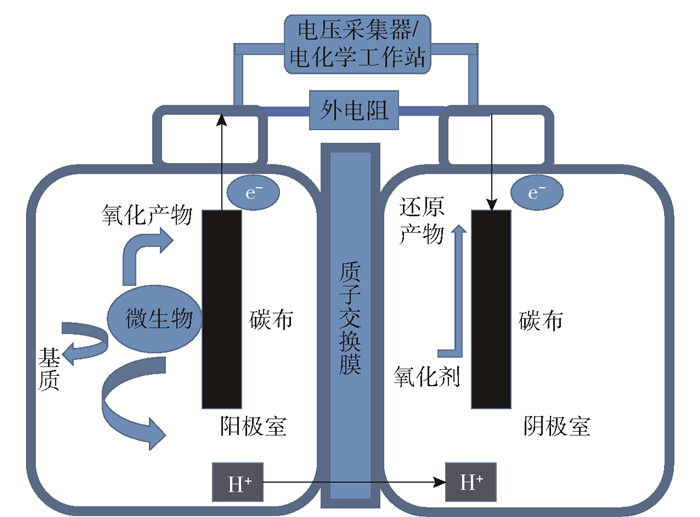
1.2 实验装置图 1为本实验使用的双室MFC装置示意图。MFC装置由阳极室和阴极室组成,两室的体积均为100 cm3,中间用质子交换膜分隔。每个室内都有一块5 cm×5 cm的碳布(用于接种微生物),外部通过电阻经外接导线连接。MFC阳极室产生的H+通过质子交换膜传递到阴极室,阳极室产生的电子通过外电路经外电阻转移到阴极室,由此构成MFC的电流通路。
|
图 1 双室MFC装置示意图 Fig.1 Schematic diagram of a two-chamber MFC device |
将采集的湖水样本直接涂布到BG11固体培养基上,将土壤样本按照m(土壤)∶m(水)=1∶1制成悬浊液后涂布,然后置于光照培养箱(光照强度为12 000 lx)中于32 ℃培养7 d。从中挑取出生长状况较好的单菌落,划线到新的BG11固体培养基中,在光照培养箱中于32 ℃培养7 d。选择长势较好的菌落,转移到BG11液体培养基中进行富集,于32 ℃光照培养30 d,将菌液用30%甘油于-80 ℃保藏。
1.4 菌株形态观察将筛选出的菌株涂布在BG11固体培养基平板上,肉眼观察菌落形态。将菌株进行革兰氏染色后,使用正置光学显微镜观察菌体形态。
1.5 菌种鉴定使用细菌基因组DNA抽提试剂盒提取待测菌株基因组,采用通用引物扩增菌株的16s rRNA片段(引物1:5′-ATGTTTGATCMTGGCTCAG-3′;引物2: 5′-GGTTACTTGTTACGACTT-3′),使用DNA胶回收试剂盒回收扩增产物,通过1%(质量分数)琼脂糖凝胶电泳纯化后送至生工生物工程(上海)股份有限公司测序。在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)中将测序结果与已知种属的基因序列比对并进行分类鉴定。
1.6 菌株生理生化表征参照文献[27]对菌株进行生理生化实验分析,分析项目包括可溶性淀粉水解、脂肪水解、牛奶石蕊分解、明胶水解、糖酵解和IMViC实验等。
1.7 菌株光依赖性实验取200 μL菌液接种到10 mL的BG11液体培养基中,置于摇床中在12 000 lx的光照强度下于32 ℃、211 r/min振荡培养7 d,对照组避光培养。使用紫外可见分光光度计在600 nm波长处测定菌液的吸光度。
1.8 MFC产电性能测定MFC阳极室中通入阳极液,E. coli(700 μL菌液+300 μL 30%甘油)事先接种在阳极室的碳布上。阴极室通入含有BG11培养基的阴极液,菌株(700 μL菌液+300 μL 30%甘油)事先接种在阴极室的碳布上。将组装好的MFC装置连接电压采集器,用于收集MFC的输出电压。利用电化学工作站测定MFC的电功率密度和循环伏安曲线。
1.9 化学需氧量(COD)测定收集阳极液,离心后取2 mL上清液加入COD预装管中,使用消解仪于165 ℃高温消解30 min,同时以超纯水代替电极液作为参照,采用多参数水质分析仪测定样品的COD值。
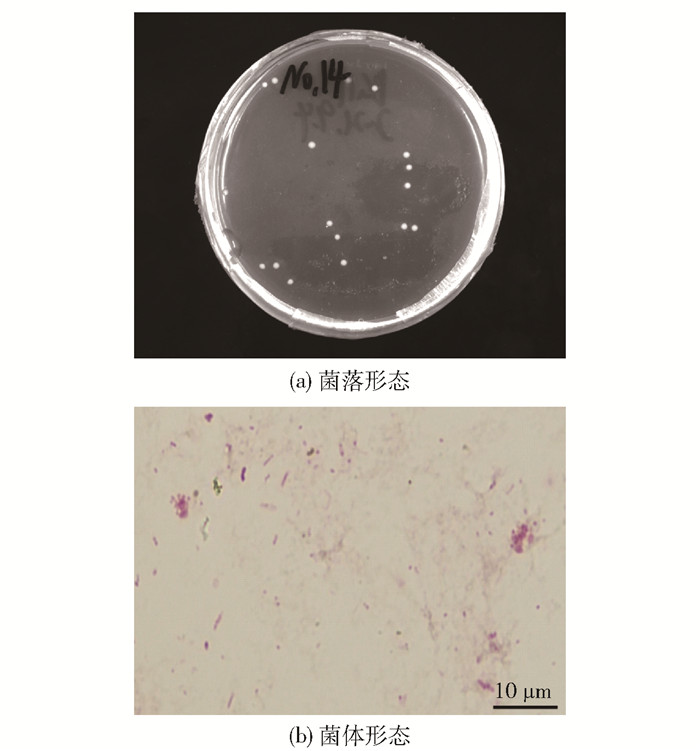
2 结果与讨论 2.1 菌株形态与菌种鉴定结果图 2为所筛选菌株的菌落形态和革兰氏染色后的菌体形态。可以看出,菌落呈白色,略显透明,边缘光滑,表面湿润(图 2 (a)),菌体呈杆状或水滴状(图 2 (b))。
|
图 2 所筛选菌株的菌落形态和革兰氏染色后的菌体形态 Fig.2 Colony morphology of screened strains and bacterial morphology after Gram staining |
基因测序结果显示,所筛选菌株的16s rRNA基因序列的长度为1 486 bp。采用核糖体数据库进行序列比对,利用MEGA7.0软件构建系统发育树,结果如图 3所示。可以看出,所筛选的菌株与Pseudomonas mendocina的相似程度达到94%,因此鉴定该菌株为门多萨假单胞菌,编号为LR134290。

|
图 3 所筛选菌株的系统发育树 Fig.3 Phylogenetic tree of the screened strain |
表 1为菌株LR134290的生理生化实验结果。可以看出,菌株LR134290具有分解乳糖、明胶和西蒙氏枸椽酸盐的能力。
| 下载CSV 表 1 菌株LR134290的生理生化实验结果 Table 1 Physiological and biochemical experimental results of strain LR134290 |
将菌株LR134290分别在光照和避光条件下培养7 d,测定菌液的吸光度。结果显示,光照条件下菌株LR134290的吸光度为0.56,远高于避光条件下该菌株的吸光度(0.01),表明菌株LR134290的生长具有光依赖性。
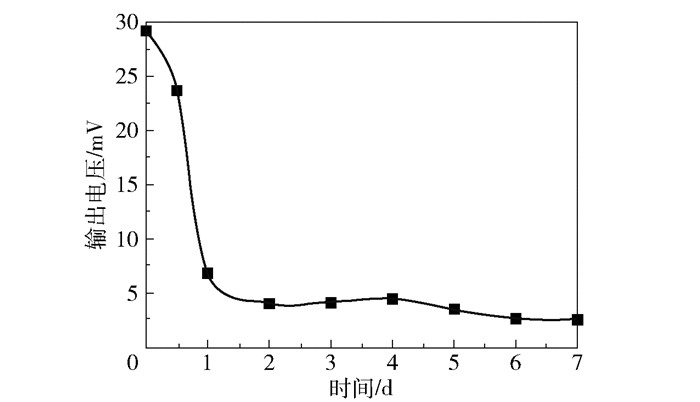
2.4 菌株的MFC产电性能为了验证菌株LR134290是否具有单独产电能力,向MFC阳极室中通入BG11液体培养基作为阳极液,菌株LR134290(700 μL菌液+300 μL 30%甘油)事先接种在阳极室的碳布上,阴极室通入阴极液。将菌株LR134290在MFC阳极室中培养7 d,测定输出电压,结果如图 4所示。在0~2 d,菌株LR134290的输出电压随培养时间的增加急剧减小,2 d后输出电压的变化趋势平缓;在刚进行培养时菌株LR134290的输出电压最大,约为29 mV。结果表明菌株LR134290具有一定的单独产电能力。
|
图 4 菌株LR134290作为生物阳极的MFC输出电压曲线 Fig.4 Output voltage curve of MFC with strain LR134290 as bioanode |
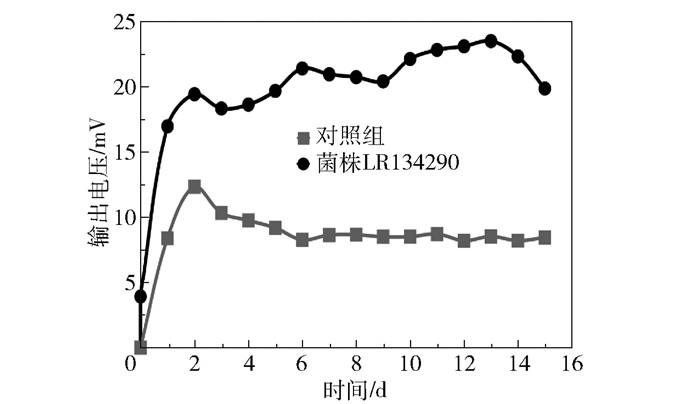
为了探究菌株LR134290作为生物阴极的可能性,将其培养于MFC阴极室中,以BG11培养基为营养底物;阳极室中的微生物为E. coli,以3 g/L葡萄糖为营养底物。对照组的阴极室中不加入菌株LR134290。分别测定菌株LR134290和对照组的MFC输出电压,结果如图 5所示。相较于对照组,菌株LR134290作为生物阴极可以显著提高MFC整体的电压输出能力;菌株LR134290的输出电压峰值为25.83 mV,相较于对照组(电压峰值为13.68 mV)提高了88.9%,经t检验,二者具有显著性差异(P < 0.001)。结果表明,菌株LR134290具备进一步研究的可行性。
|
图 5 菌株LR134290作为生物阴极的MFC输出电压曲线 Fig.5 Output voltage curve of MFC with strain LR134290 as biocathode |
为了更全面地分析菌株LR134290作为生物阴极的MFC电化学性能,采用电化学工作站测定了MFC的电压极化曲线和电功率密度曲线(图 6)以及循环伏安曲线(图 7)。由图 6可以看出,以菌株LR134290作为生物阴极的最大电功率密度为0.622 μW/cm2,相比对照组(0.492 μW/cm2)提高了26.4%;菌株LR134290作为生物阴极的电压极化曲线位于对照组曲线的右侧,在电压相同时其电流密度大于对照组。由图 7可以看出,相比于对照组,菌株LR134290的闭合伏安曲线的重合度较高,表明其MFC电化学性能较为稳定。
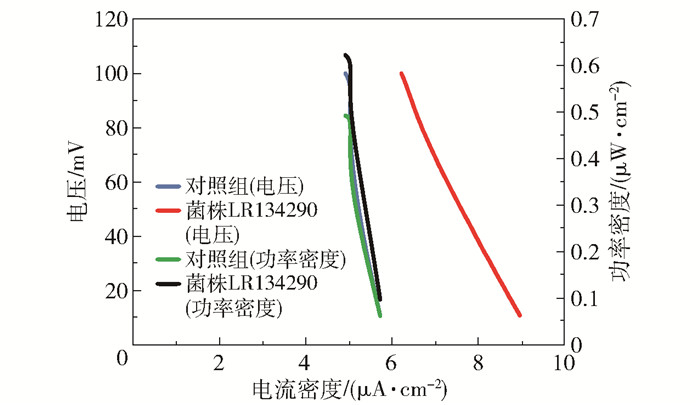
|
图 6 菌株LR134290作为生物阴极的MFC电压极化曲线和电功率密度曲线 Fig.6 Voltage polarization curve and electric power density curve of MFC with strain LR134290 as biocathode |
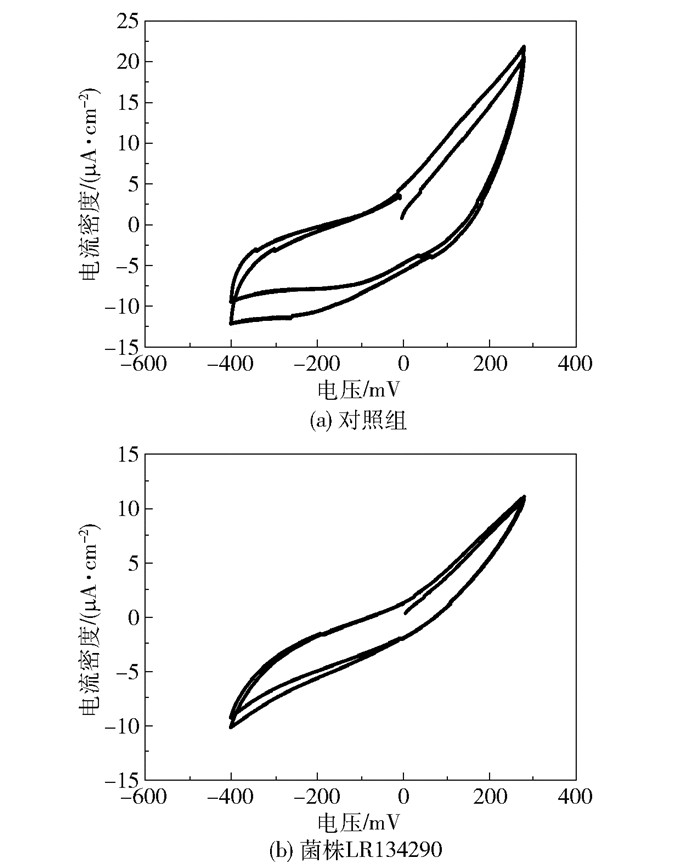
|
图 7 对照组和菌株LR134290的循环伏安曲线 Fig.7 Cyclic voltammetry curves of control group and strain LR134290 group |
MFC作为绿色能源的一个重要应用是产电微生物对废水中有机污染物的降解,其降解效率可以通过测定阳极电解液的COD来表征。表 2为培养15 d后对照组和实验组的阳极电解液COD值。可以看出,当阳极室底物(葡萄糖)的质量浓度为3 g/L时,以菌株LR134290作为生物阴极的MFC阳极电解液的COD为395.7 mg/L,与不加菌株的对照组(COD为800.3 mg/L)相比,COD值降低了50.6%,表明菌株LR134290显著提升了阳极室产电微生物消耗有机物的效率。考虑到生物阴极自身也要消耗大量有机物,因此MFC整体的有机物降解能力将会进一步提高。
| 下载CSV 表 2 阳极电解液的COD值 Table 2 COD of the anode electrolyte |
本文从自然界中筛选得到一株具有光依赖型的菌株,经鉴定为门多萨假单胞菌(LR134290)。对该菌株进行了产电性能测试,结果显示:菌株LR134290在MFC阳极室中具有一定的独立产电能力;将菌株LR134290接种在双室MFC的阴极室、大肠杆菌接种在阳极室时,与阴极室不加入菌株的对照组相比,可以显著提升MFC的产电性能,表现为输出电压、最大电功率密度以及有机物降解率大幅提高。以上结果表明,门多萨假单胞菌株LR134290作为生物阴极在MFC中具有一定的发展潜力。
| [1] |
BILEN K, OZYURT O, BAKIRCI K, et al. Energy production, consumption, and environmental pollution for sustainable development: a case study in Turkey[J]. Renewable and Sustainable Energy Reviews, 2008, 12(6): 1529-1561. DOI:10.1016/j.rser.2007.03.003 |
| [2] |
杨冰, 高海军, 张自强. 微生物燃料电池研究进展[J]. 生命科学仪器, 2007, 5(1): 3-12. YANG B, GAO H J, ZHANG Z Q. The development of microbiol fuel cells[J]. Life Science Instruments, 2007, 5(1): 3-12. (in Chinese) DOI:10.3969/j.issn.1671-7929.2007.01.001 |
| [3] |
孔晓英, 李连华, 孙永明, 等. 微生物燃料电池产能原理及输出功率的影响因素[J]. 现代化工, 2007, 27(S2): 282-284, 286. KONG X Y, LI L H, SUN Y M, et al. Fundamental study on microbial fuel cell and influent factors on output power[J]. Modern Chemical Industry, 2007, 27(S2): 282-284, 286. (in Chinese) DOI:10.16606/j.cnki.issn0253-4320.2007.s2.140 |
| [4] |
CHOI S, KIM B, CHANG I S. Tracking of Shewanella oneidensis MR-1 biofilm formation of a microbial electrochemical system via differential pulse voltammetry[J]. Bioresource Technology, 2018, 254: 357-361. DOI:10.1016/j.biortech.2018.01.047 |
| [5] |
LIU Q, YANG Y, MEI X X, et al. Response of the microbial community structure of biofilms to ferric iron in microbial fuel cells[J]. Science of the Total Environment, 2018, 631-632: 695-701. DOI:10.1016/j.scitotenv.2018.03.008 |
| [6] |
MEEHAN A, GAO H, LEWANDOWSKI Z. Energy harvesting with microbial fuel cell and power management system[J]. IEEE Transactions on Power Electronics, 2011, 26(1): 176-181. DOI:10.1109/TPEL.2010.2054114 |
| [7] |
王慧勇, 梁鹏, 黄霞, 等. 微生物燃料电池中产电微生物电子传递研究进展[J]. 环境保护科学, 2009, 35(1): 17-20, 35. WANG H Y, LIANG P, HUANG X, et al. Research progress in microbial fuel cells for electrons transfer of electricigens[J]. Environmental Protection Science, 2009, 35(1): 17-20, 35. (in Chinese) DOI:10.3969/j.issn.1004-6216.2009.01.006 |
| [8] |
GIL G C, CHANG I S, KIM B H, et al. Operational parameters affecting the performannce of a mediator-less microbial fuel cell[J]. Biosensors and Bioelectronics, 2003, 18(4): 327-334. DOI:10.1016/S0956-5663(02)00110-0 |
| [9] |
REGUERA G, NEVIN K P, NICOLL J S, et al. Biofilm and nanowire production leads to increased current in Geobacter sulfurreducens fuel cells[J]. Applied and Environmental Microbiology, 2006, 72(11): 7345-7348. DOI:10.1128/AEM.01444-06 |
| [10] |
REYES K R E, TSAI P W, TAYO L L, et al. Biodegradation of anthraquinone dyes: interactive assessment upon biodecolorization, biosorption and biotoxicity using dual-chamber microbial fuel cells (MFCs)[J]. Process Biochemistry, 2021, 101: 111-127. DOI:10.1016/j.procbio.2020.11.006 |
| [11] |
LOVLEY D R. Microbial fuel cells: novel microbial physiologies and engineering approaches[J]. Current Opinion in Biotechnology, 2006, 17(3): 327-332. DOI:10.1016/j.copbio.2006.04.006 |
| [12] |
BOND D R, LOVLEY D R. Evidence for involvement of an electron shuttle in electricity generation by Geothrix fermentans[J]. Applied and Environmental Microbiology, 2005, 71(4): 2186-2189. DOI:10.1128/AEM.71.4.2186-2189.2005 |
| [13] |
RASHID N, CUI Y F, REHMAN M S U, et al. Enhanced electricity generation by using algae biomass and activated sludge in microbial fuel cell[J]. Science of the Total Environment, 2013, 456-457: 91-94. DOI:10.1016/j.scitotenv.2013.03.067 |
| [14] |
吴义诚, 王泽杰, 傅海燕, 等. 光合细菌在微生物燃料电池中的应用研究进展[J]. 微生物学通报, 2016, 43(12): 2707-2713. WU Y C, WANG Z J, FU H Y, et al. Progress on application of photosynthetic bacteria in microbial fuel cells[J]. Microbiology China, 2016, 43(12): 2707-2713. (in Chinese) DOI:10.13344/j.microbiol.china.151060 |
| [15] |
GVTTLER J, KENNEDY S J, LUIMSTRA V M, et al. Direct electron transport as a possible mechanism of electrogenic activity across a range of benthic cyanobacteria in a photosynthetic microbial fuel cell[J]. New Zealand Journal of Botany, 2020, 58(4): 378-388. DOI:10.1080/0028825X.2020.1840401 |
| [16] |
FRADINHO J C, DOMINGOS J M B, CARVALHO G, et al. Polyhydroxyalkanoates production by a mixed photosynthetic consortium of bacteria and algae[J]. Bioresource Technology, 2013, 132: 146-153. DOI:10.1016/j.biortech.2013.01.050 |
| [17] |
RYU B G, KIM J, HAN J I, et al. Feasibility of using a microalgal-bacterial consortium for treatment of toxic coke wastewater with concomitant production of microbial lipids[J]. Bioresource Technology, 2017, 225: 58-66. DOI:10.1016/j.biortech.2016.11.029 |
| [18] |
ANDREWS J S, ROLFE S A, HUANG W E, et al. Biofilm formation in environmental bacteria is influenced by different macromolecules depending on genus and species[J]. Environmental Microbiology, 2010, 12(9): 2496-2507. DOI:10.1111/j.1462-2920.2010.02223.x |
| [19] |
DUCAT D C, AVELAR-RIVAS J A, WAY J C, et al. Rerouting carbon flux to enhance photosynthetic productivity[J]. Applied and Environmental Microbiology, 2012, 78(8): 2660-2668. DOI:10.1128/AEM.07901-11 |
| [20] |
ANGELIS S, NOVAK A C, SYDNEY E B, et al. Co-culture of microalgae, cyanobacteria, and macromycetes for exopolysaccharides production: process preliminary optimization and partial characterization[J]. Applied Biochemistry and Biotechnology, 2012, 167(5): 1092-1106. DOI:10.1007/s12010-012-9642-7 |
| [21] |
WANG M, KEELEY R, ZALIVINA N, et al. Advances in algal-prokaryotic wastewater treatment: a review of nitrogen transformations, reactor configurations and molecular tools[J]. Journal of Environmental Management, 2018, 217: 845-857. DOI:10.1016/j.jenvman.2018.04.021 |
| [22] |
WANG X, FENG Y J, LIU J, et al. Sequestration of CO2 discharged from anode by algal cathode in microbial carbon capture cells (MCCs)[J]. Biosensors and Bioelectronics, 2010, 25(12): 2639-2643. DOI:10.1016/j.bios.2010.04.036 |
| [23] |
RABAEY K, READ S T, CLAUWAERT P, et al. Cathodic oxygen reduction catalyzed by bacteria in microbial fuel cells[J]. The ISME Journal, 2008, 2: 519-527. DOI:10.1038/ismej.2008.1 |
| [24] |
杨茜, 李轩, 蒋涛阳, 等. 高盐废水生物阴极MFCs产电及脱氮性能研究[J]. 应用化工, 2020, 49(1): 22-27. YANG Q, LI X, JIANG T Y, et al. Study on electricity generation and nitrogen removal performance of bio-cathode MFCs in high-salt wastewater[J]. Applied Chemical Industry, 2020, 49(1): 22-27. (in Chinese) |
| [25] |
谢珊, 陈阳, 梁鹏, 等. 好氧生物阴极型微生物燃料电池的同时硝化和产电的研究[J]. 环境科学, 2010, 31(7): 1601-1606. XIE S, CHEN Y, LIANG P, et al. Simultaneous electricity generation and nitrification in a microbial fuel cell with aerobic biocathode[J]. Environmental Science, 2010, 31(7): 1601-1606. (in Chinese) |
| [26] |
CHO Y K, DONOHUE T J, TEJEDOR I, et al. Development of a solar-powered microbial fuel cell[J]. Journal of Applied Microbiology, 2008, 104(3): 640-650. DOI:10.1111/j.1365-2672.2007.03580.x |
| [27] |
王红波, 代学成, 张群志, 等. 采油微生物生理生化特征研究[J]. 石油钻采工艺, 2008, 30(3): 120-123. WANG H B, DAI X C, ZHANG Q Z, et al. Research on physiological biochemical characteristics of production microbes[J]. Oil Drilling & Production Technology, 2008, 30(3): 120-123. (in Chinese) |








