2. 北京化工大学 安庆研究院, 安庆 246000
2. Anqing Research Institute, Beijing University of Chemical Technology, Anqing 246000, China
发光二极管(LED)具有寿命长、能耗低、无汞蒸气和臭氧产生、环保安全、出光速度快等优点,因此以LED作为光源的光聚合技术成为目前光聚合领域的前沿发展方向[1-3]。在光聚合反应中,开发具有优秀光引发性能的光引发剂至关重要。目前,已经有多种LED光引发剂被报道,例如肟酯类[4-6]、α-羰基酸酯类[7-9]、萘醌衍生物类[10]、硫杂蒽酮(TX)类[11]及萘酰亚胺类[12-13]等。相对于传统汞灯,LED光源发射的波长(常用波长为385、395、405、455 nm)要长一些,因此开发LED光引发剂的关键是使其吸收波长能够红移至385 nm以上,并且分子中存在易于断裂、产生自由基的弱键。芳香硫化物是近年来报道的一类光引发剂[14-16],其具有特殊的共轭结构,能够通过在芳香环上进行官能团修饰来改善引发剂的引发活性,因此芳香硫化物作为光引发剂逐渐受到人们关注。Love等[17]报道了一种芳硫醇类光引发剂,该引发剂在365 nm和405 nm波长的LED光源照射下能够引发丙烯酸酯类单体聚合,并且表现出一定的抗氧阻聚能力,但其引发活性较低。Zhao等[18]报道了一类芳硫酯光引发剂,该类化合物可以在365 nm的紫外光下快速引发丙烯酸酯类单体聚合,并且能够在一定程度上提高材料的机械性能,但是在385 nm以上的LED光源照射下该类光引发剂是否可以有效引发丙烯酸酯单体聚合未被研究。本课题组报道了一类萘酰亚胺芳硫醚和萘酰亚胺苄硫醚类光引发剂,这类引发剂可以在405 nm的LED光源照射下通过C—S键的断裂生成芳基硫自由基,进而有效地引发丙烯酸酯类单体聚合,其中萘酰亚胺芳硫醚类光引发剂在太阳光下表现出优异的稳定性[19-21]。
作为最早发现的动态聚合反应,二硫键交换反应可以在低温下进行,在制备动态聚合物方面有很大的优势。芳香族二硫化物因其优异的性能在自修复体系和降低体积收缩方面受到人们关注。Zhang等[22]在光聚合二硫化物降低体积收缩的研究中发现,聚合型芳香族二硫化物不仅具有良好的降低体积收缩的能力,而且还具有较强的光引发活性,能够在光照条件下很好地引发(甲基)丙烯酸酯类单体的聚合。芳香环结构和芳环所连取代基的不同均会对二硫化合物的电子云分布、二硫键的断裂能力以及硫自由基的活性产生影响,进而影响芳香族二硫化物的光吸收性能和引发活性。因此,探究芳香族二硫化物的结构与引发性能之间的关系对于开发芳香族二硫化物类LED光引发剂是非常重要的,而目前关于这方面的研究鲜有报道。本文研究了6种芳香族二硫化物的光吸收性能、光解机制及光引发性能,探究了苯环、吡啶环、噻吩环、供电子基团及吸电子基团对光引发活性的影响,为设计和合成新型高效的芳香族二硫化物类光引发剂提供参考。
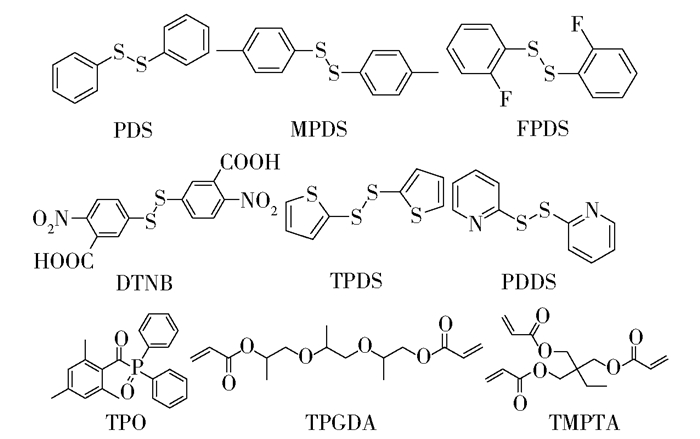
1 实验部分 1.1 实验原料和仪器 1.1.1 实验原料二苯二硫醚(PDS),分析纯,天津希恩思生化科技有限公司;2, 2′-二硫二吡啶(PDDS)、对甲苯二硫醚(MPDS)、5, 5′-二硫代双(2-硝基苯甲酸)(DTNB)、2, 4, 6-三甲基苯甲酰基-二苯基氧化膦(TPO),分析纯,安徽泽升科技有限公司;双(2-噻吩基)二硫醚(TPDS),分析纯,萨恩化学技术(上海)有限公司;2, 2′-二氟二苯二硫醚(FPDS),分析纯,上海吉至生化科技有限公司;三丙二醇二丙烯酸酯(TPGDA)、三羟甲基丙烷三丙烯酸酯(TMPTA),分析纯,天津希恩思生化科技有限公司;苯基-N-叔丁基硝酮(PBN),分析纯,上海毕得医药科技有限公司;无水乙腈,分析纯,北京化工厂。图 1为实验中所用的芳香族二硫化合物及单体的化学结构式。
|
图 1 芳香族二硫化合物及单体的化学结构式 Fig.1 Chemical structures of the aromatic disulfides and monomers |
紫外可见分光光度计,UV-3600,日本岛津公司;傅里叶变换红外光谱仪(FT-IR),Nicolet 5700,美国Thermo Electron公司;LED点光源照射机,UVEC-4II,深圳兰普里克公司;电子顺磁共振波谱仪,ELEXSYS II,德国Bruker公司。
1.2 实验方法 1.2.1 光吸收性能测试将6种芳香族二硫化物(PDS、MPDS、FPDS、DTNB、TPDS和PDDS) 分别溶解在无水乙腈中,配制成浓度为1×10-4 mol/L的标准溶液。使用紫外可见分光光度计在200~500 nm的波长范围内测试其吸光度,然后根据朗伯-比尔定律计算不同波长下芳香族二硫化物在无水乙腈中的摩尔消光系数ε。
1.2.2 光降解性能测试分别取6种芳香族二硫化物的标准溶液5 mL置于石英比色皿中,以波长为385 nm的LED点光源垂直于液面进行照射,液面的光照强度为100 mW/cm2。使用紫外可见分光光度计在不同时间测试溶液在200~500 nm波长范围内的吸光度。
1.2.3 分子理论计算采用Gaussian 09软件计算芳香族二硫化物的前线分子轨道以及C—S键和S—S键的键能,涉及的模拟计算均基于泛密度函数理论(DFT)。选用B3LYP/6-31G(d)基组优化芳香族二硫化物的基态结构,然后进行频率计算,最后确定优化后的几何结构均具有最小能量。在S—S键的键能计算过程中,所有的几何优化都是在不加任何约束下在相同的条件下进行的,同样选用B3LYP/6-31G(d)基组进行测试。所有的计算结果均由Gaussian view 5.0软件处理[23]。
1.2.4 电子顺磁共振(ESR)测试将芳香族二硫化物溶解在无水乙腈中,配制成1×10-4 mol/L的标准溶液,然后向标准溶液中加入10倍于二硫化物物质的量的PBN作为自由基捕捉剂。为了尽量消除环境中的光以及溶剂中少量的氧气对实验的影响,将样品在避光的条件下缓慢通入氮气10 min。在测试过程中使用内径为0.5 mm的玻璃毛细管吸取适量标准溶液,封端后装入内径为5 mm的石英管中,然后使用波长为385 nm的LED点光源照射10 min,使用电子顺磁共振波谱仪进行测试。
1.2.5 光聚合动力学测试以芳香族二硫化物为光引发剂,TPGDA或TMPTA为活性单体,分别配制引发剂含量为1%(质量分数)的感光液。在厚度为1 mm的KBr盐片上涂抹一层感光液,然后覆盖一层同样的KBr盐片以隔绝氧气。将样品置于原位红外光谱仪中,使用LED点光源(光照强度为100 mW/cm2)持续照射盐片300 s,于不同时间分别在385 nm和405 nm波长下测试样品的红外光谱。根据式(1)计算单体双键转化率,将双键转化率对时间作图得到双键转化率曲线,将双键转化率对时间进行微分即可得到双键转化速率曲线。
| $ R=\left(1-\frac{s_t}{s_0}\right) \times 100 \% $ | (1) |
式中:R为双键转化率,st和s0分别为照射时间为t时和未照射时双键在1 660~1 600 cm-1处的红外吸收峰积分面积。
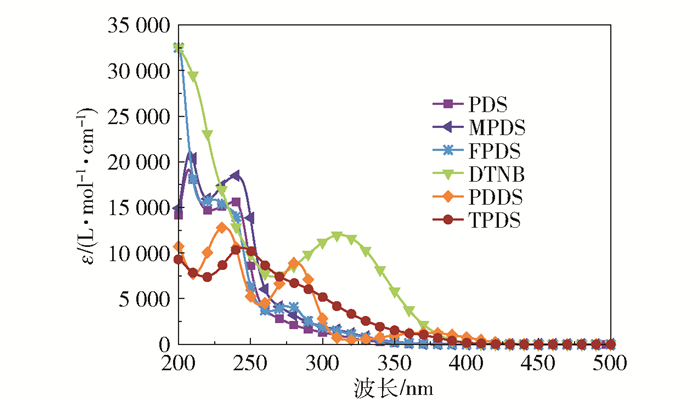
2 结果与讨论 2.1 光吸收性能图 2为不同芳香族二硫化物在无水乙腈中的紫外可见吸收光谱,表 1为不同芳香族二硫化物的最大吸收波长λmax及在特殊波长下的摩尔消光系数ε。从结果中可以看出PDS、MPDS、TPDS和PDDS的λmax均小于300 nm。PDS与MPDS的λmax分别为209 nm和210 nm,相对应的最大摩尔消光系数εmax分别为19 140 L/(mol·cm)和21 090 L/(mol·cm),甲基作为供电子基团引入到苯基二硫化物中,不仅使其最大吸收波长略微发生红移,同时也相应地提高了该类二硫化物的吸光能力。由于FPDS中氟原子和DTNB中硝基和羧基的强吸电诱导效应以及给电子共轭效应的综合影响,它们的λmax出现在200 nm,对应的摩尔消光系数分别为32 450 L/(mol·cm)和32 670 L/(mol·cm),并且DTNB在325 nm附近出现了较强的吸收峰。与苯基及取代苯基二硫化物相比,由于杂原子S和N的贡献,噻吩基二硫化合物TPDS和吡啶基二硫化合物PDDS的λmax明显发生红移,分别达到249 nm和232 nm。在常见的LED光源波长范围内(385、395、405、455 nm),6种二硫化合物的摩尔消光系数都很低,但芳杂环基二硫化合物TPDS和PDDS的摩尔消光系数总体上明显高于苯基或取代苯基二硫化物PDS、MPDS、FPDS和DTNB,这表明与苯基或取代苯基二硫化物相比,芳杂环基二硫化物在LED光源波长范围内具有更好的吸收。
|
图 2 不同芳香族二硫化物在乙腈中的紫外可见吸收光谱(c=1×10-4 mol/L) Fig.2 UV-Vis absorption spectra of different aromatic disulfides in acetonitrile (c=1×10-4 mol/L) |
| 下载CSV 表 1 不同芳香族二硫化物的最大吸收波长λmax及在特殊波长下的摩尔消光系数ε Table 1 Maximum absorption wavelengths of different aromatic disulfides and their molar extinction coefficients ε at specific wavelengths |
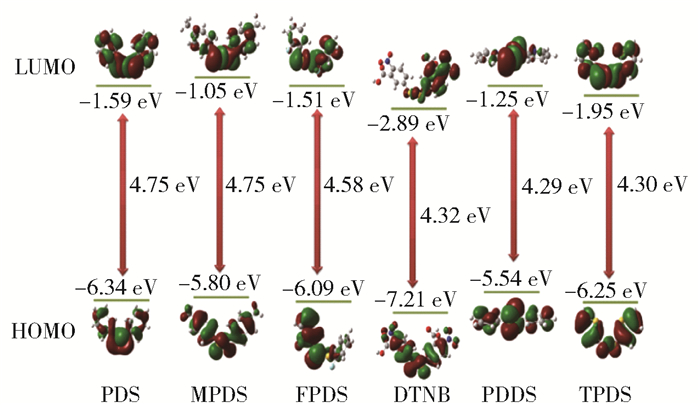
6种芳香族二硫化物的最高占据分子轨道(HOMO)和最低未占分子轨道(LUMO)示意图以及能量间隙如图 3所示。可以看出,在PDS、MPDS、PDDS和TPDS的HOMO轨道中电子均匀地分布在芳香环和硫原子上,而在LUMO轨道中电子云主要分布在硫原子上,这种现象表明在光照条件下二硫化合物从基态到达激发态时电子云流向硫原子,使得S—S键上电子云密度增大。而在FPDS和DTNB的HOMO轨道中电子分布在一侧的芳香环和硫原子上,在LUMO轨道中电子云主要集中在S—S键和另一侧芳香环上,这表明二硫化物从基态到达激发态时电子云从芳香环的一侧经S—S键转向另一侧。PDDS和TPDS的HOMO和LUMO轨道能量间隙分别为4.29 eV和4.30 eV,低于苯基或取代苯基二硫化物PDS、MPDS、FPDS、DTNB的轨道能量间隙(分别为4.75、4.75、4.58、4.32 eV)。这也进一步说明了芳杂环基的存在可以使二硫化物的最大紫外可见吸收波长发生红移[24],与紫外吸收实验结果相符合。
|
图 3 不同芳香族二硫化物的前线分子轨道及能量间隙 Fig.3 Frontier molecular orbitals and energy gaps of different aromatic disulfides |
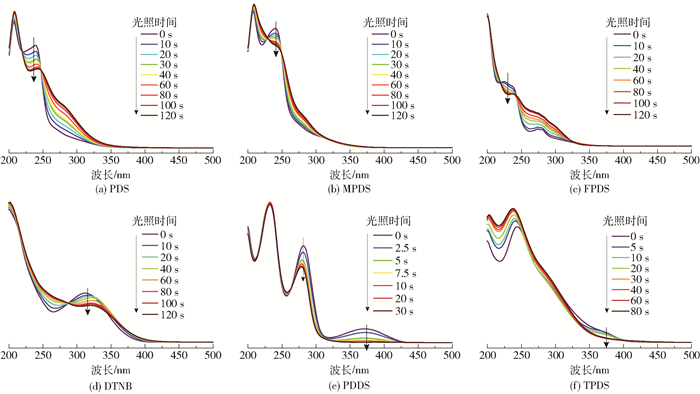
图 4为在385 nm的LED点光源照射下不同芳香族二硫化物的紫外可见吸收光谱。从图 4(a)~(d)中可以看出,随着照射时间增加,PDS、MPDS、FPDS、DTNB分别在241、239、233、315 nm处的吸收峰强度明显降低,而在降低的峰两侧均有两处吸收峰的强度有所增强,并且在持续光照120 s时基本达到稳定,这是由于在光照条件下,PDS、MPDS、FPDS和DTNB均发生了光化学反应,其结构发生了改变,生成了较多的含苯环的小分子碎片,导致其紫外可见吸收光谱发生变化。从图 4(e)中可以看出,随着照射时间增加,PDDS在281 nm和373 nm处的吸收峰明显降低,在持续照射30 s左右达到光降解平衡。图 4(f)显示随着照射时间增加,噻吩基二硫化物TPDS在373 nm处的吸收峰明显降低,且在持续光照80 s时基本达到平衡,这说明PDDS和TPDS在385 nm波长的照射下也发生了一定的光化学反应,出现了分子结构上的变化。
|
图 4 在385 nm的LED点光源照射下不同芳香族二硫化物的紫外可见吸收光谱 Fig.4 UV-Vis absorption spectra of different aromatic disulfides under a 385 nm LED light source |
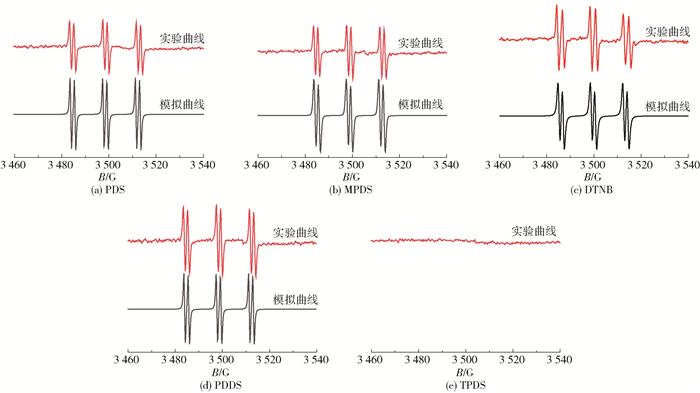
为了进一步确定芳香族二硫化物在光照射下究竟发生何种光化学反应以及能否产生自由基,本文以PBN为捕捉剂,对苯基二硫化合物PDS、带有供电基的取代苯基二硫化合物MPDS、带有吸电子基的取代苯基二硫化合物DTNB、吡啶基二硫化合物PDDS和噻吩基二硫化合物TPDS在385 nm的LED点光源照射后进行了ESR测试,结果如图 5所示。从图 5(a)~(d)可以看出,PDS、MPDS、DTNB和PDDS这4种芳香族二硫化物产生了明显的自由基信号,实验测得的曲线与芳硫自由基的拟合曲线相吻合,其超精细裂分常数分别为:aN=13.8、13.9、14.0、13.7,aH=1.8、1.9、2.2、1.7,与文献报道的结果(aN=13.8,aH=1.8)[25]基本一致,这说明它们都发生了二硫键的断裂,产生了两个芳硫自由基,如反应式(2)所示。
| $ \mathrm{R}-\mathrm{S}-\mathrm{S}-\mathrm{R} \stackrel{h v}{\rightleftharpoons} 2 \mathrm{R}-\mathrm{S}. $ | (2) |
|
图 5 在385 nm的LED点光源照射后不同芳香族二硫化物的ESR实验曲线及其拟合曲线 Fig.5 Experimental ESR spectra and simulated spectra of different aromatic disulfides after irradiation with a 385 nm LED light source |
式中,R为苯基、对甲基苯基、2-氟苯基、4-羧基-5-硝基苯基和2-吡啶基。图 5(e)显示噻吩基二硫化合物TPDS在相同的条件下持续光照时始终未检测到ESR信号,这可能是TPDS生成的芳基硫自由基太活泼或者溶剂效应的影响,导致光解过程中生成的芳基硫自由基快速恢复成S—S键,因此不能被PBN捕捉到。
此外,本文还计算了6种芳香族二硫化合物的S—S键和C—S键的键能,结果如表 2所示。从表中可以看出,二硫化物中S—S键的键能均低于C—S键的键能,这表明在光照条件下S—S键优先发生断裂。苯基或取代苯基二硫化物PDS、MPDS、FPDS、DTNB的S—S键键能分别为230.73、134.04、157.57、176.41 kJ/mol,这表明给电子基团和吸电子基团的引入都可以明显降低苯基二硫化物中S—S键的键能。而PDDS和TPDS中S—S键的键能分别为204.13 kJ/mol和97.55 kJ/mol,均低于苯基二硫化物PDS的键能,这说明芳杂环的引入同样可以降低S—S键键能,尤其是噻吩环的引入使S—S键的键能降低得更加显著。
| 下载CSV 表 2 芳香族二硫化合物中S—S键和C—S键的键能 Table 2 Bond dissociation energies of S—S and C—S bonds in the aromatic disulfides |
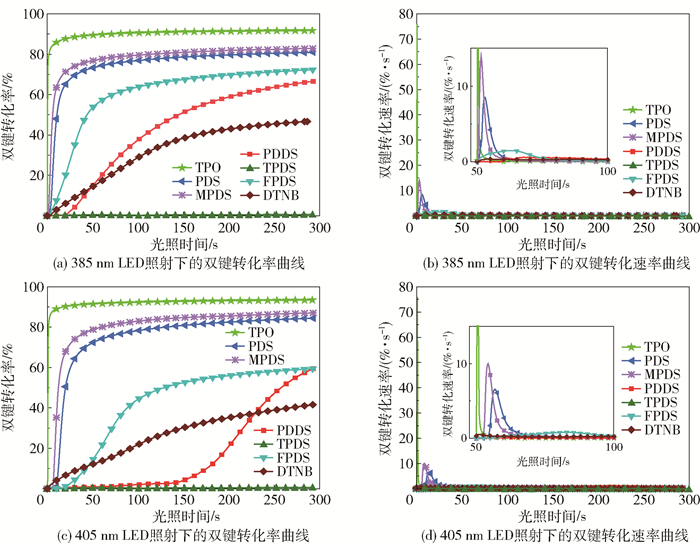
本文研究了6种芳香族二硫化合物引发活性单体TPGDA的光聚合动力学,并与商业化LED光引发剂TPO进行对比,以此来评价其光引发性能,结果如图 6所示。由图 6(a)和(b)可以看出,PDS、MPDS、FPDS、DTNB和PDDS在385 nm的LED照射下都能引发TPGDA的光聚合,并且这5种芳香族二硫化物引发的TPGDA的最终双键转化率和最大双键转化速率都低于商用光引发剂TPO(最大双键转化率为91.7%,最大双键转化速率为76.2%·s-1),表明这5种芳香族二硫化物在光照后产生的芳基硫自由基的光引发活性远低于TPO在光照后产生的芳香基酰基自由基和膦酰基自由基的引发活性。在这5种芳香二硫化物中,PDS和MPDS具有较高的光引发活性,在385 nm的LED照射300 s后,它们所引发的TPGDA体系的最终双键转化率分别达到80.4%和83.2%,最大双键转化速率分别为8.52%·s-1和13.98%·s-1。FPDS和DTNB引发的TPGDA体系的最终双键转化率较低,分别为72.3%和46.4%,最大双键转化速率分别仅为1.47%·s-1和0.29%·s-1。总体上可以发现,当苯环中含有供电子基团时,可以提高苯基二硫化合物的光引发活性,而吸电子基团会明显降低苯基二硫化物的光引发活性。吡啶基二硫化合物PDDS所引发的TPGDA体系的最终双键转化率为66.6%,最大双键转化速率仅为0.61%·s-1,且存在20 s的诱导期,这表明缺电子的六元芳杂环的引入降低了二硫化物的引发活性。值得注意的是,噻吩基二硫化合物TPDS完全未引发TPGDA的光聚合反应,TPGDA的双键转化率为0,说明TPDS没有引发活性。结合TPDS在ESR测试中始终未能捕捉到信号的现象,认为TPDS在光照条件下不能生成稳定的芳基硫自由基,二硫键断裂后更加倾向于很快恢复为S—S键。
|
图 6 在阻氧条件下不同二硫化合物引发的TPGDA光聚合动力学曲线(光照强度:100 mW/cm2,二硫化合物含量:1%) Fig.6 Kinetic curves of photopolymerization of TPGDA initiated by different disulfides in the absence of oxygen (light intensity: 100 mW/cm2, disulfide content: 1%) |
由图 6(c)和(d)可以看出在405 nm的LED照射下,除了TPDS外,其他5种芳香二硫化合物也能引发TPGDA体系聚合,其引发能力的整体趋势与385 nm波长下的趋势相似。但是在405 nm的LED照射下PDDS出现了更长的诱导期,并且PDS和MPDS也分别出现了10 s和6 s的诱导期,最终双键转化率和最大双键转化速率也略微降低。
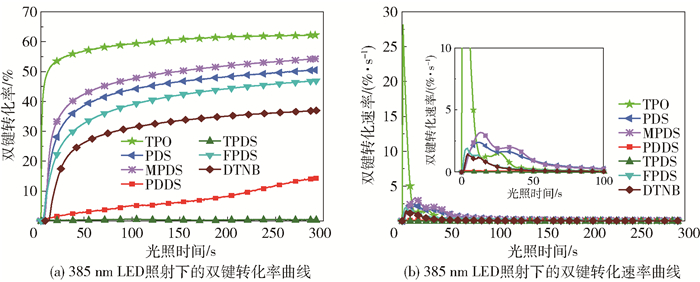
此外,本文还研究了在385 nm的LED照射下6种芳香族二硫化合物引发TMPTA的聚合动力学,结果如图 7所示。从图中可以看出,PDS、MPDS、FPDS、DTNB和PDDS在持续照射300 s后,TMPTA的双键转化率分别为50.3%、54.2%、46.7%、36.5%和14.1%,最大双键转化速率分别为2.37%·s-1、3.07%·s-1、1.91%·s-1、1.44%·s-1和0.12%·s-1,而TPDS同样不能引发TMPTA体系聚合。整体来看,这些芳香族二硫化物对TMPTA的引发能力低于商用的TPO(最终双键转化率为61%,最大双键转化速率为28.29%·s-1),6种二硫化合物在385 nm的LED辐照下引发TMPTA的活性顺序与TPGDA相似。
|
图 7 在阻氧条件下不同二硫化合物引发的TMPTA光聚合动力学曲线(光照强度:100 mW/cm2,二硫化合物含量:1%) Fig.7 Kinetic curves of photopolymerization of TMPTA initiated by different disulfides in the absence of oxygen (light intensity: 100 mW/cm2, disulfide concentration: 1%) |
(1) 6种芳香族二硫化物的最大吸收波长均小于300 nm,供电基团甲基及芳香杂环的引入均使二硫化合物的最大吸收波长红移,氟原子和硝基、羧基的吸电子诱导效应以及给电子共轭效应的综合影响使FPDS和DTNB的最大吸收波长蓝移至200 nm;与苯基或取代苯基二硫化物相比,芳杂环基二硫化物在常见的LED光源波长范围内具有更好的吸收。
(2) 在385 nm的LED照射下PDS、MPDS、DTNB和PDDS均能发生二硫键的断裂,产生芳基硫自由基;噻吩基二硫化合物TPDS不能生成稳定的芳基硫自由基,S—S键断裂后更倾向于重新结合恢复二硫键。
(3) 在385 nm的LED照射下PDS、MPDS、FPDS、DTNB和PDDS均能引发TPGDA和TMPTA聚合,在405 nm的LED照射下也能引发TPGDA聚合;给电子基团甲基可以提高苯基硫自由基的光引发活性,吸电子基团氟原子和硝基等可明显降低苯基硫自由基的光引发活性;由于TPDS不能在LED光照下产生稳定的活性自由基,因此不能引发TPGDA和TMPTA的聚合反应。
| [1] |
PENG X, ZHU D, XIAO P. Naphthoquinone derivatives: naturally derived molecules as blue-light-sensitive photoinitiators of photopolymerization[J]. European Polymer Journal, 2020, 127: 109569. DOI:10.1016/j.eurpolymj.2020.109569 |
| [2] |
QIU W W, LI M Q, YANG Y N, et al. Cleavable coumarin-based oxime esters with terminal heterocyclic moieties: photobleachable initiators for deep photocuring under visible LED light irradiation[J]. Polymer Chemistry, 2020, 11(7): 1356-1363. DOI:10.1039/C9PY01690B |
| [3] |
BRELOY L, LOSANTOS R, SAMPEDRO D, et al. Allyl amino-thioxanthone derivatives as highly efficient visible light H-donors and co-polymerizable photoinitiators[J]. Polymer Chemistry, 2020, 11(26): 4297-4312. DOI:10.1039/D0PY00551G |
| [4] |
DING Y Y, JIANG S L, GAO Y J, et al. Photochromic polymers based on fluorophenyl oxime ester photoinitiators as photoswitchable molecules[J]. Macromolecules, 2020, 53(14): 5701-5710. DOI:10.1021/acs.macromol.0c00198 |
| [5] |
CHEN S X, JIN M, MALVAL J P, et al. Substituted stilbene-based oxime esters used as highly reactive wavelength-dependent photoinitiators for LED photopolymerization[J]. Polymer Chemistry, 2019, 10(48): 6609-6621. DOI:10.1039/C9PY01330J |
| [6] |
LI Z Q, ZOU X C, ZHU G G, et al. Coumarin-based oxime-esters: photobleachable and versatile unimolecular initiators for acrylate and thiol-based click photopolymerization under visible LED light irradiation[J]. ACS Applied Materials & Interfaces, 2018, 10(18): 16113-16123. |
| [7] |
HE X L, GAO Y J, NIE J, et al. Methyl benzoylformate derivative Norrish type Ⅰ photoinitiators for deep-layer photocuring under near-UV or visible LED[J]. Macromolecules, 2021, 54(8): 3854-3864. DOI:10.1021/acs.macromol.0c02868 |
| [8] |
HE X L, JIA W, GAO Y J, et al. Water-soluble benzoylformic acid photoinitiators for water-based LED-triggered deep-layer photopolymerization[J]. European Polymer Journal, 2022, 167: 111066. DOI:10.1016/j.eurpolymj.2022.111066 |
| [9] |
PAN H Y, CHEN S Q, JIN M, et al. A substituent: para-to-ortho positioning effect drives the photoreactivity of a dibenzothiophene-based oxalate series used as LED-excitable free radical photoinitiators[J]. Polymer Chemistry, 2019, 10(13): 1599-1609. DOI:10.1039/C9PY00052F |
| [10] |
STRZELEZYK R, PODSIADLY R. Derivatives of 1, 4-naphthoquinone as visible-light-absorbing one-component photoinitiators for radical polymerisation[J]. Coloration Technology, 2015, 131(3): 229-235. DOI:10.1111/cote.12144 |
| [11] |
EREN T N, GRAFF B, LALEVEE J, et al. Thioxanthone-functionalized 1, 6-heptadiene as monomeric photoinitiator[J]. Progress in Organic Coatings, 2019, 128: 148-156. DOI:10.1016/j.porgcoat.2018.12.014 |
| [12] |
GIACOLETTO N, IBRAHIM-OUALI M, DUMUR F. Recent advances on squaraine-based photoinitiators of polymerization[J]. European Polymer Journal, 2021, 150: 110427. DOI:10.1016/j.eurpolymj.2021.110427 |
| [13] |
ZHANG J, DUMUR F, XIAO P, et al. Structure design of naphthalimide derivatives: toward versatile photoinitiators for near-UV/visible LEDs, 3D printing, and water-soluble photoinitiating systems[J]. Macromolecules, 2015, 48(7): 2054-2063. DOI:10.1021/acs.macromol.5b00201 |
| [14] |
YAO J Y, HOU H H, MA X D, et al. Combining photo-cleavable and hydrogen-abstracting groups in quinoxaline with thioether bond as hybrid photoinitiator[J]. Chinese Chemical Letters, 2017, 28(1): 6-12. DOI:10.1016/j.cclet.2016.06.008 |
| [15] |
WRZYSZCZYNSKI A, BARTOSZEWICZ J, HUG G L, et al. Photochemical studies of a photodissociative initiator based on a benzophenone derivative possessing a thioether moiety[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2003, 155(1-3): 253-259. DOI:10.1016/S1010-6030(02)00391-X |
| [16] |
KRONGAUZ V V, CHAWLA C P. Revisiting aromatic thiols effects on radical photopolymerization[J]. Polymer, 2003, 44(14): 3871-3876. DOI:10.1016/S0032-3861(03)00099-5 |
| [17] |
LOVE D M, FAIRBANKS B D, BOWMAN C N. Evaluation of aromatic thiols as photoinitiators[J]. Macromolecules, 2020, 53(13): 5237-5247. DOI:10.1021/acs.macromol.0c00757 |
| [18] |
ZHAO Z R, WANG C, LIU F, et al. Synthesis and application of new S-benzoheterocycle thiobenzoates photoinitiators[J]. Research on Chemical Intermediates, 2020, 46(7): 3717-3726. DOI:10.1007/s11164-020-04170-3 |
| [19] |
YU J, GAO Y J, JIANG S L, et al. Naphthalimide aryl sulfide derivative Norrish type Ⅰphotoinitiators with excellent stability to sunlight under near-UV LED[J]. Macromolecules, 2019, 52(4): 1707-1717. DOI:10.1021/acs.macromol.8b02309 |
| [20] |
JU X B, HU X Y, GAO Y J, et al. Two hydrogen donor-containing naphthalimide benzyl thioether photoinitiators for LED photopolymerization[J]. Progress in Organic Coatings, 2022, 162: 106562. DOI:10.1016/j.porgcoat.2021.106562 |
| [21] |
HU X Y, YU J, JIANG S L, et al. Naphthalimide derivatives containing benzyl-sulfur bond as cleavable photoinitiators for near-UV LED polymerization[J]. Journal of Sulfur Chemistry, 2020, 41(6): 616-634. DOI:10.1080/17415993.2020.1795175 |
| [22] |
ZHANG M L, JIANG S L, GAO Y J, et al. UV-nanoimprinting lithography photoresists with no photoinitiator and low polymerization shrinkage[J]. Industrial & Engineering Chemistry Research, 2020, 59(16): 7564-7574. |
| [23] |
ZHANG H Y, GUO Y R, WU Z B, et al. Unveiling the theoretical mechanism of purely organic room temperature phosphorescence emission and heteroatomic effects on singlet-triplet intersystem crossing for isopropylthioxanthone derivatives[J]. Journal of Luminescence, 2021, 232: 117864. DOI:10.1016/j.jlumin.2020.117864 |
| [24] |
BOUZRATI-ZERELLI M, KIRSCHNER J, FIK C P, et al. Silyl glyoxylates as a new class of high performance photoinitiators: blue LED induced polymerization of methacrylates in thin and thick films[J]. Macromolecules, 2017, 50(17): 6911-6923. DOI:10.1021/acs.macromol.7b01370 |
| [25] |
BUETTNER G R. Spin trapping: ESR parameters of spin adducts[J]. Free Radical Biology and Medicine, 1987, 3(4): 259-303. DOI:10.1016/S0891-5849(87)80033-3 |








