2. 北京化工大学 软物质科学与工程高精尖创新中心, 北京 100029;
3. 北京化工大学 高新技术研究院, 北京 100029;
4. 北京化工大学 有机无机复合材料国家重点实验室, 北京 100029
2. Beijing Advanced Innovation Center for Soft Matter Science and Engineering, Beijing University of Chemical Technology, Beijing 100029, China;
3. High-Tech Research Institute, Beijing University of Chemical Technology, Beijing 100029, China;
4. State Key Laboratory of Organic-Inorganic Composites, Beijing University of Chemical Technology, Beijing 100029, China
微针是由1根或多根高度不超过1 mm的尖锐针体集成在基板上的给药系统[1]。相比于传统给药方式,微针给药具有以下优点[2-3]:(1)可避免口服给药带来的首过效应;(2)可克服角质层的屏障作用,给药时在皮下留下微孔道,增加了皮肤的渗透性,提高了给药效率;(3)由于微针高度为微米级,在刺入皮下时不会触及神经系统,因此给药时不会产生疼痛,患者的依从性较好;(4)操作简单,不需要专业人员给药,患者可自行在家使用;(5)可减少注射给药带来的医疗垃圾。
根据设计形式和给药方式的不同,微针可以分为5类:固体微针[4-6]、可溶微针[7]、涂层微针[8]、中空微针[9-10]和溶胀微针[11]。其中,涂层微针是在固体微针表面上涂覆一层药物,由于有固体微针的支撑,涂层微针的力学性能较好。此外,涂层微针所递送的药物范围广泛,从小分子到蛋白质、DNA、病毒、疫苗,甚至微米粒子都可以涂覆在固体微针表面[12-14]。目前,制备涂层微针的方法有喷墨打印法[15]、喷涂法[16]和浸渍法[17]。喷墨打印和喷涂法需要额外的辅助设备,并且为了达到足够的载药量,需要进行多次涂层,大大增加了时间成本,不利于批量化生产。浸渍法的操作简单,成本较低,常被用来制备涂层微针。由于皮肤具有弹性,涂层微针底板及靠近底板的涂层溶液不能进入皮下进行给药,因此,为了避免药物浪费,通常使用掩膜浸渍法[18]和薄膜浸渍法[1]进行涂覆,在制备过程中,微针底板不会接触到涂层溶液,从而达到理想的涂覆效果。但是在掩膜浸渍法中,由于掩膜孔必须与微针一一对应,因此对精准定位的要求较高,定位过程中针尖容易受损。另外,使用浸渍法制备涂层微针时,药量精准控制、载药均一性及批量化生产仍是商业化的瓶颈。
为了避免在掩膜浸渍法制备涂层微针的过程中针尖受损以及提高涂层微针的载药均一性,本文以生物相容性和生物可降解性优良的聚乳酸(PLA)作为基质材料,采用热压法制备了带有4个限位大针的聚乳酸固体微针,限位针的存在可以起到保护微针针尖的作用;利用限位板隔绝微针底板与涂层溶液直接接触,分别采用翻转浸渍法和漂浮浸渍法制备了涂层溶液距离底板300 μm左右的涂层聚乳酸微针,测试了其力学性能、载药量及载药均一性。
1 实验部分 1.1 实验材料与仪器 1.1.1 实验材料磺酰罗丹明B(生物染色剂),Sigma-Aldrich公司;聚乳酸颗粒,分子量为50~60 kDa,Lakeshore生物材料有限公司;聚乙烯醇(PVA),平均分子量为9 000~10 000,Sigma-Aldrich公司;蔗糖(纯度>99%)、聚二甲基硅氧烷(PDMS),美国道康宁公司;二氧化硅颗粒,粒径30~50 nm,北京伊诺凯科技有限公司;1H, 1H, 2H, 2H-全氟辛基三乙氧基硅烷(纯度98%),Sigma-Aldrich公司;无水乙醇,分析纯,福晨(天津)化学试剂有限公司;猪皮,购自当地某屠宰场。
1.1.2 实验仪器BXXW-30AL型超声波清洗机,北京博翔兴旺有限公司;VLS3.5型激光雕刻机,美国Universal公司;DZF-6050型真空干燥箱,北京陆希科技有限公司;带有荧光场的SZX7型光学显微镜,日本OLYMPUS公司;ESM301型测力计,美国Mark-10公司;EnSpireTM型酶标仪,美国PerkinElmer公司。
1.2 聚乳酸微针的制备采用热压法制备聚乳酸微针。将PDMS中的预聚物与固化剂按质量比10:1混合均匀,在真空干燥箱中除去气泡。将混合物倒入定制模具中,于60 ℃固化5 h,得到厚度均一的PDMS模板。然后通过调节激光雕刻机的激光功率和速度雕刻出所需的微针模板。将聚乳酸颗粒平铺在PDMS模板上,在真空干燥箱中于200 ℃加热30 min,取出热压,冷却脱模后得到聚乳酸微针,在光学显微镜下观察制备的微针。
1.3 限位板的制备使用CAD软件(2007版)绘制出所需限位板规格。限位板选用聚甲醛材质,使用激光雕刻机对限位板进行刻蚀,限位板的孔与聚乳酸微针一一对应。
1.4 涂层溶液的配制将4 g PVA加入到10 mL超纯水中,于90 ℃搅拌至完全溶解。冷却后,加入5 g蔗糖,搅拌至完全溶解,加入100 mg磺酰罗丹明B,搅拌混合均匀,制得涂层溶液。
1.5 涂层聚乳酸微针的制备 1.5.1 翻转浸渍法将制备的涂层溶液装入玻璃样品瓶中,限位板放置在瓶口处,将微针装配到限位板内。将瓶翻转180°,待涂层溶液接触到微针时开始计时,分别静置10 s、20 s和30 s,制得涂层聚乳酸微针,于真空干燥箱中保存,在光学显微镜下观察制备的涂层微针。
1.5.2 漂浮浸渍法图 1为漂浮浸渍法制备涂层聚乳酸微针的示意图。将限位板与微针装配在一起,固定在可上下移动的支架上。支架匀速下降,微针随限位板下降至接触涂层溶液,此时固定限位板的绳子呈松弛状态,限位板漂浮在涂层溶液上,维持10 s后支架向上移动,采用光学显微镜观察制备的涂层微针。
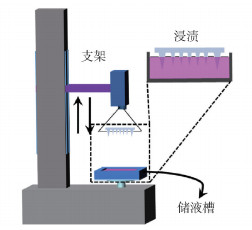
|
图 1 漂浮浸渍法制备涂层聚乳酸微针示意图 Fig.1 Schematic diagram of the preparation of coated polylactic acid microneedles by the floating dipping method |
将3%(质量分数)纳米SiO2颗粒与1%(质量分数)1H, 1H, 2H, 2H-全氟辛基三乙氧基硅烷混合,向其中加入96%(质量分数)的乙醇,混合均匀,制得超疏水溶液。将限位板浸泡在超疏水溶液中,10 min后取出,室温下干燥后备用。
1.7 涂层聚乳酸微针的力学性能测试使用测力计测定微针的力学性能。分别将聚乳酸微针和涂层聚乳酸微针固定在可上下移动的不锈钢板上,钢板连接传感器,可以感知力的大小与位移。不锈钢板以10 mm/min的速度向下移动,微针接触到下侧不锈钢板时开始记录位移与力的关系,到达预设力20 N后停止移动。
随后,观察涂层聚乳酸微针在猪皮表面的刺入情况和药物分布情况。对猪皮进行预处理,用剃须刀脱毛,酒精清理表面油脂,待用。将干燥后的涂层微针垂直刺入猪皮2 min后取下,通过光学显微镜观察微针的刺入情况。为了更直观地观察药物在猪皮内部的分布,将猪皮侧切后使用光学显微镜观察。
1.8 涂层聚乳酸微针的载药量测定采用磺酰罗丹明B作为模型药物。选用二倍稀释法配制质量浓度ρ为1 mg/mL~1.19×10-7 mg/mL的系列磺酰罗丹明B溶液。取不同浓度的磺酰罗丹明B溶液100 μL,转移至96孔板内,采用酶标仪测定其荧光强度I(激发波长为485 nm,发射波长为538 nm),以lgρ为横坐标,lgI为纵坐标,绘制标准曲线。使用漂浮浸渍法制备涂层聚乳酸微针,将其在500 μL超纯水中充分溶解,使用酶标仪测定荧光强度,通过标准曲线计算磺酰罗丹明B的质量浓度,进而得到涂层微针的载药量。
2 结果与讨论 2.1 光学显微镜观察结果 2.1.1 聚乳酸微针和限位板图 2(a)为带有限位针的聚乳酸微针的光学显微镜图,微针的阵列为5×5,高度为650 μm,针尖与针尖的间距为1 000 μm,底部直径为300 μm,微针周围有4个限位大针,可以起到保护微针不受损坏的作用。图 2(b)为限位板的实物图,由于皮肤具有弹性,微针在刺入皮肤的过程中,靠近微针底板处约200~300 μm高度的微针不能刺入皮下[8],因此本文选用的限位板厚度为300 μm。
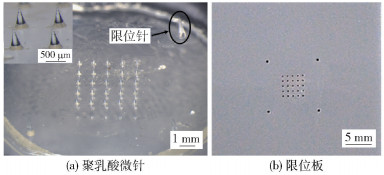
|
图 2 聚乳酸微针的光学显微镜图以及限位板的实物图 Fig.2 Optical microscope image of the polylactic acid microneedles and a physical image of the limiting plate |
涂层溶液中含有PVA和蔗糖,其中PVA可以增加涂层溶液的黏性,使药物更好地涂覆在聚乳酸固体微针的表面;蔗糖也具有增黏作用,同时还能起到保护药物、维持药物稳定性的作用。
为了更直观地观察涂层情况,本文采用深红色的磺酰罗丹明B作为模型药物。使用翻转浸渍法分别静置10 s、20 s、30 s制备涂层聚乳酸微针,通过光学显微镜观察,结果如图 3所示。可以看出,微针表面的载药量较为均一,随着静置时间增加,载药量变化不明显,表明静置10 s完全可以达到制备涂层聚乳酸微针的要求。此外,涂层溶液与微针底板间的距离也较均一,约为300 μm。

|
图 3 使用翻转浸渍法分别静置10 s、20 s、30 s制备的涂层聚乳酸微针 Fig.3 Coated polylactic acid microneedles prepared by standing for 10 s, 20 s, and 30 s, respectively, using a flip dipping method |
使用漂浮浸渍法制备涂层聚乳酸微针,通过光学显微镜观察,结果如图 4所示。涂层微针的涂层分布均匀,涂层距离微针底板约300 μm,与限位板的厚度一致。

|
图 4 使用漂浮浸渍法制备的涂层聚乳酸微针 Fig.4 Coated polylactic acid microneedles prepared by a floating dipping method |
在翻转浸渍法制备涂层聚乳酸微针的过程中,限位板背面黏附有较多的涂层溶液,为了避免药物浪费,本文考察了未经处理的限位板的重复使用情况,并通过光学显微镜观察使用限位板制备的涂层微针,结果如图 5所示。第1次使用时,限位板无涂层溶液渗透情况,所制备的微针涂层分布均匀;限位板第2次使用时,制备的涂层微针有少数拉丝现象;限位板第3次重复使用时,涂层溶液已渗透到限位板背面,微针底板完全被涂层溶液浸渍。因此,未经处理的限位板不能重复使用。

|
图 5 未经处理的限位板的重复使用情况(俯视图)以及制备的涂层微针 Fig.5 Reuse of the untreated limiting plate (top view) and prepared coated microneedles |
由于未经处理的限位板不能重复使用,造成大量涂层溶液的浪费。为了避免此情况发生,将限位板浸渍在超疏水溶液中,形成超疏水表面,比较了未处理的限位板和超疏水限位板的使用情况以及所制备的涂层微针,结果如图 6所示。分别将未处理的限位板和超疏水限位板浸渍在涂层溶液中(图 6(b)和6(f)),取出后,未处理的限位板上有大量的溶液残留(图 6(c)),而超疏水限位板上几乎无涂层溶液残留(图 6(g)),避免了涂层溶液的浪费。与未处理的限位板制备的涂层微针(图 6(d))相比,超疏水限位板制备的涂层微针的涂层距离微针底板较远(图 6(h)),这可能是超疏水溶液在限位板孔内有部分残留所致。

|
图 6 未处理的限位板和超疏水限位板的使用情况以及所制备的涂层微针 Fig.6 Use of the untreated limiting plate and the superhydrophobic limiting plate and the resulting coated microneedles |
为了评估制备的聚乳酸微针的力学性能,将微针固定在测力计上,测量力与位移的关系,结果如图 7所示。聚乳酸微针和涂层聚乳酸微针的力学位移曲线基本重合,表明涂层几乎不影响微针的力学性能。当位移为300 μm时,单根针受力可达1 N左右。有研究[19]表明,单根针的刺入力为0.03 N时,微针可全部刺入猪皮皮下。因此,本实验制备的涂层聚乳酸微针有足够的机械性能刺入皮下。
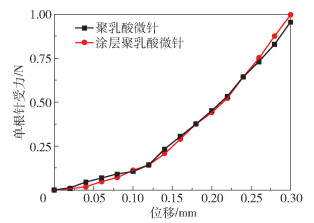
|
图 7 聚乳酸微针和涂层聚乳酸微针的力学位移曲线 Fig.7 Mechanical displacement curves of the polylactic acid microneedles and the coated polylactic acid microneedles |
通过光学显微镜观察力学性能测试前后聚乳酸微针和涂层聚乳酸微针的形貌变化,结果如图 8所示。力学性能测试后,聚乳酸微针和涂层聚乳酸微针均没有断裂,表明微针能够刺入皮下并且无断裂风险,安全性较好。

|
图 8 力学性能测试前后聚乳酸微针和涂层聚乳酸微针的形貌变化 Fig.8 Morphology changes of the polylactic acid microneedles and the coated polylactic acid microneedles before and after mechanical property tests |
将涂层聚乳酸微针刺入经预处理的猪皮2 min后移除,通过光学显微镜观察猪皮表面涂层微针的刺入情况,然后将猪皮侧切后观察药物的分布情况,结果如图 9所示。由图 9(a)和(b)可以看出,猪皮表面存在清晰的红点,与涂层微针一一对应,说明涂层微针具有足够的力学性能可以全部刺入皮下;从图 9(c)和(d)中可以看出,药物主要分布在猪皮下约300 μm处。

|
图 9 涂层聚乳酸微针刺入猪皮后猪皮表面及侧切面的光学显微镜图及荧光图 Fig.9 Optical microscope images and fluorescence images of the pig skin surface and lateral section after the coated polylactic acid microneedles penetrated into the pig skin |
图 10为磺酰罗丹明B的标准曲线,标准曲线方程为lgI=6.77+lgρ,决定系数R2=0.999,结果表明,在3.9×10-3~1.53×10-5 mg/mL的范围内,lgρ与lgI的线性关系良好。使用漂浮浸渍法制备了6片涂层聚乳酸微针,测定单根微针的载药量及相对标准偏差(RSD),结果如表 1所示。单根微针的平均载药量为15.54 ng,RSD为11.67%,与本课题组之前使用限位装置制备的涂层高分子微针的载药量(15~16 ng)[18]一致,但载药均一性有所提高(RSD由12.3%减小至11.67%)。
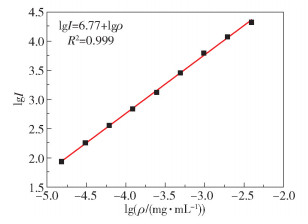
|
图 10 磺酰罗丹明B的标准曲线 Fig.10 Standard curve of sulfonyl rhodamine B |
| 下载CSV 表 1 涂层聚乳酸微针的载药量及相对标准偏差 Table 1 Drug loading and relative standard deviation of the coated polylactic acid microneedles |
本文用热压法制备了带有4个限位大针的聚乳酸微针,通过限位板的隔绝作用以及限位大针的定位和保护作用,分别采用翻转浸渍法和漂浮浸渍法成功制备了涂层聚乳酸微针,涂层溶液距离微针底板约300 μm,可有效避免药物的浪费;力学性能测试结果表明,涂层溶液的存在不会影响微针的力学性能,制备的涂层聚乳酸微针能够刺入皮下并且无断裂;涂层聚乳酸微针的单根针载药量约为15 ng,相对标准偏差为11.67%,与本课题组之前使用限位板制备的涂层高分子微针相比,其载药均一性有所提高。此外,本文还制备了超疏水限位板,在其表面浸渍涂层溶液后几乎无溶液残留,解决了涂层溶液浪费的问题。
| [1] |
INGROLE R S J, GILL H S. Microneedle coating methods: a review with a perspective[J]. Journal of Pharmacology and Experimental Therapeutics, 2019, 370(3): 555-569. DOI:10.1124/jpet.119.258707 |
| [2] |
陈博智. 高分子微针用于皮下药物控释的研究[D]. 北京: 北京化工大学, 2021. CHEN B Z. Polymer microneedles for controlled transdermal drug delivery[D]. Beijing: Beijing University of Chemical Technology, 2021. (in Chinese) |
| [3] |
WANG Q L, REN J W, CHEN B Z, et al. Effect of humidity on mechanical properties of dissolving microneedles for transdermal drug delivery[J]. Journal of Industrial and Engineering Chemistry, 2018, 59: 251-258. DOI:10.1016/j.jiec.2017.10.030 |
| [4] |
CHEN B Z, ZHANG L Q, XIA Y Y, et al. A basal-bolus insulin regimen integrated microneedle patch for intraday postprandial glucose control[J]. Science Advances, 2020, 6(28): eaba7260. DOI:10.1126/sciadv.aba7260 |
| [5] |
EVENS T, CASTAGNE S, SEVENO D, et al. Comparing the replication fidelity of solid microneedles using injection compression moulding and conventional injection moulding[J]. Micromachines, 2022, 13(8): 1280. DOI:10.3390/mi13081280 |
| [6] |
LI Q Y, ZHANG J N, CHEN B Z, et al. A solid polymer microneedle patch pretreatment enhances the permeation of drug molecules into the skin[J]. RSC Advances, 2017, 7(25): 15408-15415. DOI:10.1039/C6RA26759A |
| [7] |
LIU J L, FENG Y H, ZHANG X P, et al. Experimental and theoretical studies of drug-polymer interactions to control the drug distributions in dissolving microneedles[J]. Journal of Industrial and Engineering Chemistry, 2020, 84: 280-289. DOI:10.1016/j.jiec.2020.01.009 |
| [8] |
CHEN Y, CHEN B Z, WANG Q L, et al. Fabrication of coated polymer microneedles for transdermal drug delivery[J]. Journal of Controlled Release, 2017, 265: 14-21. DOI:10.1016/j.jconrel.2017.03.383 |
| [9] |
ABD-EL-AZIM H, TEKKO I A, ALI A, et al. Hollow microneedle assisted intradermal delivery of hypericin lipid nanocapsules with light enabled photodynamic therapy against skin cancer[J]. Journal of Controlled Release, 2022, 348: 849-869. DOI:10.1016/j.jconrel.2022.06.027 |
| [10] |
PARRILLA M, DETAMORNRAT U, DOMÍNGUEZ-ROBLES J, et al. Wearable hollow microneedle sensing patches for the transdermal electrochemical monitoring of glucose[J]. Talanta, 2022, 249: 123695. DOI:10.1016/j.talanta.2022.123695 |
| [11] |
HE R Y, NIU Y, LI Z D, et al. A hydrogel microneedle patch for point-of-care testing based on skin interstitial fluid[J]. Advanced Healthcare Materials, 2020, 9(4): 1901201. DOI:10.1002/adhm.201901201 |
| [12] |
SHAN J Y, ZHANG X X, KONG B, et al. Coordination polymer nanozymes-integrated colorimetric microneedle patches for intelligent wound infection management[J]. Chemical Engineering Journal, 2022, 444: 136640. DOI:10.1016/j.cej.2022.136640 |
| [13] |
DHARADHAR S, MAJUMDAR A, DHOBLE S, et al. Microneedles for transdermal drug delivery: a systematic review[J]. Drug Development and Industrial Pharmacy, 2019, 45(2): 188-201. DOI:10.1080/03639045.2018.1539497 |
| [14] |
CHEN B Z, HE M C, ZHANG X P, et al. A novel method for fabrication of coated microneedles with homogeneous and controllable drug dosage for transdermal drug delivery[J/OL]. Drug Delivery and Translational Research. [2022-02-06]. https://doi.org/10.1007/s13346-022-01123-8.
|
| [15] |
UDDIN M J, SCOUTARIS N, KLEPETSANIS P, et al. Inkjet printing of transdermal microneedles for the delivery of anticancer agents[J]. International Journal of Pharmaceutics, 2015, 494(2): 593-602. DOI:10.1016/j.ijpharm.2015.01.038 |
| [16] |
LI X F, XU Q N, WANG J, et al. A gene-coated microneedle patch based on industrialized ultrasonic spray-ing technology with a polycation vector to improve antitumor efficacy[J]. Journal of Materials Chemistry B, 2021, 9(27): 5528-5536. DOI:10.1039/D1TB00512J |
| [17] |
BAEK S H, SHIN J H, KIM Y C. Drug-coated microneedles for rapid and painless local anesthesia[J]. Biomedi-cal Microdevices, 2017, 19(1): 2. DOI:10.1007/s10544-016-0144-1 |
| [18] |
LIANG L, CHEN Y, ZHANG B L, et al. Optimization of dip-coating methods for the fabrication of coated microneedles for drug delivery[J]. Journal of Drug Delivery Science and Technology, 2020, 55: 101464. DOI:10.1016/j.jddst.2019.101464 |
| [19] |
DONNELLY R F, SINGH T R R, GARLAND M J, et al. Hydrogel-forming microneedle arrays for enhanced transdermal drug delivery[J]. Advanced Functional Materials, 2012, 22(23): 4879-4890. DOI:10.1002/adfm.201200864 |








