磷酸奥司他韦(oseltamivir phosphate, OP),化学式为C16H28N2O4 ·H3PO4,是一种神经氨酸酶抑制剂,用于预防和治疗甲型、乙型流感[1]。中国流行性感冒诊疗方案推荐其作为流感抗病毒治疗的首选药物。同时,OP也被视为抑制COVID-19病毒的潜在药物[2]。
流感病毒进入人体后,必须与仅存在于呼吸道的唾液酸受体结合,因此呼吸道是流感病毒的主要攻击目标[3]。由于呼吸道感染是绝大多数病毒性疾病最常见的传播途径,因此将抗病毒药物经呼吸道直接递送至肺部能够提高药物的靶向性和生物利用度。Valiulin等[4]将triazavirin超声雾化形成气溶胶,直接递送至小鼠肺部,其生物利用度达到85%,是原口服剂型的4倍。Sahakijpijarn等[5]制备了瑞德西韦(remdesivir)干粉吸入剂,在吸入后20 h,药物浓度仍超过半最大效应浓度(EC50),可持续发挥药效。此外,还有研究表明肝素[6]、类固醇类药物[7]等通过吸入给药的方式也可以发挥抗病毒作用。
目前,OP的主要剂型是口服胶囊和混悬液,不良反应有恶心、呕吐、腹泻以及头晕、头痛、疲劳、失眠等[8]。如果以吸入剂的形式将OP递送至肺部,与流感病毒直接产生作用,则很可能取得比传统口服制剂更好的抗病毒效果,并且在一定程度上降低副作用的发生率。Tang等[9]采用脂质体包裹OP制备了干粉吸入剂,但脂质体的包封过程较为复杂,且制得的干粉吸入剂的体外肺部细微粒子沉积率(fine particle fraction, FPF)为35.40%,沉积效果有待提高。邹佳辉等[10]将OP与亮氨酸、甘露醇相结合,采用喷雾干燥法制备了干粉吸入剂,其FPF为(36.2±2.8)%,体外肺部沉积效果一般,且制剂中OP含量较低,仅为20%(质量分数)。Aziz等[11]将OP分别与不同糖类(海藻糖、甘露醇、葡萄糖)相结合,通过研磨制备干粉吸入剂,其FPF均大于70%,尽管该制剂的体外肺部沉积效果较佳,但并未对研磨过程中可能出现的药物不均一现象进行探究。
乳铁蛋白是一种铁结合糖蛋白,对多种革兰氏阳性菌和阴性菌均有抑制效果,其中包括可能引起肺炎的金黄色葡萄球菌(Staphylococcus aureus)[12],因此乳铁蛋白可降低由病毒感染导致肺炎发生的可能性。将磷酸奥司他韦和乳铁蛋白联合使用,可以发挥抗病毒和抗菌的双重疗效,从而更有利于流感的治疗。本文采用喷雾干燥法制备了磷酸奥司他韦-乳铁蛋白干粉吸入剂,通过正交试验对制剂配方及喷雾干燥工艺参数进行了优化;考察了在优化条件下制备的干粉吸入剂对正常人肺泡上皮细胞(HPAEpiC)的毒性以及对金黄色葡萄球菌的抑制作用。本文结果可以为磷酸奥司他韦肺部递送的相关研究提供参考。
1 实验部分 1.1 实验材料磷酸奥司他韦原料药(纯度≥98%),博瑞生物医药(苏州)股份有限公司;磷酸奥司他韦标准品(纯度≥99%)、甘露醇(纯度98%)、甲醇(纯度≥99.9%,色谱级)、乙腈(纯度≥99.9%,色谱级),上海阿拉丁生化科技股份有限公司;乳铁蛋白(纯度95%),上海源叶生物科技有限公司;L-亮氨酸(纯度99%)、磷酸二氢钾(纯度≥99.5%,色谱级),上海麦克林生化科技有限公司;羟丙基甲基纤维素(HPMC)胶囊(3号),苏州胶囊有限公司。
人肺泡上皮细胞(HPAEpiC),25 cm2,北纳生物科技有限公司;CCK-8试剂盒,500T,日本同仁化学研究所;金黄色葡萄球菌ATCC12600,中国普通微生物菌种保藏管理中心(CGMCC);1640基础培养基(500 mL),美国HyClone公司;双抗(青霉素+链霉素)(100 mL)、胎牛血清(FBS)(500 mL),美国Gibco公司;酵母提取物、胰蛋白胨,英国Oxoid公司;氯化钠(分析纯),福晨(天津)化学试剂有限公司;琼脂,BioRoYee公司。
1.2 干粉吸入剂的制备称取500 mg磷酸奥司他韦、50 mg乳铁蛋白、300 mg辅料(L-亮氨酸和甘露醇),溶解于一定体积的纯水中。用0.45 μm滤膜过滤,将过滤后的溶液用喷雾干燥器(B-290,瑞士Büchi公司)喷干,收集所得干粉,即为干粉吸入剂。
1.3 磷酸奥司他韦含量测定采用高效液相色谱法(HPLC)检测OP含量。以水-甲醇-乙腈(体积比620 ∶245 ∶135)作为溶剂,将OP标准品及待测样品溶解,经0.22 μm滤膜过滤,得到待测溶液。检测仪器为Waters 2695-2489型高效液相色谱仪(美国Waters公司),色谱柱为Waters-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.05 mol/L磷酸二氢钾溶液(用1 mol/L氢氧化钾溶液调节pH值至6.0)-甲醇-乙腈(体积比为620 ∶245 ∶135),流速1.2 mL/min,检测波长207 nm,柱温50 ℃,进样体积15 μL。
配制10~1 000 μg/mL的OP标准溶液,进行HPLC检测。以OP的质量浓度X为横坐标,色谱峰面积Y为纵坐标,绘制标准曲线。得到的回归方程为:Y=17 992.0X+12 583.8,相关系数R2=0.999 99, 结果表明,在配制浓度范围内,Y与X之间的线性关系良好,可以利用该回归方程测定OP含量。
1.4 干粉吸入剂的质量评价 1.4.1 微观形貌和几何粒径使用扫描电子显微镜(SEM)(JSM-7800F,日本JEOL公司)观察样品的微观形貌。将少量样品粘贴在样品台的导电胶上,喷金,观察干粉吸入剂颗粒的表面形貌、团聚情况,并使用Nanomeasure软件测量颗粒的几何粒径。
1.4.2 收率按照式(1)计算收率y。
| $ y=\frac{m_{\mathrm{i}}}{m_{\mathrm{r}}} \times 100 \% $ | (1) |
式中:mi为所制备的磷酸奥司他韦-乳铁蛋白干粉吸入剂的质量,mr为原料总质量。
1.4.3 密度及流动性取5 mL量筒,称其质量为m0。向其中缓缓倾倒干粉吸入剂至一定体积V1,称量总质量为m1。然后对量筒轻加震荡,直至量筒中干粉吸入剂的体积不再发生变化,记录此时粉末的体积为V2。分别按照式(2)和(3)计算堆积密度ρb和振实密度ρt。
| $ \rho_{\mathrm{b}}=\frac{m_{1}-m_{0}}{V_{1}} $ | (2) |
| $ \rho_{\mathrm{t}}=\frac{m_{1}-m_{0}}{V_{2}} $ | (3) |
卡尔指数(Carr’s index)用于表征干粉吸入剂的流动性,其计算公式如式(4)所示。卡尔指数越小,粉末的流动性越好。一般认为,当卡尔指数小于20%时,粉末具有很好的流动性。
| $ I=\frac{\rho_{\mathrm{t}}-\rho_{\mathrm{b}}}{\rho_{\mathrm{t}}} \times 100 \% $ | (4) |
式中:I为卡尔指数。
1.4.4 晶型采用X射线衍射仪(XRD)(2500VB2+PC,日本理学株式会社)测定样品的晶型。将约20 mg干粉吸入剂轻轻倒入样品槽中,用盖玻片压平。在电压20 kV、电流2 mA的条件下,以10(°)/min的速度在3°~90°的范围内进行扫描,检测在各角度下粉末的吸收强度。
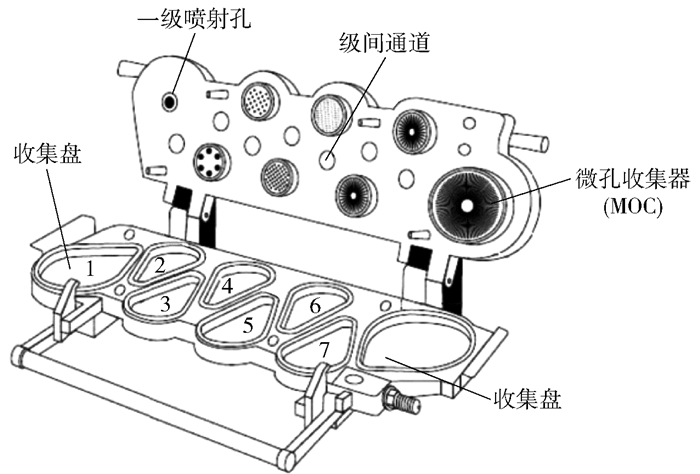
1.5 体外肺部细微粒子沉积率的测定采用新一代药用撞击器(NGI)[13-14](英国Copley Scientific公司)测定干粉吸入剂的体外肺部沉积情况,其内部结构如图 1[15]所示。称取约25 mg干粉吸入剂填充至3号HPMC胶囊中。实验选取的流速为39 L/min,与人体的正常吸入流速类似。干粉吸入剂经吸入装置进入NGI,并按照空气动力学直径(Da)由大到小的顺序被截留在各级收集盘上。在此流速下,各级收集盘的截至Da分别为:10.17 μm(1级)、5.58 μm(2级)、3.50 μm(3级)、2.03 μm(4级)、1.18 μm(5级)、0.71 μm(6级)、0.45 μm(7级)、0 μm(MOC级)。选取的吸入体积为4 L,计算出单次吸入时间约为6.2 s。每次实验吸入胶囊3粒(共75 mg),与目前OP胶囊的单次服用剂量相同。使用Breezhaler吸入器(NeohalerTM,诺华生物医学研究有限公司)作为吸入装置进行测试,其余操作均按照《中华人民共和国药典(2020年版)第四部》[14]进行。
测试结束后,分别收集胶囊、吸入装置、NGI模拟喉部及各级收集盘中的干粉吸入剂,并采用1.3节的方法测定各处的OP含量。每组实验进行3次,结果取平均值。
体外肺部细微粒子沉积率是指NGI中2级至MOC级的药物(OP)沉积总量占单次测试总主药量的百分比,计算公式如下。
| $ F=\frac{\sum\limits_{i=2}^{7} M_{i}+M_{\mathrm{MOC}}}{\sum M} \times 100 \% $ | (5) |
式中:F为干粉吸入剂的体外肺部细微粒子沉积率,Mi为OP在第i级中的沉积量,MMOC为OP在MOC级中的沉积量,∑M为OP总质量(包括胶囊、吸入装置、NGI模拟喉部、第1~7级及MOC级收集盘中OP的质量)。
测试后,将各处的OP沉积量输入配套软件CITDAS中,可计算得到各样品的空气动力学直径Da。
1.6 细胞毒性测定采用CCK-8法测试OP原料药及干粉吸入剂的细胞毒性。HPAEpiC细胞在37 ℃、5% CO2的条件下置于CO2培养箱(311,美国Thermo Fisher Scientific公司)中培养,细胞贴壁生长至约80%汇合后,用胰蛋白酶消化,得到细胞悬液。使用完全培养基(含10% FBS和1%双抗的1640培养基)稀释细胞悬液至浓度约为6×104个细胞/mL。在无菌96孔板中加入细胞悬液(100 μL/孔),并在37 ℃、5% CO2的条件下培养24 h使其贴壁生长。
使用无血清培养基(含1%双抗的1640培养基)分别将OP原料药和干粉吸入剂溶解稀释,稀释的质量浓度梯度区间为500~1 000 μg/mL,干粉吸入剂对应的OP质量浓度约为294~588 μg/mL。
在37 ℃、5% CO2的条件下培养24 h后,细胞生长至约70%~80%汇合,吸去各孔培养基,用磷酸盐缓冲液(PBS)冲洗。随后,在每孔中加入不同质量浓度的OP原料药稀释液或干粉吸入剂稀释液100 μL,继续在37 ℃、5% CO2的条件下培养24 h。然后吸去各孔溶液,用PBS冲洗。各孔中加入提前用无血清培养基稀释10倍的CCK-8试剂100 μL,在37 ℃下继续培养约2 h。然后使用酶标仪(Multiskan GO,美国Thermo Fisher Scientific公司)在450 nm波长下测定各孔的吸光度。实验中设置空白组(未接种细胞、未加入药液)及对照组(仅接种细胞、未加入药液)。按照式(6)计算细胞存活率Rs。
| $ R_{\mathrm{s}}=\frac{A-A_{\mathrm{b}}}{A_{0}-A_{\mathrm{b}}} \times 100 \% $ | (6) |
式中:A为各实验组的吸光度,Ab为空白组的吸光度,A0为对照组的吸光度。每组实验进行3次,结果取平均值。
1.7 抑菌能力测定采用梯度稀释法测定干粉吸入剂对金黄色葡萄球菌的抑制能力。将在优化条件下制备的含乳铁蛋白的4 mg干粉吸入剂溶解在4 mL LB培养基(含0.5%酵母提取物、1%胰蛋白胨、1%氯化钠,均为质量分数)中,接种40 μL金黄色葡萄球菌,在摇床中培养12 h。用无菌水将细菌悬液梯度稀释至1×103 CFU/mL。取稀释后的细菌悬液100 μL,涂布在琼脂培养基(含0.5%氯化钠、0.5%酵母提取物、1%胰蛋白胨、1.5%琼脂)上,于37 ℃、5% CO2的条件下培养12 h,记录菌落数。空白组的LB培养基中不加入任何药物,对照组的LB培养基中加入在优化条件下制备的不含乳铁蛋白的干粉吸入剂,其余操作与实验组相同。按照式(7)计算抑菌率Ra。
| $ R_{\mathrm{a}}=\frac{a_{0}-a_{1}}{a_{0}} \times 100 \% $ | (7) |
式中:a0为空白组的菌落数,a1为实验组或对照组的菌落数。
2 结果与讨论 2.1 正交试验设计及结果 2.1.1 正交试验设计本课题组前期通过单因素试验,根据干粉吸入剂的造粒情况、几何粒径大小、表面形貌及团聚程度,对干粉吸入剂的配方及喷干工艺参数进行了初步优化,确定了较优的条件为:磷酸奥司他韦500 mg、乳铁蛋白50 mg、m(主药) ∶m(辅料)=5 ∶3,喷雾干燥器的进口温度为120 ℃,旋风强度为100%。对仍未确定的4个因素:m(L-亮氨酸) ∶m(甘露醇)、溶液体积、进料速率、气体流量,采用正交试验对其进行优化。按照L9(34)正交试验设计表安排试验,各因素的水平及试验方案分别如表 1和表 2所示。
| 下载CSV 表 1 因素水平设计表 Table 1 Design table of factors and levels |
| 下载CSV 表 2 正交试验方案 Table 2 Orthogonal test scheme |
按照正交试验方案进行试验,制备9批磷酸奥司他韦-乳铁蛋白干粉吸入剂。通过扫描电子显微镜观察吸入剂颗粒的表面形貌、团聚情况及几何粒径大小,结果如图 2所示。可以看出,样品1、2、3为圆整的球形颗粒,表面较为光滑;样品4、5、6虽然仍呈现圆整的球形颗粒,但相较于前3组样品,其表面出现较多的褶皱;样品7、8、9均有呈“空穴”状的颗粒出现,表面褶皱中产生“捕获效应”,即有小颗粒被包裹在空穴中[16]。当m(L-亮氨酸) ∶m(甘露醇)相同时,样品的表面微观形貌相似;当m(L-亮氨酸) ∶m(甘露醇)发生改变时,样品的表面微观形貌会发生较为明显的变化。这种现象可能是由于L-亮氨酸具有一定的疏水性,在液滴干燥的过程中会增加颗粒表面的吸引力,最终引起颗粒表面微观形貌的改变[17]。

|
图 2 不同试验条件(试验号)下制备的磷酸奥司他韦-乳铁蛋白干粉吸入剂的SEM图 Fig.2 SEM images of oseltamivir phosphate-lactoferrin dry powder inhalations prepared under different test conditions (test numbers) |
表 3为各组干粉吸入剂的收率及粉体学性质。从结果中可以看出各组样品的平均几何粒径差别并不显著。其中,样品1和3由于颗粒间出现了较为明显的团聚现象,因此其平均几何粒径较大;样品7和8有较多呈“空穴”状的颗粒出现,因此其平均几何粒径大于其他各组。
| 下载CSV 表 3 干粉吸入剂的收率及粉体学性质 Table 3 Yield and powder properties of dry powder inhalations |
干粉吸入剂的收率在48%~71%之间,未能达到较高的收率水平。导致这一结果的主要原因是颗粒的平均几何粒径较小[18],处于1~2 μm左右的颗粒之间的内聚力较非纳微级的大颗粒强,且容易产生静电作用,宏观上会降低干粉吸入剂粉末的流动性,使制备的干粉吸入剂难以从喷雾干燥器中取出,导致收率降低。
9组干粉吸入剂的堆积密度和振实密度差别不大,堆积密度均小于0.3 g/mL,振实密度均小于0.4 g/mL,二者均较小,有利于干粉吸入剂的分散。
与收率结果类似,由于干粉吸入剂的平均几何粒径较小,导致范德华力、静电力和毛细作用力明显,因此干粉吸入剂的流动性普遍较差。其中,样品1、3、4、6的卡尔指数均大于26%,流动性差;样品2、5、7、8的卡尔指数在20%~26%之间,流动性尚可;样品9的卡尔指数为18.48%,流动性最佳。
2.1.4 干粉吸入剂的体外肺部沉积情况体外肺部细微粒子沉积率FPF是评价干粉吸入剂质量的最关键指标,而空气动力学直径Da影响干粉吸入剂在肺部的沉积情况。各组样品的Da和FPF结果如表 4所示。
| 下载CSV 表 4 干粉吸入剂的空气动力学直径Da及体外肺部细微粒子沉积率FPF Table 4 Aerodynamic diameter and fine particle fraction of dry powder inhalations |
样品1的FPF很小,结合SEM结果,分析其原因可能是由于样品1的团聚比较严重,吸入过程中未能很好地分散,因此粒径较大,导致大部分颗粒被截留在NGI的第1级收集盘,无法进一步向更深层递送。样品3的FPF也较小,原因可能是样品3与HPMC胶囊间的静电作用较强,颗粒大部分存留于胶囊中,没有很好地从吸入装置中递送出来。样品2由于团聚现象不明显,颗粒的分散性较好,有利于干粉吸入剂的雾化分散,因此其FPF较大。样品4和6大部分存留在胶囊中,未能有效地递送出吸入装置,导致其FPF很小,原因是样品与HPMC胶囊间的静电作用较强。结合SEM结果可知,样品5的粒径分布比样品4和6更为均匀,颗粒间的接触面积较小,可减少粒子间的接触摩擦,因而静电作用有所减弱,使FPF增大。样品7~9的FPF较前6组样品均有明显提高,且Da在2~5 μm范围内,适合肺部吸入。分析其主要原因是随着L-亮氨酸添加量的进一步提高,在干燥过程中液滴表面有更多疏水性L-亮氨酸富集,因此可以提升干粉吸入剂的雾化性能[18]。相较于样品7和8而言,样品9产生的具有“空穴”的大颗粒较少,粒径分布更为均匀,更有利于细微粒子向深层递送,其FPF高达75.613%。
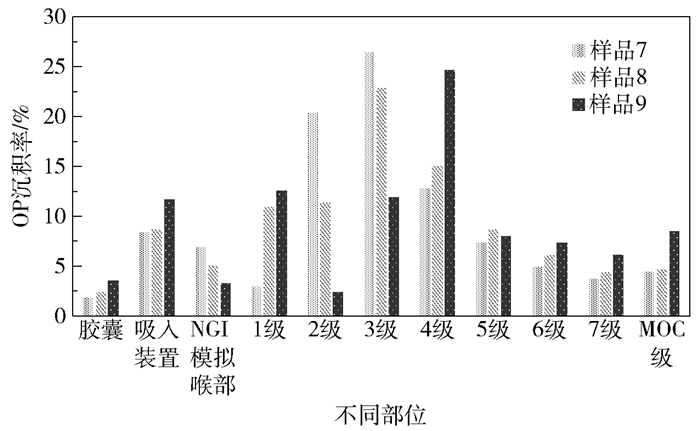
样品7~9中OP在各处的沉积情况见图 3。由结果可知,样品7和8在第3级收集盘中的OP沉积率最高,样品9在第4级收集盘中的OP沉积率最高。而这3组样品在胶囊、吸入装置、NGI模拟喉部及第1级收集盘中的OP沉积率都较低,表明大部分干粉吸入剂被有效递送到第2级至MOC级,有利于干粉吸入剂在肺部直接发挥作用。
|
图 3 样品7~9中磷酸奥司他韦在各部位的沉积情况 Fig.3 Deposition of oseltamivir phosphate in samples 7-9 |
根据正交试验得到的磷酸奥司他韦-乳铁蛋白干粉吸入剂的收率、卡尔指数、Da及FPF结果,采用多指标综合评价法(Z分综合评价法)对试验中选取的各个水平进行综合评定。Z分综合评价法的计算方法如下。
| $ Z_{i}=\frac{X_{i}-\bar{X}_{i}}{S_{i}} $ | (8) |
| $ \sum Z_{i}=\sum Z_{i, \mathrm{~h}}-\sum Z_{i, 1} $ | (9) |
式中:Xi为某组试验中某一指标结果,Xi为该指标的9组结果的平均值,Si为该指标的9组结果的标准差,Zi, h为高优指标的Zi值,Zi, l为低优指标的Zi值。“高优”指该指标数值越大越好,“低优”指该指标数值越小越好。通过式(8)计算Zi值,使所选指标无量纲化以便进行进一步的多指标综合评价。在一定范围内,所选的4个指标中,产率、FPF为“高优”指标,在计算∑Zi值时应将对应的Zi值加上;卡尔指数和Da为“低优”指标,在计算∑Zi值时应将对应的Zi值减去。最终得到的∑Zi值越大,结果越优。正交试验的综合评价结果如表 5所示。
| 下载CSV 表 5 正交试验的综合评价结果 Table 5 Comprehensive evaluation results of the orthogonal test |
根据极差大小,得到正交试验中各因素对干粉吸入剂性质影响的大小顺序:A(m(L-亮氨酸)∶m(甘露醇))>C(进料速率)>B(溶液体积)>D(气体流量)。由试验结果可知,干粉吸入剂的较优配方及喷雾干燥条件为A3B2C3D3,即:m(L-亮氨酸) ∶m(甘露醇)=3 ∶0,溶液体积40 mL,进料速率6.4 mL/min,气体流量473 L/h。
由上述极差分析结果可知,m(L-亮氨酸) ∶m(甘露醇)是影响干粉吸入剂性质的最主要因素。此外,干粉吸入剂表面的静电作用对试验结果的影响也较大。而表面静电作用受配方、含水量、颗粒表面的粗糙程度及粒径均匀程度等因素的综合影响,情况较为复杂。通过比较FPF与卡尔指数可以看出,当干粉吸入剂的流动性较好时,其体外肺部沉积情况也较好。产生这一现象的主要原因是流动性的提高有利于胶囊的罐装,同时也有利于干粉吸入剂向更深层递送。
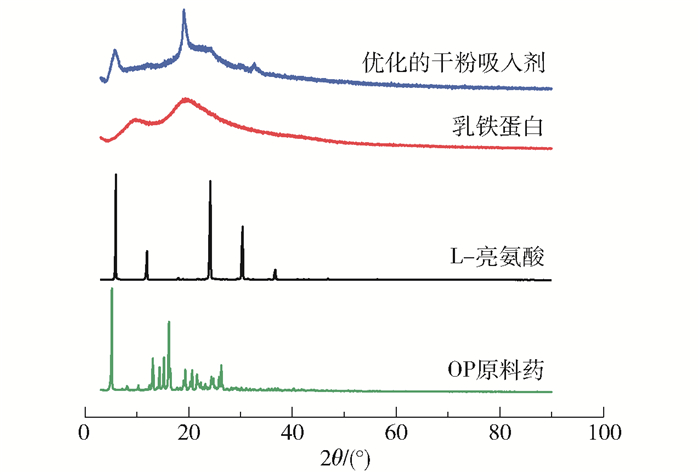
2.2 干粉吸入剂的XRD结果图 4为各原料以及在优化条件下制备的磷酸奥司他韦-乳铁蛋白干粉吸入剂的XRD谱图。从结果中可以看出:OP原料药在2θ约为5°、13°、14°、15°、16°、19°、21°、26°处具有明显的衍射峰;L-亮氨酸在2θ约为6°、12°、24°、30°和37°处有明显的衍射峰;而乳铁蛋白没有明显的衍射峰,呈无定形状态;在优化条件下采用喷雾干燥法制备的干粉吸入剂在2θ为6°和19°处存在衍射峰,两峰分别对应L-亮氨酸和OP原料药的特征峰,但峰形与原料相比明显变宽,表明在喷雾干燥过程中原料晶型遭到一定程度的破坏,仅有少部分晶型保留,这与喷雾干燥法易产生无定形状态物质的趋势一致。
|
图 4 OP原料药、L-亮氨酸、乳铁蛋白以及在优化条件下制备的干粉吸入剂的XRD谱图 Fig.4 XRD patterns of raw OP, L-leucine, lactoferrin and the dry powder inhalation prepared under optimized conditions |
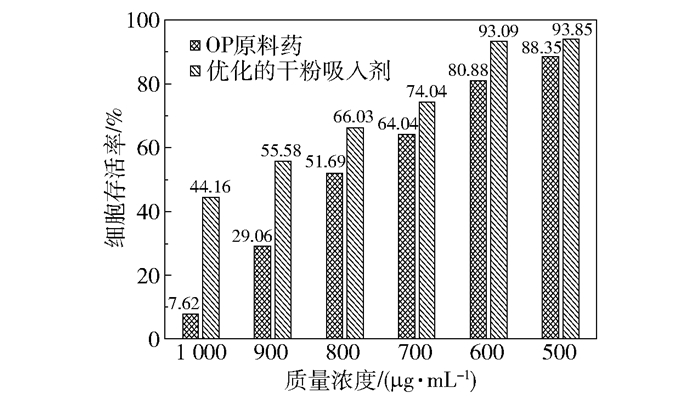
OP原料药及在优化条件下制备的干粉吸入剂对HPAEpiC细胞的毒性测试结果如图 5所示。由结果可知,OP原料药和干粉吸入剂的细胞存活率均随其质量浓度的降低而逐渐增大,表明其细胞毒性逐渐减弱。当干粉吸入剂的质量浓度不高于600 μg/mL(所含OP的质量浓度约为353 μg/mL)时,HPAEpiC细胞的存活率均大于90%,因此可以认为在此浓度范围内干粉吸入剂对HPAEpiC细胞几乎没有损伤作用。产生这一结果的主要原因是干粉吸入剂中除了磷酸奥司他韦外,还加入了辅料L-亮氨酸及乳铁蛋白。L-亮氨酸是人体必需氨基酸之一,对细胞没有明显的毒性,这一实验结果与Wang等[19]的研究结果一致。乳铁蛋白作为一种人体自身分泌的蛋白质,广泛应用于肺癌靶向药物的开发[20-21],目前还没有对肺部细胞产生明显毒害作用的报道。综上所述,由于加入的辅料对肺部细胞均没有明显的毒害作用,因此,在相同的质量浓度下干粉吸入剂相较于OP原料药对正常肺部细胞的毒性有所减弱。这一结果与Yan等[22]的研究结果一致。
|
图 5 磷酸奥司他韦原料药及优化的干粉吸入剂对HPAEpiC细胞的毒性 Fig.5 Toxicity to HPAEpiC cells of oseltamivir phosphate and optimized dry powder inhalation |
采用梯度稀释法和菌落计数法测试了干粉吸入剂对金黄色葡萄球菌的抑制作用,结果如图 6所示。空白组、对照组和实验组的菌落数分别为80、76和62,其菌落总数均在30~300之间,达到菌落计数法的实验要求。由结果可知,对照组的菌落数相较于空白组没有明显变化,而实验组的菌落数相较于空白组和对照组明显减少,表明含有乳铁蛋白的干粉吸入剂(1 mg/mL)对金黄色葡萄球菌具有一定的抑制作用,抑菌率为22.50%。优化的干粉吸入剂中含有的乳铁蛋白具有金属离子结合位点,可与金黄色葡萄球菌生长和代谢所需的Fe3+螯合,从而产生抑菌作用[23-25]。

|
图 6 添加乳铁蛋白对干粉吸入剂抑制金黄色葡萄球菌效果的影响 Fig.6 Effect of adding lactoferrin on the inhibitory effect of dry powder inhalation against S. aureus |
(1) 本文在前期单因素试验初步优化的基础上,采用正交试验法进一步优化了磷酸奥司他韦-乳铁蛋白干粉吸入剂的配方及喷雾干燥工艺参数,得到优化的制备条件为:m(L-亮氨酸) ∶m(甘露醇)= 3 ∶0,溶液体积40 mL,进料速率约6.4 mL/min,气体流量约473 L/h。
(2) 考察了在优化条件下制备的干粉吸入剂对HPAEpiC细胞的毒性以及对金黄色葡萄球菌的抑制作用,结果表明:当干粉吸入剂的质量浓度低于600 μg/mL时,干粉吸入剂对HPAEpiC细胞几乎没有损伤作用;在质量浓度为1 mg/mL时,干粉吸入剂对金黄色葡萄球菌具有一定的抑制作用,抑菌率为22.50%。
| [1] |
VAN DER VRIES E, SCHUTTEN M, FRAAIJ P, et al. Influenza virus resistance to antiviral therapy[J]. Advances in Pharmacology, 2013, 67: 217-246. |
| [2] |
LI G D, DE CLERCQ E. Therapeutic options for the 2019 novel coronavirus (2019-nCoV)[J]. Nature Reviews Drug Discovery, 2020, 19(3): 149-150. DOI:10.1038/d41573-020-00016-0 |
| [3] |
CALLIGARI P A, KNELLER G R, GIANSANTI A, et al. Inhibition of viral group-1 and group-2 neuraminidases by oseltamivir: a comparative structural analysis by the ScrewFit algorithm[J]. Biophysical Chemistry, 2009, 141(1): 117-123. DOI:10.1016/j.bpc.2009.01.004 |
| [4] |
VALIULIN S V, ONISCHUK A A, DUBTSOV S N, et al. Aerosol inhalation delivery of triazavirin in mice: outlooks for advanced therapy against novel viral infections[J]. Journal of Pharmaceutical Sciences, 2021, 110: 1316-1322. DOI:10.1016/j.xphs.2020.11.016 |
| [5] |
SAHAKIJPIJARN S, MOON C, WARNKEN Z N, et al. In vivo pharmacokinetic study of remdesivir dry powder for inhalation in hamsters[J]. International Journal of Pharmaceutics: X, 2021, 3: 100073. DOI:10.1016/j.ijpx.2021.100073 |
| [6] |
CONZELMANN C, MVLLER J A, PERKHOFER L, et al. Inhaled and systemic heparin as a repurposed direct antiviral drug for prevention and treatment of COVID-19[J]. Clinical Medicine, 2020, 20(6): e218-e221. DOI:10.7861/clinmed.2020-0351 |
| [7] |
HALPIN D M G, SINGH D, HADFIELD R M. Inhaled corticosteroids and COVID-19: a systematic review and clinical perspective[J]. European Respiratory Journal, 2020, 55: 2001009. DOI:10.1183/13993003.01009-2020 |
| [8] |
GRAYSON M L, COSGROVE S E, MCCARTHY J S, et al. Kucers' the use of antibiotics: a clinical review of antibacterial, antifungal, antiparasitic, and antiviral drugs[M]. 7th ed. Boca Raton: CRC Press, 2018.
|
| [9] |
TANG Y, ZHANG H Y, LU X F, et al. Development and evaluation of a dry powder formulation of liposome-encapsulated oseltamivir phosphate for inhalation[J]. Drug Delivery, 2015, 22(5): 608-618. DOI:10.3109/10717544.2013.863526 |
| [10] |
邹佳辉, 黄偲偲, 邱娜, 等. 用于肺部给药的磷酸奥司他韦微粉的制备及肺组织分布初步考察[J]. 中国医药工业杂志, 2017, 48(5): 692-698. ZOU J H, HUANG S S, QIU N, et al. Preparation and preliminary investigation on lung distribution of oseltamivir phosphate powders for pulmonary administration[J]. Chinese Journal of Pharmaceuticals, 2017, 48(5): 692-698. (in Chinese) |
| [11] |
AZIZ S, SCHERLIEΒ R, STECKEL H. Development of high dose oseltamivir phosphate dry powder for inhalation therapy in viral pneumonia[J]. Pharmaceutics, 2020, 12: 1154. DOI:10.3390/pharmaceutics12121154 |
| [12] |
FOSTER T J, GEOGHEGAN J A. Staphylococcus aureus[M]//TANG Y W, SUSSMAN M, LIU D, et al. Molecular medical microbiology. 2nd ed. Amsterdam: Academic Press, 2015: 655-674.
|
| [13] |
SHAJI J, SHAIKH M. Current development in the evaluation methods of pulmonary drug delivery system[J]. Indian Journal of Pharmaceutical Sciences, 2016, 78(3): 294-306. |
| [14] |
国家药典委员会. 中华人民共和国药典: 四部[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China: Part 4[M]. Beijing: China Medical Science Press, 2020. (in Chinese) |
| [15] |
杨资伟, 杨阳, 李晗, 等. 两种撞击器测定自制吸入粉雾剂体外沉积性质的对比研究[J]. 国际药学研究杂志, 2013, 40(4): 475-480. YANG Z W, YANG Y, LI H, et al. Characters of dry powder inhaler in vitro deposition with twin-stage impactor and next generation pharmaceutical impactor: a comparative study[J]. Journal of International Pharmaceutical Research, 2013, 40(4): 475-480. (in Chinese) |
| [16] |
SOU T, KAMINSKAS L M, NGUYEN T H, et al. The effect of amino acid excipients on morphology and solid-state properties of multi-component spray-dried formulations for pulmonary delivery of biomacromolecules[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2013, 83(2): 234-243. DOI:10.1016/j.ejpb.2012.10.015 |
| [17] |
SOU T, ORLANDO L, MCINTOSH M P, et al. Investigating the interactions of amino acid components on a mannitol-based spray-dried powder formulation for pulmonary delivery: a design of experiment approach[J]. International Journal of Pharmaceutics, 2011, 421: 220-229. DOI:10.1016/j.ijpharm.2011.09.018 |
| [18] |
COLOMBO P, TRAINI D, BUTTINI F. Inhalation drug delivery: techniques and products[M]. Chichester: John Wiley & Sons, Ltd., 2013.
|
| [19] |
WANG X H, WAN W, LU J, et al. Effects of L-leucine on the properties of spray-dried swellable microparticles with wrinkled surfaces for inhalation therapy of pulmonary fibrosis[J]. International Journal of Pharmaceutics, 2021, 610: 121223. DOI:10.1016/j.ijpharm.2021.121223 |
| [20] |
ABD ELWAKIL M M, MABROUK M T, HELMY M W, et al. Inhalable lactoferrin-chondroitin nanocomposites for combined delivery of doxorubicin and ellagic acid to lung carcinoma[J]. Nanomedicine, 2018, 13(16): 2015-2035. DOI:10.2217/nnm-2018-0039 |
| [21] |
ABDELAZIZ H M, ELZOGHBY A O, HELMY M W, et al. Inhalable lactoferrin/chondroitin-functionalized monoolein nanocomposites for localized lung cancer targeting[J]. ACS Biomaterials Science & Engineering, 2020, 6: 1030-1042. |
| [22] |
YAN M, DONG S Y, SHEN X, et al. Lactoferrin-thymol complex for the disinfection of gram-positive Staphylococcus aureus and gram-negative Escherichia coli[J]. Food & Function, 2021, 12: 11165-11173. |
| [23] |
LEON-SICAIROS N, CANIZALEZ-ROMAN A, DE LA GARZA M, et al. Bactericidal effect of lactoferrin and lactoferrin chimera against halophilic Vibrio parahaemolyticus[J]. Biochimie, 2009, 91: 133-140. DOI:10.1016/j.biochi.2008.06.009 |
| [24] |
YEN C C, SHEN C J, HSU W H, et al. Lactoferrin: an iron-binding antimicrobial protein against Escherichia coli infection[J]. Biometals, 2011, 24: 585-594. DOI:10.1007/s10534-011-9423-8 |
| [25] |
KELL D B, HEYDEN E L, PRETORIUS E. The biology of lactoferrin, an iron-binding protein that can help defend against viruses and bacteria[J]. Frontiers in Immunology, 2020, 11: 1221. DOI:10.3389/fimmu.2020.01221 |