2. 重庆城市管理职业学院 智能工程学院,重庆 401331
2. School of Intelligent Engineering, Chongqing City Management College, Chongqing 401331, China
气体水合物是一种由水分子和客体分子在低温高压下形成的特殊笼型晶体化合物[1],其中水分子间相互连接形成主体水笼,客体分子占据笼内并稳定笼体。气体水合物的晶体结构主要为Ⅰ型、Ⅱ型和H型。Ⅰ型水合物为体心立方结构,由2个五边形十二面体(512)的小笼(D笼)以及6个由12个五边形和2个六边形组成的十四面体(51262)的大笼(T笼)组成;Ⅱ型水合物为面心立方结构,由8个对称的准球形十六面体(51264)的H笼和16个D笼组成;H型水合物的晶胞为简单立方结构,由3个D笼、2个扁球形十二面体(435663)的ID笼和1个椭球形二十面体(51268)的I笼组成[2]。
气体水合物中客体分子特性是影响水合物稳定性的关键因素之一[3-4]。通常情况下,H2、N2等小体积的客体分子能够稳定占据Ⅰ型及Ⅱ型水合物中的小孔;CH4、H2S、CO2、C2H6及C2H4等中等体积的客体分子能够稳定占据Ⅰ型水合物中的大孔;较大体积的客体分子只能占据Ⅱ型水合物中的大孔[5-6]。Liu等[7]指出,随着客体分子C链长度的变化,客体分子占据水笼后,C—C键伸缩振动频率的变化量差别明显,表明水合物中主客体间的相互作用发生了改变。Sloan等[8]发现在水合物的生成过程中,水合物的动力学特性与客体的尺寸相关联,客体尺寸过小不利于水合物的稳定。对于小分子烷烃水合物,随着客体分子尺寸的增大,主客体间的相互作用逐渐增强,客体分子的C—C键伸缩振动频率呈现蓝移[9]。Yan等[10]研究了CO2置换CH4水合物过程中的相互作用,发现相比于CH4水合物,CO2水合物的主客体间具有更强的静电作用。综上,水合物中的客体分子决定着水合物的相关特性,客体分子不同,水合物中主客体间的相互作用存在差异。目前的相关研究多集中在烷烃类水合物的主客体间相互作用、C—C键伸缩振动等方面,而对烯烃、炔烃水合物的研究较少,并且未对比具有相同C链长度的烷烃、烯烃、炔烃的水合物中主客体间相互作用的本质属性,也未研究C原子的轨道杂化特性对水合物中主客体间相互作用的影响。
为了分析烃类水合物中主客体间相互作用的特征,本文利用量子化学方法获得乙烷、乙烯及乙炔占据Ⅰ型水合物大笼时的结构、相互作用能及C—C键伸缩振动频率,讨论了客体分子在水笼中的赋存形态,揭示了主客体间的相互作用机制,可以为水合物微观赋存机理的研究提供参考。
1 结构模型及计算方法首先,从Ⅰ型水合物的单晶衍射数据[11]中获得计算所需的水合物的T笼几何结构(图 1),并且修改了水合物笼体的氢原子排列,使具有未成键氢原子的邻近水分子对的数目最小化,以保持水笼的稳定结构[12-13]。邻近的具有未成键氢原子的水分子对数为3,乙烷、乙烯和乙炔分子被封装在T笼中。
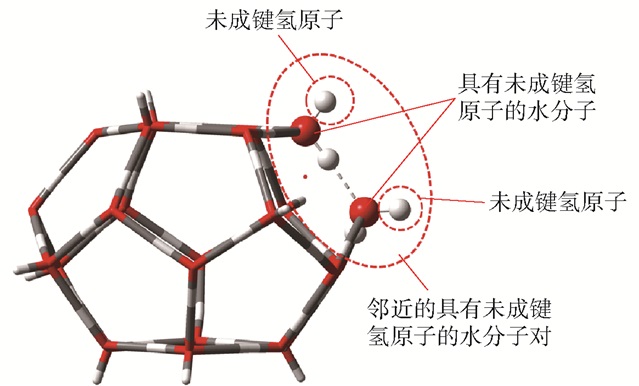
|
图 1 T笼的几何结构 Fig.1 Geometricstructure of the T cage |
在几何优化时,首先将客体分子置于主体水笼中间,冻结笼体进行结构优化,使客体分子在主体水笼中的取向局部最小化。然后水笼被完全松弛,利用B3LYP交换-相关泛函和Grimme的DFT-D3(BJ)色散校正以及6-311++G(2d,2p)基组(B3LYP-D3(BJ)/6-311++G(2d,2p)计算水平)对所有主客体组合进行几何优化,收敛限为:Maximum Force < 0.000 450,Root Mean Square(RMS) < 0.000 300,Maximum Displacement < 0.001 800,RMS Displacement < 0.001 200。利用与结构优化相同的计算水平进行频率计算,以确保优化的几何结构没有虚频。分别使用含色散矫正和不含色散矫正的M0 6-2X方法,以6-311++G(2d,2p)为基组(M0 6-2X/6-311++G(2d,2p)计算水平)进行单点能计算,以获得主客体间相互作用能(ΔEhost-guest)。能量计算中使用基组重叠误差矫正(BSSE)。M0 6-2X函数[14]是非局域交换量(2X)的两倍的高非局域函数;M0 6-2X/6-311++G(2d,2p)计算水平是描述弱相互作用系统结合能的有效工具,并且已成功用于气体水合物的研究[6, 10]。以上计算在Gaussian 16软件中进行,ΔEhost-guest使用下式计算。
| $ \Delta E_{\text {host-guest }}=E_{\text {total }}-E_{\text {cage }}-E_{\text {guest }} $ |
式中:Etotal、Ecage和Eguest分别是客体分子占据的主体水笼的单点能、具有稳定几何结构的空主体水笼的能量和孤立客体分子的能量。
利用PSI4软件在SAPT2+/aug-cc-pVDZ计算水平上对水合物的主客体间相互作用进行能量分解,获得表征吸引作用的静电、色散、感应作用对水合物的主客体间相互作用的贡献。
2 结果与讨论 2.1 客体分子占据水合物笼体的几何结构在水合物的研究中,客体分子在笼中的占据位置对判断客体分子构型及占据稳定性具有重要意义[15]。图 2为乙烷、乙烯和乙炔占据水合物T笼时的几何结构。可以看出:客体分子占据T笼的中心;乙烷占据水合物T笼时呈现对角占据形式,即朝向水笼两个对角的五边形面;乙烯分子平面平行于水笼的六边形孔洞,呈现平躺式;乙炔分子在水笼中的占据形态与乙烷相似,其分子轴线指向T笼的两个五边形面。表 1为客体分子占据T笼后笼体的特征参数。相比于空笼,乙烷占据T笼后,平均O—O距离增加了0.01 Å,表明T笼发生了微小的膨胀;乙烯占据T笼后,T笼没有发生膨胀或收缩;乙炔占据T笼后,平均O—O距离减小了0.01 Å,表明T笼发生了微小的收缩。研究[16-17]指出,水笼的膨胀、收缩与客体分子尺寸紧密相关:乙烷分子尺寸较大,会导致水笼膨胀;乙炔分子较小,并且与水笼产生吸引作用,导致水笼略微收缩。但是水笼的膨胀和收缩均很小,并未出现不规则变形。
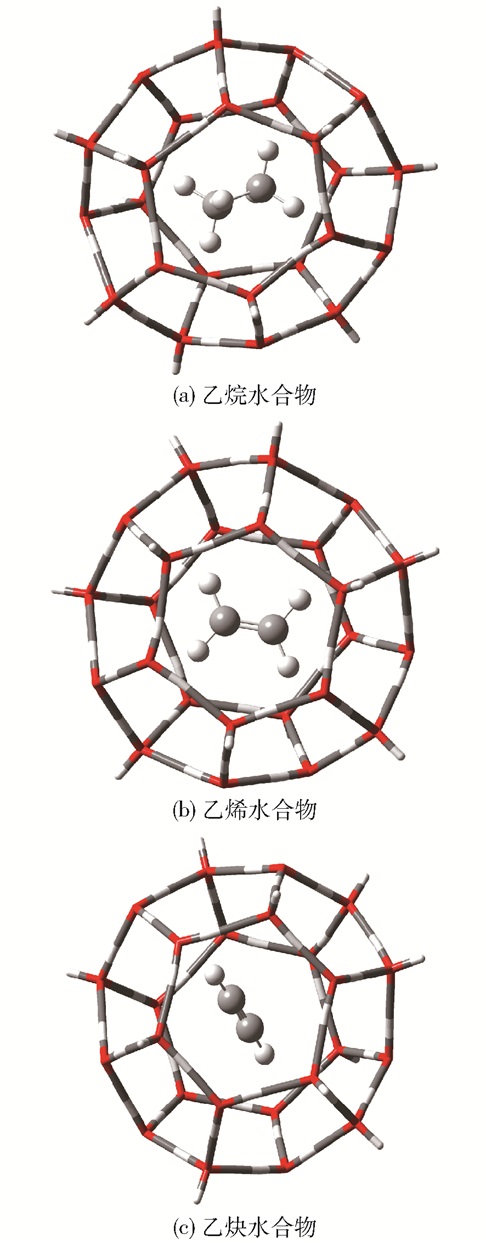
|
图 2 乙烷、乙烯和乙炔在占据水合物T笼时的几何结构 Fig.2 Geometricstructures of ethane, ethylene and ethyne when occupying the hydrate T cage |
| 下载CSV 表 1 客体分子占据T笼后笼体的特征参数 Table 1 Characteristic parameters of the T cage body after occupation by guest molecules |
表 2为客体分子占据T笼前后的平均C—H距离和平均C—C距离。乙烷、乙烯和乙炔分子占据T笼后与占据前相比,其原子间距均减小:平均C—H距离分别减小了0.005 Å、0.006 Å和0.003 Å,变化量较小;平均C—C距离分别减小了0.007 Å、0.009 Å 和0.011 Å,变化量逐渐增加。随着C原子连接的H原子数量减小,C—C间的相互作用增强。乙炔分子上的氢原子数量较少,C—C间的相互作用较强,当乙炔分子占据笼体后,笼体对乙炔分子中C—H键的影响较大,从而增强C—C间的相互作用,因此平均C—C距离变化较大。
| 下载CSV 表 2 客体分子占据T笼前后的平均C—H间距和平均C—C间距 Table 2 Average C—H distance and average C—C distance before and after the guest molecule occupies the T cage |
通常认为主客体间的相互作用受客体尺寸影响,客体分子尺寸越大,相互作用越强[6]。表 3为添加色散矫正前后主客体间的相互作用能。色散矫正前,乙烷、乙烯、乙炔占据T笼的ΔEhost-guest分别为-31.40、-27.21、-32.36 kJ/mol,随着客体分子由乙烷→乙烯→乙炔,ΔEhost-guest表现出先减小后增大的趋势。乙烷、乙烯和乙炔中的碳原子分别采用sp3、sp2和sp杂化,参与杂化的s轨道的比例分别是1/4、1/3和1/2,相比于p轨道,s轨道受原子核的吸引更强,因此s轨道的比例越高,碳原子的电负性越强,这样客体分子的C原子更容易与主体水笼的H原子产生相互作用,因此乙炔占据水笼时相互作用能最高;乙烷C原子的电负性弱于乙炔,故其占据T笼时的相互作用能小于乙炔;乙烷的分子尺寸大于乙烯,故其占据T笼时的相互作用能大于乙烯。
| 下载CSV 表 3 添加色散矫正前后主客体间的相互作用能 Table 3 Interaction energies between the host and the guest before and after adding a dispersion correction |
进一步分析Grimme的DFT-D3色散矫正对相互作用能的影响,结果发现:在添加色散矫正后,乙炔占据T笼仍具有最高的相互作用能,乙烷次之,乙烯最小;与色散矫正前相比,色散矫正的加入会明显增大相互作用能。
为充分分析乙烷、乙烯、乙炔水合物的主客体间相互作用的本质差别,利用SAPT方法将相互作用能分解为静电作用能(ΔEelst)、色散作用能(ΔEdis)和感应作用能(ΔEind),结果如表 4所示。与乙烷占据T笼相比,乙炔占据T笼后主客体间的相互作用中静电和感应作用增强,色散作用减弱。乙烯分子占据T笼的总主客体间相互作用弱于乙烷和乙烯,但是其感应作用相比乙烷增强,静电作用减弱,但变化幅度不大,而色散作用明显减弱。随着C原子的杂化方式由sp3→sp2→sp杂化,C原子的电负性增强,与水笼间的相互作用中静电作用先略微减弱、然后增强,色散作用逐渐减弱。
| 下载CSV 表 4 主客体间相互作用能分解后的静电、色散和感应作用能 Table 4 Electrostatic, dispersion, and induction interaction energy after decomposition of the energy of interaction between host and guest |
C—C键振动频率能够反映客体分子占据水笼后的状态变化[18]。表 5为客体分子占据水笼前后的C—C键伸缩振动频率及变化量。由结果可知,乙烷分子占据T笼后C—C键伸缩振动频率为1 006.15 cm-1,相比于未占据T笼时,伸缩振动频率增加了6.79 cm-1,原因是乙烷的H原子与水笼之间的相互作用导致C—H键的强度减弱,碳原子杂化轨道中s成分增加,键能增加,导致伸缩振动频率增加。对于乙烯和乙炔,相比于未占据T笼时,其占据T笼后C—C键伸缩振动频率分别减小了5.86 cm-1和15.87 cm-1,原因是C原子与水笼间的作用导致碳原子杂化轨道中s成分降低,键能降低,伸缩振动频率减小。
| 下载CSV 表 5 客体分子占据T笼前后的C—C键伸缩振动频率及变化量 Table 5 Frequency and variation of stretching vibration of C—C bond before and after the guest molecule occupies the T cage |
本文利用量子化学方法,对乙烷、乙烯、乙炔占据水合物T笼时的结构、能量及C—C键伸缩振动频率进行研究,所得结论如下:
(1) 乙烷、乙烯、乙炔分子占据水合物笼体后,水笼会发生微小的膨胀或收缩。客体分子的平均C—H原子间距和平均C—C原子间距与占据前相比均有所减小,其中乙炔的平均C—C原子间距减小了0.011 Å,乙烯次之,乙烷最小。
(2) 色散矫正前,乙烷、乙烯、乙炔占据T笼的ΔEhost-guest分别为-31.40、-27.21、-32.36 kJ/mol。色散矫正后,这些分子的相互作用能明显增大。
(3) 能量分解结果表明,C原子的杂化方式对水合物的主客体间相互作用影响较大。随着客体分子中C原子的杂化方式由sp3→sp2→sp杂化,客体分子与水笼间的相互作用中静电作用先略微减弱、然后增强,色散作用逐渐减弱。
(4) 与未占据T笼时相比,乙烷分子占据T笼后C—C键伸缩振动频率增加了6.79 cm-1;乙烯和乙炔分子占据T笼后C—C键伸缩振动频率分别减小了5.86 cm-1和15.87 cm-1。
| [1] |
XU C G, LI X S, YAN K F, et al. Research progress in hydrate-based technologies and processes in China: a review[J]. Chinese Journal of Chemical Engineering, 2019, 27(9): 1998-2013. DOI:10.1016/j.cjche.2018.12.002 |
| [2] |
陈浩, 颜克凤, 李小森. 基于量子化学计算方法的天然气水合物稳定性研究进展[J]. 化学通报, 2020, 83(2): 111-120. CHEN H, YAN K F, LI X S. Research advance in the stability characteristics of natural gas hydrate based on quantum chemical calculation methods[J]. Chemistry, 2020, 83(2): 111-120. (in Chinese) |
| [3] |
ZHOU X B, ZHANG Q, LONG Z, et al. In situ PXRD analysis on the kineticeffect of PVP-K90 and PVCap on methane hydrate dissociation below ice point[J]. Fuel, 2021, 286: 119491. DOI:10.1016/j.fuel.2020.119491 |
| [4] |
XIN Y, SHI Q, XU K, et al. Tensile properties of structural I clathrate hydrates: role of guest-host hydrogen bonding ability[J]. Frontiers of Physics, 2021, 16(3): 33504. DOI:10.1007/s11467-020-1031-z |
| [5] |
TARIQ M, ATILHAN M, KHRAISHEH M, et al. Experimental and DFT approach on the determination of natural gas hydrate equilibrium with the use of excess N2 and choline chloride ionicliquid as an inhibitor[J]. Energy & Fuels, 2016, 30(4): 2821-2832. |
| [6] |
CHEN H, YAN K F, CHEN Z Y, et al. Exploring guest-host interactions in gas hydrates: insights from quantum mechanics[J]. Energy & Fuels, 2021, 35(22): 18604-18614. |
| [7] |
LIU Y, OJAMÄE L. C—C stretching Raman spectra and stabilities of hydrocarbon molecules in natural gas hydrates: a quantum chemical study[J]. The Journal of Physical Chemistry A, 2014, 118(49): 11641-11651. DOI:10.1021/jp510118p |
| [8] |
SLOAN E D, KOH C A. Clathrate hydrates of natural gases[M]. 3rd ed. Boca Raton: CRC Press—Taylor & Francis Group, 2007.
|
| [9] |
CAO X X, SU Y, ZHAO J J. Stability and vibrations of guest molecules in the type Ⅱ clathrate hydrate: a first-principles study of solid phase[J]. The Journal of Physical Chemistry A, 2015, 119(27): 7063-7069. DOI:10.1021/acs.jpca.5b04470 |
| [10] |
YAN K F, CHEN H, CHEN Z Y, et al. Effect of H2O molecules on the CO2 replacement in CH4 hydrate behavior by molecular simulation[J]. Energy & Fuels, 2021, 35(9): 8126-8140. |
| [11] |
GUTT C, ASMUSSEN B, PRESS W, et al. The structure of deuterated methane-hydrate[J]. The Journal of Chemical Physics, 2000, 113(11): 4713-4721. DOI:10.1063/1.1288789 |
| [12] |
MCDONALD S, OJAMÄE L, SINGER S J. Graph theoretical generation and analysis of hydrogen-bonded structures with applications to the neutral and protonated water cube and dodecahedral clusters[J]. The Journal of Physical Chemistry A, 1998, 102(17): 2824-2832. DOI:10.1021/jp9803539 |
| [13] |
LIU Y, OJAMÄE L. CH-stretching vibrational trends in natural gas hydrates studied by quantum-chemical computations[J]. The Journal of Physical Chemistry C, 2015, 119(30): 17084-17091. DOI:10.1021/acs.jpcc.5b01903 |
| [14] |
ZHAO Y, TRUHLAR D G. The M06 suite of density functionals for main group thermochemistry, thermochemical kinetics, noncovalent interactions, excited states, and transition elements: two new functionals and systematictesting of four M06-class functionals and 12 other functionals[J]. Theoretical Chemistry Accounts, 2008, 120: 215-241. DOI:10.1007/s00214-007-0310-x |
| [15] |
WEN J, ZHANG Y S, ZHOU W R, et al. Molecular mechanism of the clathrate cage formation in structure-Ⅱ cyclopentane hydrate: an ab initio study[J]. The Journal of Chemical Thermodynamics, 2020, 143: 106063. DOI:10.1016/j.jct.2020.106063 |
| [16] |
LIU J X, HOU J, XU J F, et al. Ab initio study of the molecular hydrogen occupancy in pure H2 and binary H2-THF clathrate hydrates[J]. International Journal of Hydrogen Energy, 2017, 42(27): 17136-17143. DOI:10.1016/j.ijhydene.2017.06.025 |
| [17] |
LIU J X, YAN Y J, XU J F, et al. Replacement micro-mechanism of CH4 hydrate by N2/CO2 mixture revealed by ab initio studies[J]. Computational Materials Science, 2016, 123: 106-110. DOI:10.1016/j.commatsci.2016.06.025 |
| [18] |
XU C G, YAN R, FU J, et al. Insight into micro-mechanism of hydrate-based methane recovery and carbon dioxide capture from methane-carbon dioxide gas mixtures with thermal characterization[J]. Applied Energy, 2019, 239: 57-69. DOI:10.1016/j.apenergy.2019.01.087 |







