2. 维尔利环保科技集团股份有限公司, 常州 213125
2. WELLE Environmental Group Co., Ltd., Changzhou 213125, China
沼气是可再生清洁能源的一种,开发沼气的多种应用可有效解决我国面临的环境污染和能源危机等问题[1-3]。然而沼气中大量存在的CO2导致其热值偏低,限制了其应用,因此非常有必要对沼气进行脱碳处理以提高其热值。
目前应用较为广泛的沼气脱碳方法主要有高压水洗法、化学吸收法、膜分离法及变压吸附法等[4-7]。其中乙醇胺(MEA)化学吸收法以其脱碳率高、可常压操作、CH4损失极低等优点得到广泛应用,但存在解吸过程能耗高的缺陷[8-10]。MEA-乙醇溶液具有良好的解吸性能,根据文献[11],MEA-乙醇的最佳解吸温度比MEA-水溶液低20 ℃左右,因此引入MEA-乙醇溶液可以有效降低解吸能耗。MEA化学吸收法脱碳的解吸技术多以汽提法为主,但该技术工艺复杂,会导致吸收剂浓度的变化以及MEA的高温降解,且由于富液在反应器中的停留时间较短从而导致解吸不彻底。批式解吸工艺则可以自由控制解吸时间,解吸时间的延长能够有效地提高解吸程度,从而降低吸收过程的溶液用量。出于经济性考虑,实际沼气脱碳应用中必须做到MEA的循环利用,因此富液解吸过程是极为重要的环节,而目前大部分的化学吸收脱碳研究都集中在吸收方面,针对解吸的研究较少。
用于MEA化学吸收脱碳的吸收传质设备以传统塔器为主,但传统塔器占据空间大、投资成本高、传质效率不高。超重力反应器(RPB)是一种强化传质的反应设备,通过电机带动转子高速旋转产生数百倍重力场的离心力场,在强大的离心力场中液相流体被切割为微米级的微粒以极大的速度通过填料,增大气液传质面积从而提高了传质效率[12-14]。在沼气脱碳中引入超重力反应器可以有效减少工程实践中的设备投资和设备占地面积,还可以提高传质效率,减少吸收剂的循环量。但将超重力反应器用于沼气脱碳的研究目前并不多见。
本文旨在研究将超重力反应器吸收和批式解吸工艺结合用于沼气脱碳的效果。在中试规模下进行超重力反应器用于脱碳的吸收传质性能实验,重点研究了操作参数变化对传质性能的影响,发现超重力反应器具有良好的脱碳效果,可代替传统塔器,大幅减少工程上的设备占地和设备投资;首次将批式解吸工艺应用于沼气脱碳,重点研究了中试规模下加热器用于MEA-乙醇溶液的批式解吸性能,发现MEA-乙醇溶液的批式解吸性能良好,采用批式解吸工艺长期运行不会改变溶液的性质,且可以使溶液解吸得更加彻底,减少溶液用量。
1 实验部分 1.1 实验原理MEA化学吸收法通过MEA与CO2进行反应将沼气中的CO2脱除[15-16]。MEA与CO2的反应是一个可逆反应,总反应式可写作
| $ \begin{aligned} &2 \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{2} \mathrm{OH}+\mathrm{CO}_{2}=\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NHOHCOO}^{-}+ \\ &\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{3}^{+} \mathrm{OH} \end{aligned} $ | (1) |
该反应可以分为两步,第一步是两性离子的生成反应,反应式如下。
| $ \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{2} \mathrm{OH}+\mathrm{CO}_{2}=\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{2}^{+} \mathrm{COO}^{-} \mathrm{OH} $ | (2) |
接下来是两性离子的去质子化反应,反应式如下。
| $ \begin{aligned} \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{2}^{+} \mathrm{COO}^{-} \mathrm{OH}+\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{2} \mathrm{OH} =\\ \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NHOHCOO}^{-} +\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{NH}_{3}^{+} \mathrm{OH} \end{aligned} $ | (3) |
在高温下,发生上述反应的逆反应。
1.2 实验材料与设备N2、CO2,纯度均为99.99%,南京特种气体厂;乙醇胺、无水乙醇,分析纯,上海麦克林生化科技有限公司。
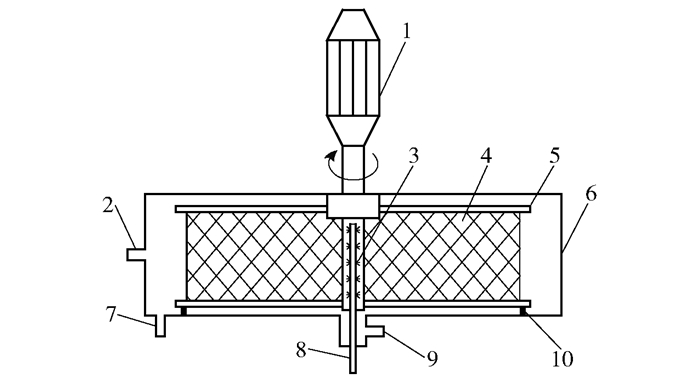
逆流填充式超重力反应器,实验室自行设计,南京亨格水处理有限公司生产,其结构示意图如图 1所示;加热器,实验室自行设计,安徽天马环保装备有限公司生产;浮子流量计,H250型,科隆公司;在线沼气分析仪,H9010型,武汉四方光电有限公司。
|
1—电机;2—气体进口;3—液体分布管;4—填料;5—转子;6—外壳;7—液体出口;8—液体进口;9—气体出口;10—密封。 图 1 超重力反应器示意图 Fig.1 Structure of the counter-current RPB reactor |
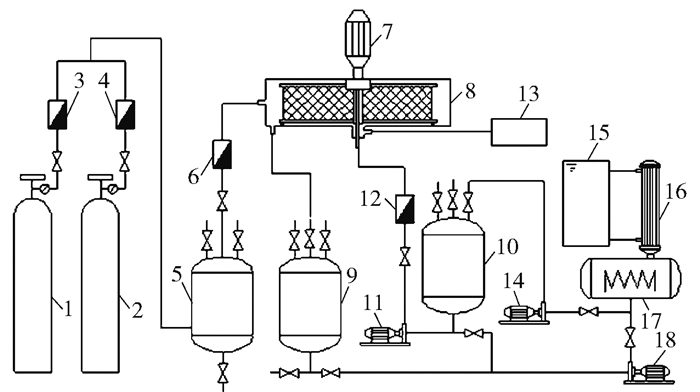
沼气中含有大量甲烷,属危险气体,本文实验以N2和CO2配制模拟沼气来代替真实沼气,由于N2无法与MEA发生反应,可以作为CH4的替代品进行实验研究。本文实验分为吸收实验、解吸实验和吸收解吸循环实验3个部分,实验系统示意图见图 2,实物图见图 3、4。吸收实验在超重力反应器中进行。通过调节CO2和N2的流量配制成不同CO2浓度的模拟沼气,模拟沼气先进入缓冲罐进行稳压和混匀,然后经过进气流量计进入超重力反应器;溶液存放在贫液罐,由泵经过进液流量计输送入超重力反应器,气体和液体在超重力反应器中逆流接触进行传质;完成传质后,富液依靠重力流入富液罐,气体则进入在线沼气分析仪进行成分测定。吸收实验研究进气量、进气CO2含量、进液量、进液MEA含量及转子转速对传质效果的影响,传质效果则通过产品气CO2含量、CO2去除率和富液CO2负荷来反映,实验条件为常温常压(25 ℃,0.1 MPa)。
|
1—CO2气体;2—N2气体;3—CO2流量计;4—N2流量计;5—缓冲罐;6—进气流量计;7—变频电机;8—超重力反应器;9—富液罐;10—贫液罐;11,14,18—泵;12—进液流量计;13—在线沼气分析仪;15—冷却水箱;16—冷凝器;17—加热器。 图 2 MEA-乙醇化学吸收法用于沼气脱碳的实验系统示意图 Fig.2 Experimental system schematic diagram of MEA- ethanol chemical absorption for biogas CO2 removal |

|
图 3 超重力反应器实物图 Fig.3 View of the RPB |

|
图 4 加热器装置实物图 Fig.4 View of the heater |
解吸实验采用批式解吸工艺,在加热器中进行。批式解吸工艺是指吸收、解吸分开进行的工艺。将一定量的吸收剂先进行CO2的吸收,待全部吸收剂完成吸收后再进入反应器中解吸,解吸完成后再次进行吸收,吸收、解吸过程轮流进行。与连续式解吸工艺相比,批式解吸工艺可以自由控制解吸时间,克服连续式解吸工艺由于富液在反应器中停留时间短而解吸不彻底的缺点,并且可以通过引入多组贫、富液罐实现连续运行。解吸工艺中,最初的富液存放在富液罐中,利用泵将富液全部打入加热器,设定加热温度,对富液进行加热,解吸过程中释放的CO2经过冷凝器排出,冷凝器将部分汽化的溶液冷凝回流到加热器。解吸实验研究溶液MEA含量和解吸时间对解吸性能的影响,解吸对象为CO2负荷0.44~0.46 mol/mol的富液。已知最佳解吸温度是溶液的沸腾温度[11],因此本文实验的解吸温度固定为80 ℃。
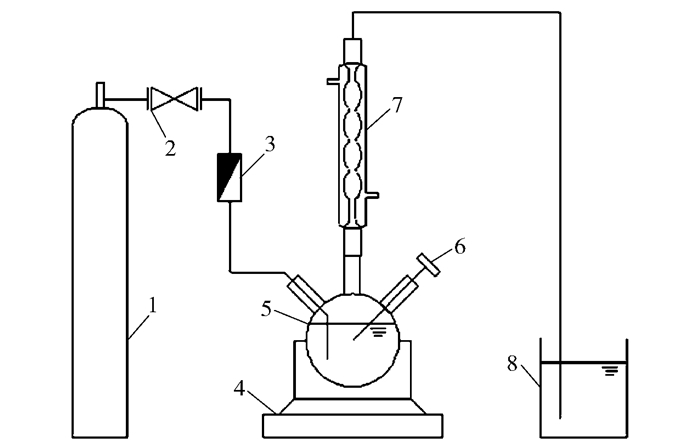
富液CO2负荷表示为单位MEA吸收的CO2量(mol/mol),其测定系统如图 5所示,实物图见图 6。测定时,将烧瓶置于天平上,取质量为m的富液放入烧瓶,向富液中通入CO2,直至天平示数不再变化,记录示数n。根据前期的小试实验[11]可知固定溶液浓度的最大CO2负荷是一定的,设被测定富液的最大负荷为d,则可根据上述数据通过式(4)计算出富液负荷D。
| $ D=\frac{m(61+44 d)-61 n}{44 n} $ | (4) |
|
1—CO2气体;2—CO2减压阀;3—CO2流量计;4—电子天平;5—烧瓶;6—温度探头;7—冷凝器;8—废气处理液。 图 5 CO2负荷测定系统 Fig.5 Schematic of the CO2 loading determination system |

|
图 6 CO2负荷测定装置实物图 Fig.6 View of the CO2 loading determination system |
通过吸收-解吸多次循环实验研究前述吸收实验和解吸实验确定的最佳参数下的吸收-解吸循环性能。实验中需要调控的参数有进气量、进液量、进液MEA浓度、进气CO2含量、超重力反应器转速以及加热时间;需要测定的参数有气体CO2含量、CO2去除率、富液CO2负荷以及加热器电耗。本文中的气量均在常温常压(0.1 MPa、25 ℃)下测定;气相CO2含量通过在线沼气分析仪测量;CO2去除率通过进出气CO2差量计算;富液CO2负荷通过前文介绍方法测量;加热器电耗通过电表直接测量,解吸能耗通过加热器电耗反映,单位解吸能耗表示为释放单位质量CO2的能耗(kJ/kg)。
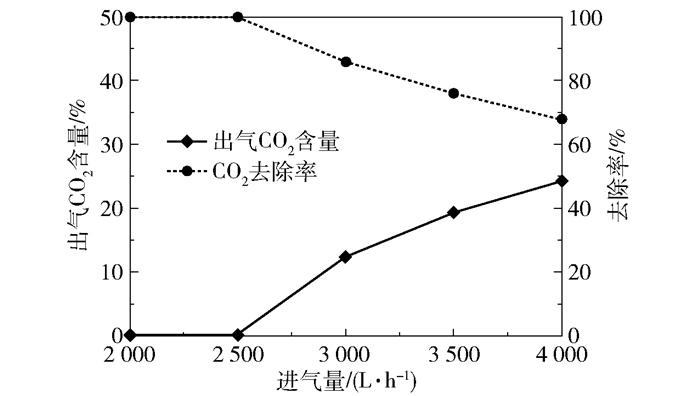
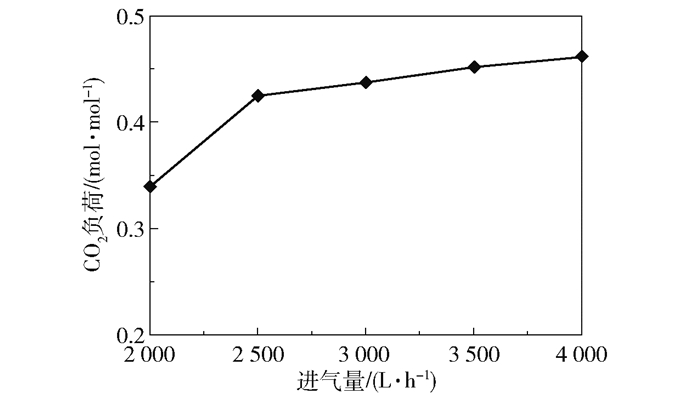
2 结果与讨论 2.1 吸收性能 2.1.1 进气量的影响在进液量40 L/h、进液MEA浓度3.28 mol/L、进气CO2含量(体积分数,下同)50%、转子转速1 000 r/min、进气量2 000~4 000 L/h的实验条件下,产品气CO2含量和CO2去除率随进气量的变化趋势如图 7所示,富液CO2负荷的变化趋势如图 8所示。
|
图 7 产品气CO2含量和CO2去除率随进气量的变化趋势 Fig.7 Trends of product gas CO2 content and CO2 removal rate with the gas flow rate |
|
图 8 富液CO2负荷随进气量的变化趋势 Fig.8 Trends of rich solution CO2 loading with the gas flow rate |
可以看出当进气量低于2 500 L/h时,CO2去除率接近100%,产品气CO2含量接近于0,富液负荷在0.33~0.43 mol/mol之间;当进气量增长到4 000 L/h时,产品气CO2含量增长到24.32%,CO2去除率下降至68.12%,富液负荷增长到0.46 mol/mol。这是因为在进液相关参数(进液量与进液MEA含量)恒定、超重力反应器转速固定的情况下,进入超重力反应器的MEA量以及气液流动状态均不变,能够吸收的CO2量是一定的,进气量变大,进入反应器的CO2总量随之增大,而可吸收的CO2量一定,导致产品气CO2含量上升;进气量的增大使得反应器内气速增加,从而加剧超重力反应器内的气液接触,有利于传质,单位量的MEA能够吸收更多的CO2,因此富液负荷随之上升。
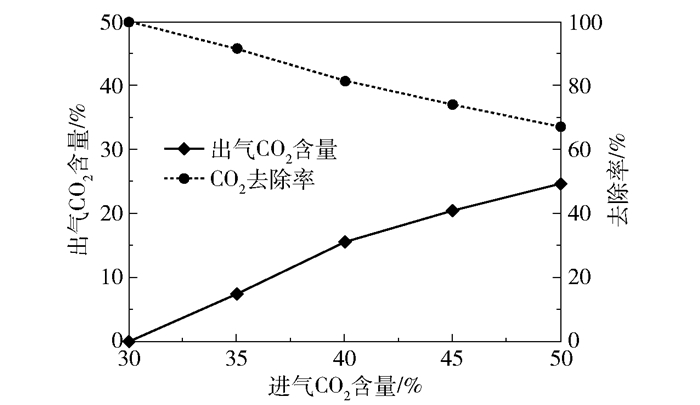
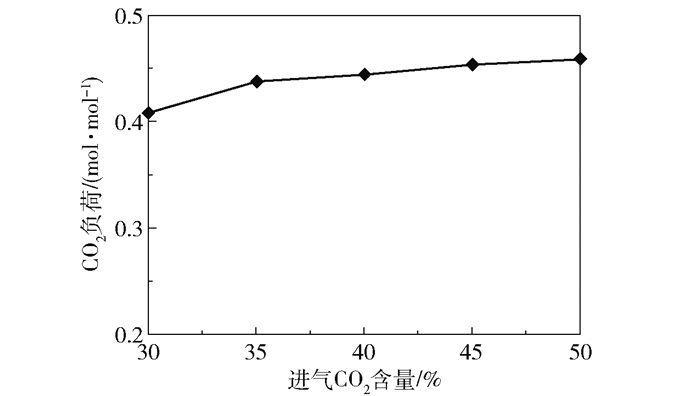
2.1.2 进气CO2含量的影响在进气量4 000 L/h、进液量40 L/h、进液MEA浓度3.28 mol/L、转子转速1 000 r/min、进气CO2含量30%~50%的实验条件下,产品气CO2含量和CO2去除率随进气CO2含量的变化趋势如图 9所示,富液CO2负荷的变化趋势如图 10所示。当进气CO2含量为30%时,CO2去除率接近100%、产品气CO2含量接近于0,富液负荷为0.41 mol/mol;当进气CO2含量增长到50%时,产品气CO2含量增长至24.66%,CO2去除率下降至66.84%,富液负荷增长至0.46 mol/mol。产品气CO2含量和CO2去除率随进气CO2含量变化的原因与进气量的影响相类似,在该组实验条件下进入反应器的MEA量恒定,进气CO2含量的升高使得进入反应器的CO2总量升高,而可吸收的CO2量不变,因此会带来产品气CO2含量的升高;富液负荷升高是因为进气CO2含量的升高使得CO2分压升高,根据亨利定律会有更多的CO2溶解在溶液中被MEA吸收。
|
图 9 产品气CO2含量和CO2去除率随进气CO2含量的变化趋势 Fig.9 Trends of product gas CO2 content and CO2 removal rate with inlet CO2 content |
|
图 10 富液CO2负荷随进气CO2含量的变化趋势 Fig.10 Trends of rich solution CO2 loading with inlet CO2 content |
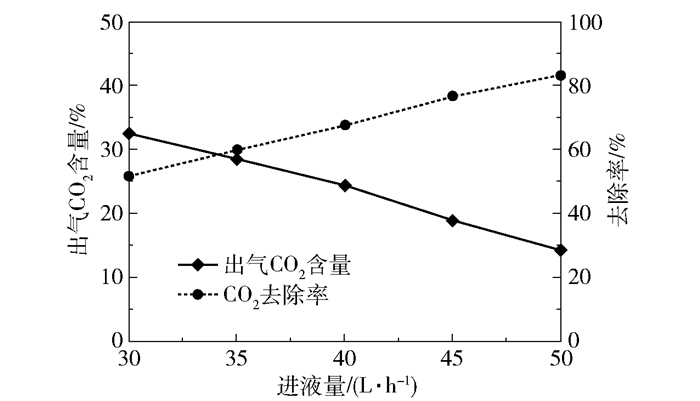
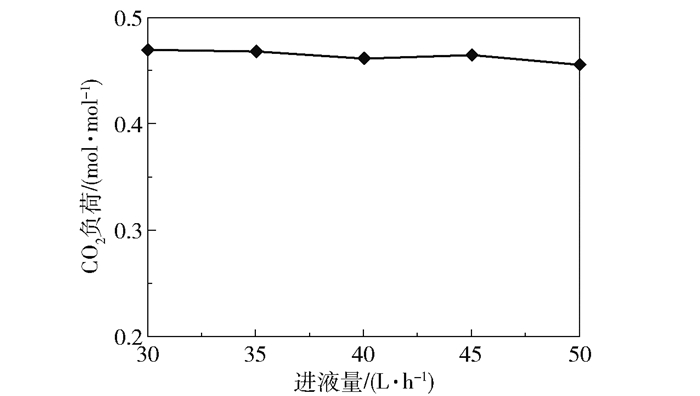
在进气量4 000 L/h、进液MEA浓度3.28 mol/L、转子转速1 000 r/min、进气CO2含量50%、进液量30~50 L/h的实验条件下,产品气CO2含量和CO2去除率随进液量的变化趋势如图 11所示,富液CO2负荷的变化趋势如图 12所示。
|
图 11 产品气CO2含量和CO2去除率随进液量的变化趋势 Fig.11 Trends of product gas CO2 content and CO2 removal rate with liquid flow rate |
|
图 12 富液CO2负荷随进液量的变化趋势 Fig.12 Trends of rich solution CO2 loading with liquid flow rate |
当进液量为30 L/h时,产品气CO2含量为32.64%、CO2去除率为52.24%、富液负荷为0.47 mol/mol;当进液量为50 L/h时,产品气CO2含量下降至14.22%,CO2去除率上升至83.46%,富液负荷为0.46 mol/mol。在气相相关参数(进气量、进气CO2含量)且转子转速恒定的情况下,进入超重力反应器的CO2量及气液流动状态不变,进液量的增大导致进入反应器的MEA量增加,使吸收的CO2量增多,因此产品气CO2含量下降;进液量的增大使得液速提高,溶液在超重力反应器内停留时间变短,CO2吸收量降低,但在转子的高速旋转下溶液的停留时间本已很短,进液量增大造成的影响基本可以忽略,因此富液负荷只是稍有下降但变化不大。
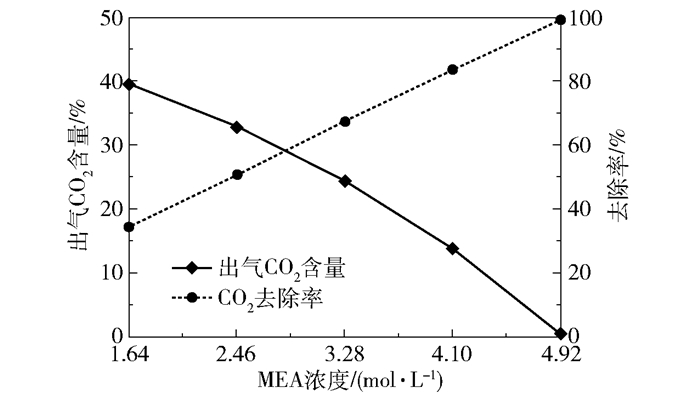
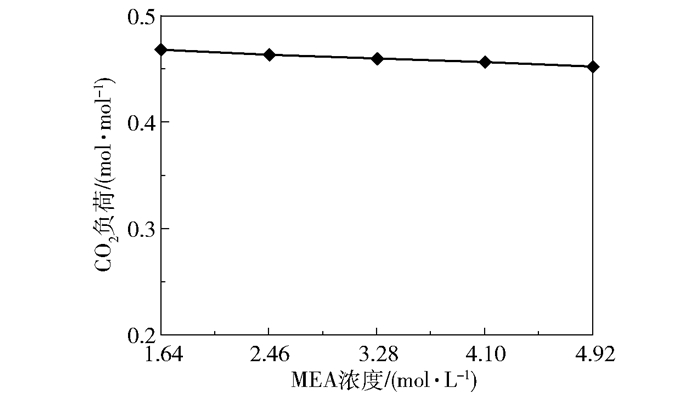
2.1.4 进液MEA含量的影响在进气量4 000 L/h、转子转速1 000 r/min、进气CO2含量50%、进液量40 L/h、进液MEA浓度1.64~4.92 mol/L的实验条件下,产品气CO2含量和CO2去除率随进液MEA浓度的变化趋势如图 13所示,富液CO2负荷的变化趋势如图 14所示。
|
图 13 产品气CO2含量和CO2去除率随进液MEA浓度的变化趋势 Fig.13 Trends of product gas CO2 content and CO2 removal rate with MEA concentration |
|
图 14 富液CO2负荷随进液MEA浓度的变化趋势 Fig.14 Trends of rich solution CO2 loading with MEA concentration |
在MEA含量为1.64 mol/L时,产品气CO2含量为39.61%、CO2去除率为34.36%、富液负荷为0.47 mol/mol;在MEA含量为4.92 mol/L时,产品气CO2含量下降至0.52%,CO2去除率上升至99.91%,富液负荷下降至0.45 mol/mol。产品气CO2含量与CO2去除率随进液MEA浓度变化的原因与进液量对脱碳性能的影响类似:MEA含量上升导致溶液黏度增大,阻碍了CO2与MEA之间的传质反应,导致CO2的吸收量有所降低,因此富液负荷缓慢下降。不同浓度MEA-乙醇溶液的黏度如表 1所示。
| 下载CSV 表 1 不同浓度溶液的黏度 Table 1 Viscosity of MEA-ethanol solutions with different concentrations |
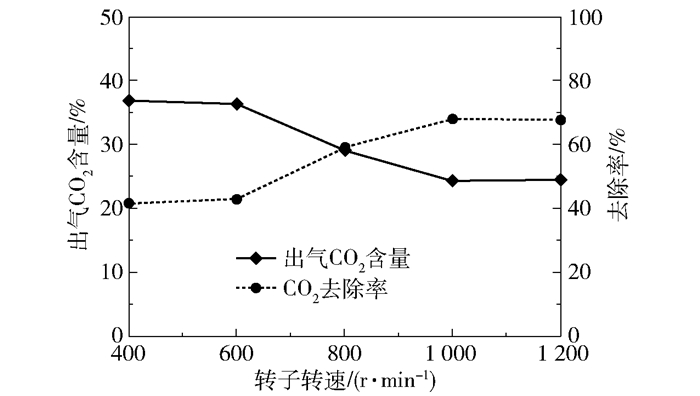
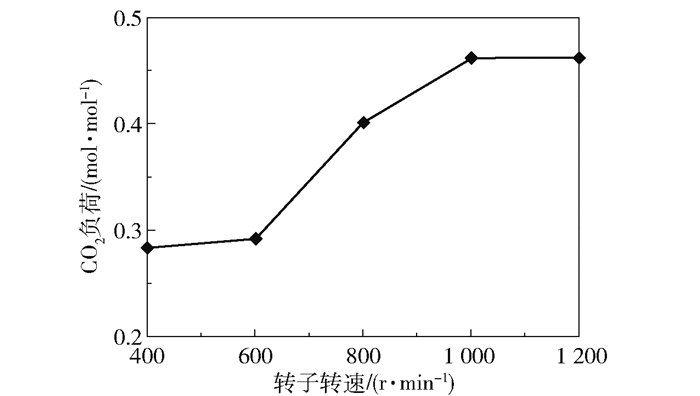
在进气量4 000 L/h、进气CO2含量50%、进液量40 L/h、进液MEA浓度3.28 mol/L、转子转速400~1 200 r/min的实验条件下,产品气CO2含量和CO2去除率随转子转速的变化趋势如图 15所示,富液CO2负荷的变化趋势如图 16所示。
|
图 15 产品气CO2含量和CO2去除率随转子转速的变化趋势 Fig.15 Trends of product gas CO2 content and CO2 removal rate with rotational speed |
|
图 16 富液CO2负荷随转子转速的变化趋势 Fig.16 Trends of rich solution CO2 loading with rotational speed |
当转速为400~600 r/min时,产品气CO2含量为36.38%~36.81%、CO2去除率为41.75%~43.46%、富液负荷在0.28 mol/mol左右;当转速提高到1 000~1 200 r/min时,产品气CO2含量下降并最终稳定在24.38%左右,CO2去除率上升并最终稳定在68.36%左右,富液负荷上升且最终稳定在0.46 mol/mol左右。这主要是由于在400~600 r/min的较低转速下,溶液不能被有效地打碎成细小的微粒,影响了与气体间的传质,所以传质效果较差;当转速提高至1 000 r/min时,溶液在高速旋转的填料的作用下被有效地剪切成细小微粒,附着在填料上的液膜也进一步变薄,极大地增强了气液间的传质作用;当转速提高到1 200 r/min时,由于液体停留时间变短对传质造成的不利影响与液滴变小、液膜变薄带来的有利影响相互抵消,脱碳性能趋于稳定。
通过上述分析可知,最佳转速为1 000 r/min,此时当进入超重力反应器的CO2与MEA的物质的量比小于0.4时,可以达到产品气CO2含量接近0的脱碳效果。
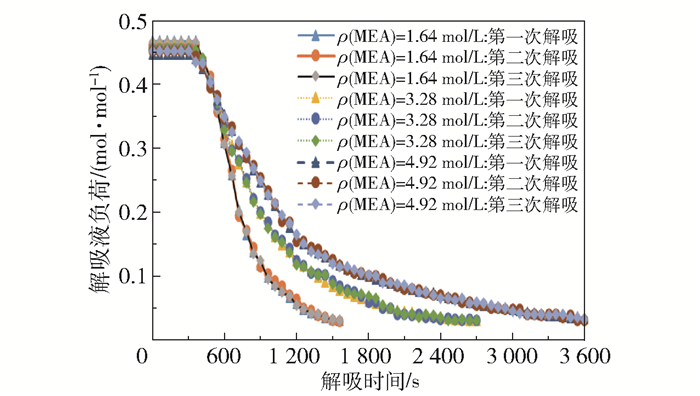
2.2 解吸性能制取MEA浓度为1.64、3.28、4.92 mol/L,CO2负荷0.44~0.46 mol/mol的MEA-乙醇富液,对富液进行0~90 min的解吸,测定不同解吸时间下的解吸液CO2负荷,并用不同解吸时间的解吸液进行吸收实验,实验条件为进气量3 000 L/h,进气CO2含量50%,超重力反应器转子转速1 000 r/min,进液量40 L/h。
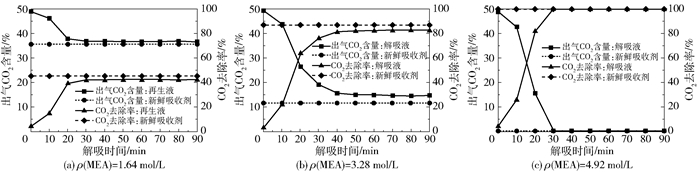
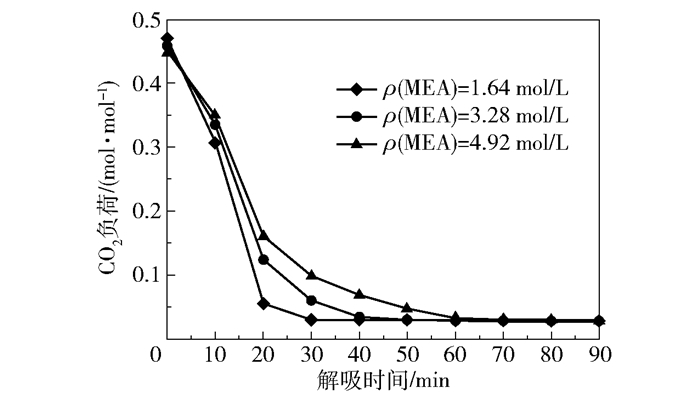
不同MEA浓度、不同解吸时间的解吸液用于沼气脱碳的产品气CO2含量和CO2去除率如图 17所示,解吸液CO2负荷如图 18所示。可以看出随着解吸时间的延长解吸效果显著提高,而解吸效果趋于稳定所需时间随着MEA浓度的升高而增加。新鲜吸收剂(即未经过解吸的MEA- 乙醇溶液)与解吸液的最低产品气CO2含量和最高CO2去除率十分接近,解吸液的CO2负荷最低可达到0.03 mol/mol。现有的连续式解吸工艺的解吸液负荷一般在0.20~0.25 mol/mol左右[17],相比于连续式解吸工艺,批式解吸工艺富液的解吸程度更加彻底。这是因为在连续式解吸工艺中,反应器中的富液温度并非均在最佳解吸温度下,而且富液流速要与吸收剂循环流速相匹配,因此富液在反应器中的停留时间较短。在本课题组的小试研究中发现,富液的解吸需要一定的反应时间[11],如果停留时间不够长则会影响解吸效果。在批式解吸过程中,加热器中的富液一直处于高温沸腾的状态,即持续保持在最佳解吸温度下,而且可以自由控制解吸时间,因此能够获得较好的解吸效果。
|
图 17 不同MEA浓度下不同解吸时间的解吸液脱碳效果 Fig.17 CO2 removal performance of desorption solutions with different MEA concentration and desorption time |
|
图 18 不同MEA浓度下不同解吸时间的解吸液CO2负荷 Fig.18 CO2 loading of desorption solution with different MEA concentration and desorption time |
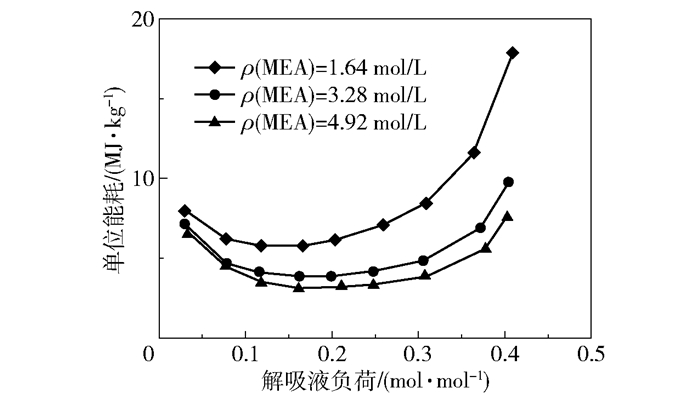
单位解吸能耗与解吸液CO2负荷的关系曲线见图 19。随着解吸的进行,在解吸液负荷逐渐降低的过程中,单位解吸能耗先降低后升高,且随着MEA浓度的升高单位能耗逐渐降低。在MEA浓度4.92 mol/L、解吸液负荷约0.16 mol/mol时,单位能耗达到最低,约为3.17 MJ/kg,解吸时间为20 min。
|
图 19 单位解吸能耗与解吸液负荷的关系曲线 Fig.19 Relationship between unit desorption energy consumption and desorption solution loading |
实验发现解吸时间与解吸液负荷D呈对应关系,如图 20所示。经过实验数据的拟合,本文解吸实验的解吸时间与解吸液负荷的关系可用式(5)描述。
| $ t=600242 D^{4}-699035 D^{3}+294574 D^{2}- \\ 56059 D+5096.8 $ | (5) |
|
图 20 解吸时间与解吸液负荷的对应关系 Fig.20 Relationship between desorption time and desorption solution loading |
式中,t为解吸时间,s。
加热器批式解吸工艺可以通过控制解吸时间得到一定负荷的解吸液。根据单位解吸能耗可以确定解吸阶段的最佳操作参数为MEA浓度4.92 mol/L,解吸时间20 min。
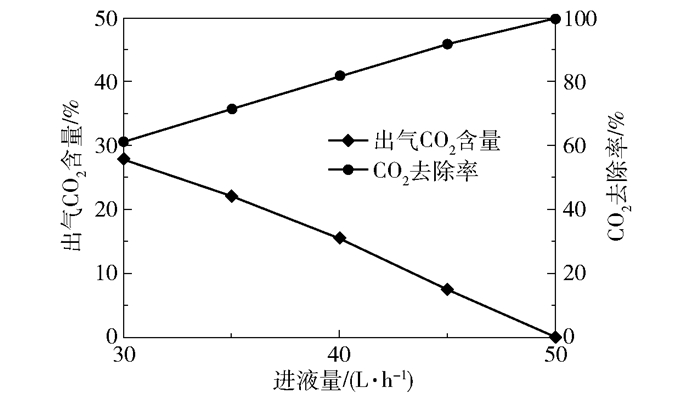
2.3 吸收-解吸循环性能制备CO2负荷约为0.16 mol/mol、MEA浓度4.92 mol/L的解吸液,在进气量3 000 L/h、进气CO2含量50%、转子转速1 000 r/min的条件下进行不同进液量的吸收实验,结果如图 21所示。可以看出当进液量大于50 L/h时,CO2可基本上被完全去除。
|
图 21 解吸液脱碳性能 Fig.21 CO2 removal performance of the desorption solution |
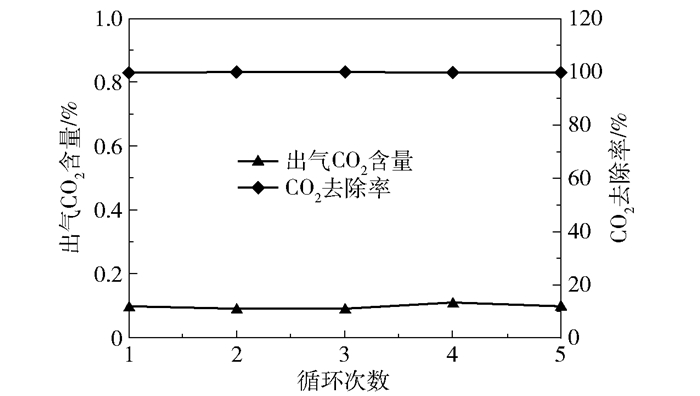
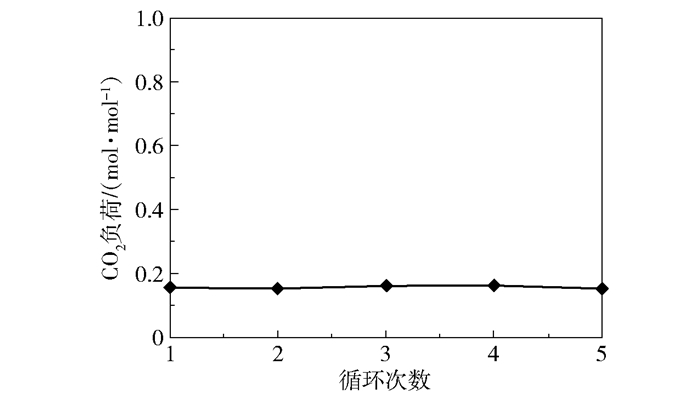
设置实验条件为进气量3 000 L/h、进气CO2含量50%、转子转速1 000 r/min、进液量40 L/h(初次吸收)和50 L/h(循环吸收)、进液MEA浓度4.92 mol/L、加热器解吸时间20 min、循环次数为5次,进行吸收-解吸循环实验。5次循环的解吸液脱碳性能如图 22所示,解吸液CO2负荷如图 23所示。
|
图 22 不同循环次数解吸液的脱碳性能 Fig.22 CO2 removal performance of the desorption solution with different cycle times |
|
图 23 不同循环次数解吸液的CO2负荷 Fig.23 CO2 loading of the desorption solution with different cycle times |
可以看出5次循环实验的结果几乎没有差别,产品气CO2含量均在0.1%左右,CO2去除率均在99.99%左右,再生液CO2负荷均在0.16 mol/mol左右。在本文体系中不含O2,不存在MEA的氧化降解,再生温度在80 ℃左右,不存在MEA的高温降解,基于以上原因,循环次数的增加不会带来溶液性质的恶化。
3 结论(1) 将超重力反应器吸收和批式解吸用于MEA- 乙醇溶液的沼气脱碳,取得了良好的脱碳及解吸性能。超重力反应器用于沼气脱碳可以使产品气CO2含量降至接近于0。进液量、进液MEA含量及转速的升高,和进气量、进气CO2含量的降低,均会使脱碳性能增强,但在转速小于600 r/min、大于1 000 r/min时脱碳性能变化不大。最佳的旋转床转速为1 000 r/min,此时若进入超重力反应器的总CO2摩尔分数(与总MEA相比)小于0.4可使产品气CO2含量接近0。
(2) MEA-乙醇溶液的批式解吸工艺可以使解吸液负荷最低达到0.03 mol/mol,单位解吸能耗最低为3.17 MJ/kg。随着解吸时间的延长解吸效果越来越好,单位解吸能耗随解吸液负荷的降低先降低后升高,随着溶液浓度的升高而降低。批式解吸工艺可以通过控制解吸时间准确地控制解吸液负荷。
(3) MEA-乙醇溶液的脱碳效果不会随着吸收-解吸循环次数的增加而恶化,在相同条件下进行多次循环实验,其脱碳效果基本不发生变化。
| [1] |
TOLEDO-CERVANTES A, ESTRADA J M, LEBRERO R, et al. A comparative analysis of biogas upgrading technologies: photosynthetic vs physical/chemical processes[J]. Algal Research, 2017, 25: 237-243. DOI:10.1016/j.algal.2017.05.006 |
| [2] |
AUGELLETTI R, GALLI S, GISLON P, et al. Biogas upgrading through CO2 removal by chemical absorption in an amine organic solution: physical and technical assessment, simulation and experimental validation[J]. Biomass and Bioenergy, 2020, 141: 105729. DOI:10.1016/j.biombioe.2020.105729 |
| [3] |
GU L, ZHANG Y X, WANG J Z, et al. Where is the future of China's biogas? Review, forecast, and policy implications[J]. Petroleum Science, 2016, 13: 604-624. DOI:10.1007/s12182-016-0105-6 |
| [4] |
DUBEY R, GUNASEKARAN A, PAPADOPOULOS T, et al. Sustainable supply chain management: framework and further research directions[J]. Journal of Cleaner Production, 2017, 142: 1119-1130. DOI:10.1016/j.jclepro.2016.03.117 |
| [5] |
BOONS F, MONTALVO C, QUIST J, et al. Sustainable innovation, business models and economic performance: an overview[J]. Journal of Cleaner Production, 2013, 45: 1-8. DOI:10.1016/j.jclepro.2012.08.013 |
| [6] |
KADAM R, PANWAR N L. Recent advancement in biogas enrichment and its applications[J]. Renewable and Sustainable Energy Reviews, 2017, 70: 892-903. |
| [7] |
ANDRIANI D, WRESTA A, ATMAJA T D, et al. A review on optimization, production and upgrading biogas through CO2 removal using various techniques[J]. Applied Biochemistry and Biotechnology, 2014, 172: 1909-1928. DOI:10.1007/s12010-013-0652-x |
| [8] |
LUIS P. Use of monoethanolamine (MEA) for CO2 capture in a global scenario: consequences and alternatives[J]. Desalination, 2016, 380: 93-99. DOI:10.1016/j.desal.2015.08.004 |
| [9] |
OKO E, WANG M H, JOEL A S. Current status and future development of solvent-based carbon capture[J]. International Journal of Coal Science & Technology, 2017, 4(1): 5-14. |
| [10] |
BOUGIE F, POKRAS D, FAN X F. Novel non-aqueous MEA solutions for CO2 capture[J]. International Journal of Greenhouse Gas Control, 2019, 86: 34-42. DOI:10.1016/j.ijggc.2019.04.013 |
| [11] |
YIN L T, LI X J, ZHANG L, et al. Characteristics of carbon dioxide desorption from MEA-based organic solvent absorbents[J]. International Journal of Greenhouse Gas Control, 2021, 104: 103224. DOI:10.1016/j.ijggc.2020.103224 |
| [12] |
FANG X D, LI G H, LI D K. An experimental study of R134a flow boiling heat transfer in a 4.07 mm tube under earth's gravity and hypergravity[J]. International Journal of Heat and Mass Transfer, 2015, 87: 399-408. DOI:10.1016/j.ijheatmasstransfer.2015.04.027 |
| [13] |
YANAGIDA R, OGAWA Y, UEDA K, et al. Sustained mild hypergravity reduces spontaneous cardiac baroreflex sensitivity[J]. Autonomic Neuroscience: Basic and Clinical, 2014, 185(15): 123-128. |
| [14] |
杨致芬, 郭春绒. 超重力技术研究进展[J]. 安徽农业科学, 2008, 36(20): 8432-8435. YANG Z F, GUO C R. Research progress of high gravity technology[J]. Journal of Anhui Agricultural Sciences, 2008, 36(20): 8432-8435. (in Chinese) DOI:10.3969/j.issn.0517-6611.2008.20.016 |
| [15] |
DANCKWERTS P V. The reaction of CO2 with ethanolamines[J]. Chemical Engineering Science, 1979, 34(4): 443-446. DOI:10.1016/0009-2509(79)85087-3 |
| [16] |
BLAUWHOFF P M M, VERSTEEG G F, VAN SWAAIJ W P M. A study on the reaction between CO2 and alkanolamines in aqueous solutions[J]. Chemical Engineering Science, 1984, 39(2): 207-225. DOI:10.1016/0009-2509(84)80021-4 |
| [17] |
李虎. 乙醇胺吸收沼气中高浓度CO2的传质性能及工艺优化[D]. 北京: 北京科技大学, 2017. LI H. Mass transfer performance and process optimization of CO2 absorption by monoethanolamines for biogas purification[D]. Beijing: University of Science and Technology Beijing, 2017. (in Chinese) |








