2. 北京理工大学 爆炸科学与技术国家重点实验室, 北京 100081
2. State Key Laboratory of Explosion Science and Technology, Beijing Institute of Technology, Beijing 100081, China
脂肪族聚酯是由二元醇和二元羧酸发生缩聚反应而生成的一类高分子聚合物,具有可水解的酯键结构,是一种可生物降解的材料,在纤维、农业、组织支架、包装材料及药物递送系统等领域有广泛的应用。目前,脂肪族聚酯主要通过化学聚合法合成,使用如锰、锌、钙、钴、镁等金属元素的乙酸盐、氧化锑和氧化钛等材料作为催化剂[1],反应温度通常高于180 ℃。高温不适用于热不稳定或化学不稳定的单体和官能团(如碳碳双键),可能会导致一系列副反应的发生,如凝胶化、分解、变色等反应[2-3]。此外,当聚酯应用于生物医用材料时,金属催化剂的残留物会对人体造成不利影响。
生物酶催化聚合是近年发展起来的一种新的聚合方法,生物酶催化剂为提高生物基聚合物的性能和价值提供了机会,很多不同结构的生物基单体已经可以通过发酵或化学转化进行工业化规模生产,所得的可降解产品(如聚乳酸等)有望减轻化石基聚合物(如塑料)对环境的不利影响。与化学法相比,生物酶催化法有以下优点[4]:1)酶催化反应的条件温和,对热不稳定的官能团(如酚羟基、醛基和碳碳双键等)具有保护作用;2)具有立体选择性、区域选择性和化学选择性[5];3)酶经过固定化处理后,具有可重复利用性,可降低应用成本[6];4)可在无溶剂体系下反应,避免后续有机溶剂的分离所带来的成本和污染[7];5)酶催化合成的聚酯的分子量分布均匀,多分散性指数(PDI)较低(接近1);6)脂肪酶本身无毒,不含重金属,且合成的聚酯能被人体降解,可满足生物医用材料的要求。因此,酶催化聚合反应越来越受到人们的关注,成为近年来的研究热点之一。
脂肪酶是应用广泛的一类催化聚合酶,除了可以催化长链酯键的水解,生成甘油、脂肪酸以及甘油单酯和二酯外,脂肪酶还可以催化酯合成、酯聚合、酯交换及酰胺合成等反应,其中聚酯和聚酰胺是脂肪酶可以催化聚合的两类重要聚合物。在酶催化合成脂肪族聚酯中,主要通过3种类型的反应实现:开环聚合、酯交换聚合和直接缩聚,其中直接缩聚的最大优点是底物二元羧酸和二元醇容易获得,无需经过特殊处理。本文综述了脂肪酶催化缩聚反应合成脂肪族聚酯的研究进展,介绍了脂肪酶的种类、饱和及不饱和脂肪族聚酯的酶催化合成,总结了酶催化法在聚酯合成中存在的问题并提出了相应的对策。
1 脂肪酶 1.1 脂肪酶的结构特点脂肪酶又称为三酰基甘油酰基水解酶,广泛存在于动植物及微生物细胞中。其分子量大小各异,最小的为20~25 kDa,最大的为60~65 kDa。脂肪酶的活性中心包含亲水基团和疏水基团两部分,活性中心中的丝氨酸残基靠近疏水端,因此表现为“外疏水、内亲水”的特性[6]。脂肪酶是一种典型的α/β水解酶,在活性口袋的上方有一个螺旋“盖子”,这个盖子的开启和关闭直接影响到底物能否被催化,同时也使得酶在溶解时产生多构象状态(open and closed)。通常,脂肪酶具有表面激活效应,即螺旋“盖子”在水和有机物的表面被激活而打开,这也是其区别于酯酶的重要标志。另外,脂肪酶都具有催化三联体Ser-Asp-His,它们形成质子传递链,加速了Ser与底物基团的作用。在酶蛋白的中心有一个长约25Å的“L”形疏水口袋,这是底物与酶作用的主要场所,在疏水口袋壁上共有21个氨基酸参与酶和底物的结合[8]。
1.2 脂肪酶的催化过程脂肪酶的催化过程遵循“乒乓机制”,当脂肪酶与底物作用时,覆盖活性中心的“盖子”发生移动而暴露活性中心,开启催化反应。其活性中心催化三联体中的组氨酸吸收丝氨酸上的一个质子,然后丝氨酸亲核进攻底物羰基上的碳原子,形成酶-底物复合物中间体[7],然后释放产物,释放后再结合底物继续催化反应,如此循环往复[9-10]。脂肪酶催化酯化反应的关键中间体是酶催化位点丝氨酸残基上的羟基参与形成的活性酯,生成的中间体被醇攻击后得到酯。各种羧酸、甲酯、乙烯基酯和卤代烷基酯等已被用作脂肪酶催化合成聚酯的单体[11]。
1.3 脂肪酶的种类脂肪酶的种类有很多,依据来源不同可以分为动物性脂肪酶、植物性脂肪酶和微生物性脂肪酶。由于微生物种类多、繁殖快、易发生遗传变异,因此,微生物性脂肪酶具有比动植物性脂肪酶更广的pH作用范围和反应温度范围以及更高的底物专一性。微生物来源的脂肪酶一般都是分泌性的胞外酶,主要的发酵微生物有黑曲霉(Aspergillus niger)、假丝酵母(Candida)等,它们适合工业化生产,且易于获得高纯度样品,因此微生物性脂肪酶是工业用脂肪酶的重要来源。Novozym 435酶是目前最常用的商业化的高效率固定化脂肪酶[11],由南极假丝酵母脂肪酶B(Candida antarctica lipase B,CALB)通过界面活化吸附在甲基丙烯酸树脂(Lewatit VP OC 1600)上制成[12]。
谭天伟等[13]通过对假丝酵母菌种Candida sp.99-125进行多种方式诱变,得到假丝酵母脂肪酶,经纯化,脂肪酶的比酶活可达5 035 U/mg。该脂肪酶对长链不饱和甘油酯以及长链脂肪酸(C12~C18)甲酯表现出较高的活性,可用于催化合成长链脂肪酸酯和中链甘油酯、维生素A棕榈酸酯和生物柴油,转化率均在90%以上。此外,将来源于疏棉状嗜热丝孢菌(Thermomyces lanuginosus)的脂肪酶固定化[14],制备成Lipozyme TL IM、Lipozyme RM IM等固定化酶,也可以用于催化酯化和转酯化反应[15]。
2 脂肪酶催化缩聚反应 2.1 缩聚原理缩聚反应分为低分子二元酸(或其活性酯)与二元醇的缩聚以及羟基酸(或其活性酯)的自缩聚两种。底物之间通过脱去低分子量的副产物(水或小分子醇类),形成新的酯键,从而合成高分子聚合物(图 1)。酶催化缩聚反应与水解反应之间存在竞争,因此限制了聚酯分子量的增长。在不改变聚合反应平衡的条件下,反应需要较长的时间和较大的酶量,并且得到的聚合物的分子量也较低。反应中可以通过抽真空或添加带水剂等方式不断去除小分子,以提高聚酯产物的分子量[16-17]。

|
图 1 脂肪酶催化的缩聚反应 Fig.1 Lipase-catalyzed polycondensation |
饱和脂肪族聚酯是分子结构中除了酯键外不再含有双键等不饱和键的聚酯。通过采用不同的多元酸和多元醇可以合成出不同类型、不同特性的饱和聚酯。
采用直链结构的多元醇与多元酸反应,可以得到具有线性结构的热塑性树脂,其柔韧性非常好,主要用作生活中的各种塑料,如聚丁二酸丁二醇酯(PBS)是一种典型的线性聚酯,由1, 4-丁二酸与1, 4-丁二醇缩聚而成。如果采用含有苯环的多元酸与多元醇反应,则得到含有苯环结构的聚酯,如聚对苯二甲酸乙二醇酯(PET),苯环的刚性特征赋予聚酯硬度,而苯环的稳定结构特征赋予聚酯耐化学性,因此这类聚酯可作为强度很高的纤维产品应用于军工等领域。
关于饱和聚酯酶催化合成工艺,国内外已有很多相关报道,表 1总结了脂肪酶在催化合成饱和脂肪族聚酯中的应用。可以看出,Novozym 435是最常用的催化聚酯合成的酶,反应温度通常在70~90 ℃之间,反应时间大于20 h,可以在有机溶剂或无溶剂的条件下进行反应。
| 下载CSV 表 1 脂肪酶催化饱和脂肪族聚酯的合成 Table 1 Synthesis of saturated aliphatic polyesters catalyzed by lipase |
Mahapatro等[18]使用CALB催化己二酸和1, 8-辛二醇的缩聚反应,于70 ℃反应48 h,合成了分子量为28 500的聚酯,并且发现酶催化法合成的产物的PDI比化学催化法低;将Lewatit上的CALB浓度从0.1%(CALB占Lewatit的质量分数)增加到1%时,产物的分子量略有增加;游离的CALB对聚合反应也有催化活性,但相对于其固定化形式,链增长较慢;在65~90 ℃之间,聚合反应对反应温度的依赖性很小。
Mahapatro等[19]发现脂肪酶Novozym 435可以在二苯醚中保持80%的活性;还发现较长链的二元酸(癸二酸和己二酸)和二元醇(1, 8-辛二醇和1, 6-己二醇)体系的反应活性高于短链的二元酸(丁二酸和戊二酸)和二元醇(1, 4-丁二醇)体系。
Azim等[20]以CALB为催化剂、二苯醚为溶剂,以丁二酸二乙酯和1, 4-丁二醇为原料制备了单相反应混合物,合成了数均分子量为38 000、PDI为1.39的聚酯;发现添加分子筛或减压可以在反应过程中去除小分子产物和水,提高聚酯的分子量;与短链单体相比,长链单体具有更高的反应活性。
酶催化酯化缩聚反应还可以在无溶剂体系中进行,使酶催化反应更加环保。Liu等[21]发现Candida sp.99-125产生的脂肪酶在无溶剂体系下能够有效地催化合成聚癸二酸丁二酯的缩聚反应,反应24 h可使聚合物的分子量达到15 800。该课题组还采用β-环糊精修饰聚合物分子以起到支撑作用,保持低聚物正确的链构象,避免其凝聚,从而进一步提高了聚合物产物的分子量[22]。
通过Novozym 435催化缩聚制备多元嵌段聚酯已有文献报道[25-27],所得聚酯具有很好的热塑性、可生物降解性和生物相容性。研究表明,3种或3种以上单体的聚合可以用来制备多种功能性高分子材料,比由2种单体聚合的材料具有更优秀的性能,为改善传统高分子材料的性能提供了一种很有前途的手段[25-27]。
以上介绍了一些关于饱和脂肪族聚酯的酶催化合成的研究工作,可以看出,酶催化合成聚酯的过程中反应条件十分温和,非常节约能源。但突出的一个问题是产物的分子量较小,难以进一步提升。因此如何通过酶催化的方式获得分子量更大的聚酯以满足实际需求,是目前国内外学者的一个研究重点。
2.2.3 脂肪酶催化酸酐、二酯聚合除了二元酸和二元醇外,酸酐、二酯参与的缩聚反应可以减少水的生成,有利于平衡向聚合物生成的方向移动。
丁二酸酐和1, 8-辛二醇在脂肪酶Candida antarctica的催化下聚合,在室温下就可以合成数均分子量达10 000的聚酯[23]。除二元醇外,多元醇也可以作为反应原料,通过控制反应条件来控制支化度,进而调节材料的疏水性。
Taresco等[24]以己二酸二乙烯酯和甘油为原料,经Novozym 435催化缩聚,制备了聚己二酸甘油酯,并通过控制反应温度来控制支化度,该材料可以作为工程固体分散体或纳米颗粒的一种成分,具有潜在的医疗应用价值。
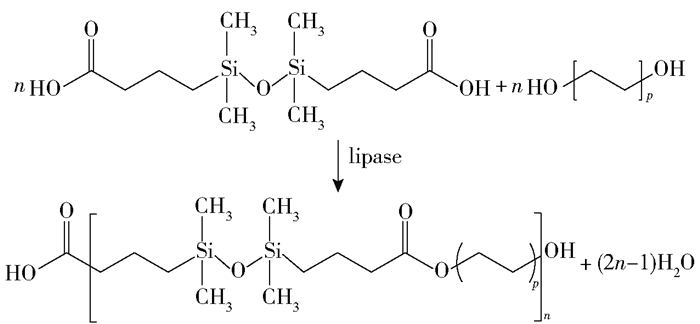
2.2.4 脂肪酶催化其他单体聚合酶法缩聚为热稳定性差的单体提供了一种有效的聚合手段,如具有硅氧烷官能团的单体。含硅聚酯因其独特的性能,如低玻璃化转变温度、低表面能、高透气性和良好的生物相容性而备受关注。将1, 3-双(3-羧丙基)四甲基二硅氧烷与二元醇(1, 4-丁二醇、1, 6-己二醇和1, 8-辛二醇)在无溶剂体系中于50~90 ℃减压,使用Novozym 435催化缩聚反应,可得到最大分子量为20 000的含硅聚酯[28],该缩聚反应如图 2所示。该聚合物与聚乙二醇再经过Novozym 435酶催化聚合,可以生成双亲性嵌段共聚物[29]。此外,双(3-羟丙基)聚二甲基硅氧烷与一系列二元羧酸(琥珀酸、己二酸和癸二酸)经过Novozym 435酶催化聚合,可得到产率大于90%的聚硅氧烷-聚酯[30]。
|
图 2 脂肪酶催化二元醇与1, 3-双(3-羧丙基)四甲基二硅氧烷的缩聚反应[28] Fig.2 Lipase-catalyzed polycondensation of diols with 1, 3-bis-(3-carboxypropyl)-tetramethyldisiloxane[28] |
酯化缩聚反应已扩展到含糖组分的产物,糖基运载工具因具有固有的生物相容性和生物黏附性/靶向性而备受关注。Khatri等[31]在无溶剂条件下,以Novozym 435为催化剂,合成了新型糖基聚乙二醇双亲性共聚物,可以作为药物载体。Perin等[32]采用Novozym 435为催化剂,在叔丁醇中以D-果糖和D-葡萄糖为原料,使用甲基丙烯酸三氟乙酯作为甲基丙烯酸供体,生成甲基丙烯酰-D-果糖和甲基丙烯酰-D-葡萄糖基单体,并以乙二醇二甲基丙烯酸酯为交联剂,制得聚甲基丙烯酰果糖水凝胶,其具有较高的机械稳定性和水膨胀能力。赤藓糖醇(C4)、木糖醇(C5)、核糖醇(C5)、甘露醇(C6)、葡萄糖醇(C6)和半乳糖醇(C6)也可以与二元酸聚合。在反应过程中,一级羟基的反应活性高于二级羟基,因此在酶法缩聚过程中,糖多元醇的立体化学性并没有发生变化[33]。
羟基酸及其酯的自缩聚也可以通过酯化(脱水)和酯交换缩聚来进行。在羟基酸的自缩聚反应中,脂肪酶对长链单体表现出更高的反应活性。这是因为单体链越长,其疏水性越大,脂肪酶在与疏水性更大的底物结合时更容易被激活,这是脂肪酶特有的一种界面活化现象。除了均聚反应外,脂肪酶催化的两种或更多种羟基酸的共聚反应是改变聚合物性质的有效工具,例如乳酸和乙醇酸共聚可以合成普通药物载体聚(乳酸-乙醇酸)[34]。蓖麻油酸是蓖麻油的主要成分,通过脂肪酶催化自聚合可得到分子量为100 600的聚蓖麻油酸[35],该聚合物可以在过氧化二异丙苯的催化下与不溶于氯仿的聚合物交联。此外,蓖麻油酸还可以通过氢化转化为12-羟基硬脂酸甲酯,然后与12-羟基十二烷酸共聚,合成新型绿色可降解的弹性体[36]。
2.3 不饱和脂肪族聚酯的合成 2.3.1 不饱和脂肪族聚酯不饱和脂肪族聚酯分子内不仅含有酯基,还含有可修饰的不饱和非芳族键(如C=C),可在常温常压下固化,通过固化改性的方法提高其性能,以扩大不饱和聚酯的应用范围,在热固性树脂行业中有较好的应用前景。不饱和脂肪族聚酯不仅具有优良的耐腐蚀性、良好的工艺性和成型性、耐热性,而且还具有优良的生物相容性、可降解性和可吸收性,广泛应用于生物医用材料、产品包装等领域。
不饱和聚酯中的双键使得聚酯具有交联性,双键在高温有氧条件下可以打开,交联后可以有效提高产品的黏合度。不饱和聚酯黏合剂(如聚氨酯黏合剂)的黏附性能好,透明度高,常温下即可固化,且耐腐蚀性好,使用方便。不饱和聚酯是增强塑料中使用最普遍的材料,具有室温可固化、黏度适中、可常压成型、固化后无小分子副产物等优点,其力学性能优于酚醛树脂,但略低于环氧树脂[37]。
2.3.2 不饱和脂肪族聚酯的合成目前不饱和聚酯大多由化学法合成,而酶催化法合成不饱和聚酯正逐渐受到人们的关注,表 2总结了关于脂肪酶催化合成不饱和聚酯的研究工作。
| 下载CSV 表 2 脂肪酶催化不饱和脂肪族聚酯的合成 Table 2 Synthesis of unsaturated aliphatic polyesters catalyzed by lipase |
衣康酸是一种通过土曲霉(Aspergillus terreus)发酵获得的二元酸[3],由于乙烯基部分和1, 4位置羧基的功能性,衣康酸经常作为聚合单体,为聚合物合成提供引入复杂官能团的机会。在化学催化法中,强酸是常用的催化剂,在聚合过程中需加入对苯二酚或甲氧基苯酚等阻聚剂对衣康酸的碳碳双键进行保护,以防止双键在高温下发生自聚。而酶催化法的反应条件温和,反应温度往往为70 ℃,在此温度下,衣康酸的双键很少发生自由基聚合,因此酶催化法是保护双键的最好途径。
Jiang等[38]以衣康酸二甲酯、1, 4-丁二醇和各种二羧酸乙酯为单体,CALB为催化剂,二苯醚为溶剂,通过两步聚合制备了一系列饱和及不饱和的脂肪族聚酯,分子量可达94 000;研究发现,二羧酸乙酯的链越长,CALB的活性越高,催化合成的产物分子量也越大,其中CALB对己二酸二乙酯的活性最高。Nguyen等[39]使用Novozym 435为催化剂,以甘油、季戊四醇、壬二酸、妥尔油脂肪酸(主要成分为油酸、亚油酸)为底物合成高支化聚酯材料,可以作为黏合剂和薄膜的成分。
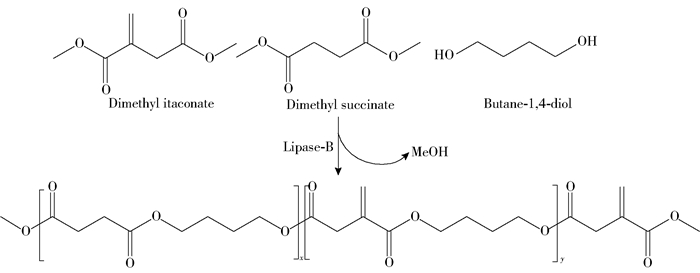
由于生物酶的催化选择性,可以合成化学法无法催化合成的功能性聚酯。Brännström等[40]以衣康酸二甲酯、丁二酸二甲酯和1, 4-丁二醇为原料合成聚酯,研究了不同催化剂的催化效果,发现CALB是最有效的催化剂;在60 ℃下进行反应,CALB对衣康酸二甲酯和丁二酸二甲酯的共轭侧基具有选择性,使得衣康酸基主要位于产物聚酯链的末端(图 3);生物酶法合成的聚酯经过交联,表现出与化学法催化合成的聚酯一样的性质,且酶催化生成的产物具有不变色的优点。Pellis等[41]使用酶催化法在无溶剂条件下合成了衣康酸、富马酸和马来酸基聚酯,实验结果显示,在缩聚反应后,原有的功能性乙烯基团被很好地保护了起来,且在反应过程中没有凝胶现象,证实了所产生的聚合物具有线性结构。Guarneri等[42]在无溶剂的温和条件下,利用脂肪酶催化合成聚(1, 4-环己烷二甲醇衣康酸酯),温和的反应条件保留了衣康酸的不稳定乙烯基,并避免了1, 4-环己烷二甲醇的分解。经过上述反应得到的聚酯中仍含有被保护的乙烯基,可继续与己二胺和2-苯乙胺等进行迈克尔加成反应,得到交联度更高的聚合物,这些材料均无法通过常规的化学方法实现合成。
2.3.3 底物对脂肪酶催化的影响不饱和底物对脂肪酶催化的产物的分子量有影响。Barrett等[43]使用衣康酸、乙二醇和戊二醇为底物,通过酶促反应分别合成了3种聚酯:线性聚(1, 4-环己烷二甲醇衣康酸酯)、聚(聚乙二醇衣康酸酯)和聚(3-甲基-1, 5-戊二醇衣康酸酯-co-3-甲基-1, 5-戊二醇己二酸酯),其中最高的分子量达12 000,这些聚酯可用于药物递送系统、组织工程支架和其他医用材料;研究还发现衣康酸二甲酯是酶促聚合的理想单体,其原因是增加了单体的柔性、延长了碳链,使得反应更易于进行,从而提高了产物聚酯的分子量。
Jiang等[44]指出在酶促缩聚条件下,丁二酸在1, 4-丁二醇中的溶解度较小,导致聚合效率较低,为避免聚合过程中两相传质的发生,选择衣康酸二甲酯为反应单体;同时还研究了脂肪酶对底物衣康酸二酯的亲和性,发现酶对底物的亲和性由高到低为:衣康酸二甲酯>衣康酸二乙酯>衣康酸二丁酯>衣康酸,可以看出,衣康酸不受Novozym 435的青睐,因为衣康酸在醇溶液中不溶,这使得酶颗粒无法与之接触,也就无法进行酶催化。衣康酸二甲酯是Novozym 435最易聚合的二酯,因为与乙醇(沸点78.4 ℃)和正丁醇(沸点117.7 ℃)相比,缩聚反应生成的小分子产物甲醇(沸点64.7 ℃)在真空下更容易被除去。此外,烷基酯的化学反应性是另一个原因,众所周知,甲酯在化学上比乙酯和丁酯更具活性。
Yang等[45]以油酸、芥酸和环氧硬脂酸为原料,采用全细胞生物转化法,以高转化率合成了生物基ω-羧基脂肪酸单体;然后在Novozym 435的催化下单体与二元醇进行缩聚,得到分子量为25 000~57 000的不饱和聚酯和具有环氧基团的聚酯,并且发现底物二元醇的链越长,产物聚酯的熔点和分子量就越高。
3 酶法合成脂肪族聚酯的不足及对策目前,使用酶作为催化剂合成脂肪族聚酯在生产过程和实际应用中仍然存在以下不足。
(1) 与传统的化学法相比,酶催化生成的聚合物的分子量仍较低。这一问题可以通过两种方法来改善:一种方法是在酶催化缩聚之后,再通过化学催化进行第二步反应,例如衣康酸聚酯制备成功后,利用其未反应的乙烯基再进行加成反应,以提高产物的分子量。另一种方法是采用分步聚合法,即先进行初始聚合以获得功能化末端的低聚物,然后在较高温度或较低压力下进行第二步聚合或交联反应。低聚物的合成避免了高聚物因沉淀而脱离反应体系的情况,低聚物的功能性末端可以在第二步反应中用于聚合或交联,而无需脂肪酶就可获得高分子量的材料。两步法的合成方式避免了许多问题,并且与酶催化直接缩聚合成聚酯相比,提供了更快的反应速率和更高的产物分子量[46]。
(2) 在有机溶剂、表面活性剂等物质的存在下,酶会在高温下从载体中释放[47]。据报道,Novozym 435也存在这种现象[48]。因为酶的释放,当需要停止实验时将固定化酶与反应体系分离,但游离在溶剂中的酶无法使反应停止,失去了反应的可控制性[49]。酶的渗漏是固定化脂肪酶的一个普遍问题,最好的解决方案是交叉连接酶以防止酶的解吸[50]。可采取葡聚糖醛或葡聚糖硫酸盐等以物理方式与酶蛋白交联[51],例如戊二醛或醛-葡聚糖[52],或者添加一些离子或化学反应基团[53],使固定化酶的结构更加稳定。
(3) 在催化反应中,机械搅拌使酶的载体颗粒变得脆弱,甚至会使酶颗粒破碎[54],尤其是在工业层面上,破碎的酶可能会堵住过滤器[55]。为了避免载体被破坏,可以采用较温和的搅拌方式[56],或者在固定化酶上涂覆一些刚性的覆盖层,以避免载体断裂[57]。例如,在Novozym 435表面涂上硅酮等有机硅,在剧烈搅拌下可避免载体支架被破坏,并且可以抑制酶的释放,使得固定化酶的活性能保持在90%以上[57]。
(4) 脂肪酶的许多应用环境是无水介质(例如疏水性溶剂),在反应过程中底物可能释放一些亲水性化合物,导致这些化合物在酶中积聚。例如,在酯化反应中,水是反应的副产物,酸也可以积聚在这种环境中,从而使得酶暴露在非常低的pH值下而失活。此外,水的积累也会使反应体系中的酶不利于接近底物,从而降低酶的活性[58]。一种解决方法是使用超声波处理和分子筛吸附,可以部分减少水在酶上的积聚[59-60];另一种方法是改变固定化载体,使用一些疏水性更强的固定化材料,这些材料更能抵抗溶剂的溶解,并且由于更加疏水而防止酶的积水[61-62]。
(5) 使用酶法合成脂肪族聚酯的反应速率较慢,且酶的价格较高,致使酶法合成聚酯的生产成本过高,迄今为止只有少数生产工艺实现了商业化。这主要是由于在底物接受和工艺稳定性方面缺乏适当的酶制剂,大大降低了成本效益。针对酶蛋白本身的优化,目前有两个方向:一是通过蛋白质工程和基因工程将已有的脂肪酶进行改造,增加其稳定性、催化活性和选择性;二是将酶蛋白进行化学修饰和固定载体优化,以提高其稳定性,增加固定化酶的重复使用率,降低产物分离成本[63]。
4 结束语综上所述,由于脂肪酶催化合成聚酯具有诸多优点,尤其是它可以得到许多化学法催化较难实现的结构,包括硅氧烷、环氧树脂和乙烯基部分,因此酶催化法合成脂肪族聚酯具有良好的应用前景。但是到目前为止,该策略仍在实验室范围内应用,主要原因是酶的成本和催化活性的限制。相信随着相关研究的不断深入,酶催化聚合会取得突破性进展,这些问题也会逐步得到解决,最终实现大规模的商业化生产。
| [1] |
GROSS R A, GANESH M, LU W. Enzyme-catalysis breathes new life into polyester condensation polymerizations[J]. Trends in Biotechnology, 2010, 28(8): 435-443. DOI:10.1016/j.tibtech.2010.05.004 |
| [2] |
ZHANG Y R, SPINELLA S, XIE W, et al. Polymeric triglyceride analogs prepared by enzyme-catalyzed condensation polymerization[J]. European Polymer Journal, 2013, 49(4): 793-803. DOI:10.1016/j.eurpolymj.2012.11.011 |
| [3] |
PELLIS A, ACERO H E, GARDOSSI L, et al. Renewable building blocks for sustainable polyesters: new biotechnological routes for greener plastics[J]. Polymer International, 2016, 65(8): 861-871. DOI:10.1002/pi.5087 |
| [4] |
YANG Y, YU Y, ZHANG Y X, et al. Lipase/esterase-catalyzed ring-opening polymerization: a green polyester synthesis technique[J]. Process Biochemistry, 2011, 46(10): 1900-1908. DOI:10.1016/j.procbio.2011.07.016 |
| [5] |
LIU C S, WANG Y L, LIU J H, et al. One-step synthesis of 4-octyl itaconate through the structure control of lipase[J]. The Journal of Organic Chemistry, 2021, 86(12): 7895-7903. DOI:10.1021/acs.joc.0c02995 |
| [6] |
AFZAL H A, GHORPADE R V, THORVE A K, et al. Epoxy functionalized polymer grafted magnetic nanoparticles by facile surface initiated polymerization for immobilization studies of Candida Antarctica lipase B[J]. Reactive and Functional Polymers, 2020, 147: 104454. DOI:10.1016/j.reactfunctpolym.2019.104454 |
| [7] |
YU Y, WANG S Z, YANG Z, et al. A novel environment-friendly synthetic technology of dibutyl itaconate[J]. Journal of Chemical Technology & Biotechnology, 2020, 95(11): 2879-2885. |
| [8] |
张小飞. 酶活性中心稳定化策略提高褶皱假丝酵母脂肪酶的稳定性[D]. 上海: 上海交通大学, 2016. ZHANG X F. Improving the stability of Candida rugosa lipase1 by active site stabilization strategy[D]. Shanghai: Shanghai Jiao Tong University, 2016. (in Chinese) |
| [9] |
LI Y, RUAN Z J, ZHENG M M, et al. Candida rugosa lipase covalently immobilized on facilely-synthesized carbon nitride nanosheets as a novel biocatalyst[J]. RSC Advances, 2018, 8(26): 14229-14236. DOI:10.1039/C8RA00536B |
| [10] |
KOGA H, KITAOKA T, ISOGAI A. Paper-immobilized enzyme as a green microstructured catalyst[J]. Journal of Materials Chemistry, 2012, 22(23): 11591-11597. DOI:10.1039/c2jm30759f |
| [11] |
ORTIZ C, FERREIRA M L, BARBOSA O, et al. Novozym 435:the "perfect" lipase immobilized biocatalyst?[J]. Catalysis Science & Technology, 2019, 9(10): 2380-2420. |
| [12] |
杨光. 脂肪酶固定化的新方法研究及其应用[D]. 杭州: 浙江大学, 2009. YANG G. Research on the new method of immobilization of lipase and its application[D]. Hangzhou: Zhejiang University, 2009. (in Chinese) |
| [13] |
谭天伟, 陈必强. Candida sp. 99-125脂肪酶及其在化学品合成中的应用[J]. 化工学报, 2010, 61(7): 1685-1692. TAN T W, CHEN B Q. Candida sp. 99-125 lipase and its application in chemical synthesis[J]. CIESC Journal, 2010, 61(7): 1685-1692. (in Chinese) |
| [14] |
TACIAS-PASCACIO V G, VIRGEN-ORTÍZ J J, JIMÉNEZ-PÉREZ M, et al. Evaluation of different lipase biocatalysts in the production of biodiesel from used cooking oil: critical role of the immobilization support[J]. Fuel, 2017, 200: 1-10. DOI:10.1016/j.fuel.2017.03.054 |
| [15] |
FU X F, ZHENG J Y, YING X X, et al. Investigation of lipozyme TL IM-catalyzed transesterification using ultraviolet spectrophotometric assay[J]. Chinese Journal of Catalysis, 2014, 35(4): 539-553. |
| [16] |
BINNS F, ROBERTS S M, TAYLOR A, et al. Enzymic polymerisation of an unactivated diol/diacid system[J]. Journal of the Chemical Society, Perkin Transactions 1, 1993, 1(8): 899-904. |
| [17] |
WU X Y, SEPPÄLÄ J, LINKO Y Y. Lipase-catalyzed polyester synthesis[J]. Biotechnology Techniques, 1996, 10(10): 793-798. DOI:10.1007/BF00222568 |
| [18] |
MAHAPATRO A, KUMAR A, KALRA B, et al. Solvent-free adipic acid/1, 8-octanediol condensation polymerizations catalyzed by Candida antartica lipase B[J]. Macromolecules, 2004, 37(1): 35-40. DOI:10.1021/ma025796w |
| [19] |
MAHAPATRO A, KALRA B, KUMAR A, et al. Lipase-catalyzed polycondensations: effect of substrates and solvent on chain formation, dispersity, and end-group structure[J]. Biomacromolecules, 2003, 4(3): 544-551. DOI:10.1021/bm0257208 |
| [20] |
AZIM H, DEKHTERMAN A, JIANG Z, et al. Candida antarctica lipase B-catalyzed synthesis of poly (butylene succinate): shorter chain building blocks also work[J]. Biomacromolecules, 2006, 7(11): 3093-3097. DOI:10.1021/bm060574h |
| [21] |
LIU W H, CHEN B Q, WANG F, et al. Lipase-catalyzed synthesis of aliphatic polyesters and properties characterization[J]. Process Biochemistry, 2011, 46(10): 1993-2000. DOI:10.1016/j.procbio.2011.07.008 |
| [22] |
LIU W H, WANG F, TAN T W, et al. Lipase-catalyzed synthesis and characterization of polymers by cyclodextrin as support architecture[J]. Carbohydrate Polymers, 2013, 92(1): 633-640. DOI:10.1016/j.carbpol.2012.09.064 |
| [23] |
UYAMA H, WADA S, FUKUI T, et al. Lipase-catalyzed synthesis of polyesters from anhydride derivatives involving dehydration[J]. Biochemical Engineering Journal, 2003, 16(2): 145-152. DOI:10.1016/S1369-703X(03)00028-7 |
| [24] |
TARESCO V, CREASEY R, KENNON J, et al. Variation in structure and properties of poly (glycerol adipate) via control of chain branching during enzymatic synthesis[J]. Polymer, 2016, 89: 41-49. DOI:10.1016/j.polymer.2016.02.036 |
| [25] |
KULSHRESTHA A S, SAHOO B, GAO W, et al. Lipase catalysis. a direct route to linear aliphatic copolyesters of bis (hydroxymethyl) butyric acid with pendant carboxylic acid groups[J]. Macromolecules, 2005,, 38(8): 3205-3213. DOI:10.1021/ma0480291 |
| [26] |
YAO D H, LI G J, KUILA T, et al. Lipase-catalyzed synthesis and characterization of biodegradable polyester containing L-malic acid unit in solvent system[J]. Journal of Applied Polymer Science, 2011, 120(2): 1114-1120. DOI:10.1002/app.33257 |
| [27] |
DAI S Y, XUE L, ZINN M, et al. Enzyme-catalyzed polycondensation of polyester macrodiols with divinyl adipate: a green method for the preparation of thermoplastic block copolyesters[J]. Biomacromolecules, 2009, 10(12): 3176-3181. DOI:10.1021/bm9011634 |
| [28] |
POOJARI Y, PALSULE A S, CAI M, et al. Synthesis of organosiloxane copolymers using enzymatic polyesterification[J]. European Polymer Journal, 2008, 44(12): 4139-4145. DOI:10.1016/j.eurpolymj.2008.07.043 |
| [29] |
POOJARI Y, CLARSON S J. Lipase catalyzed synthesis and thermal properties of poly (dimethylsiloxane)-poly (ethylene glycol) amphiphilic block copolymers[J]. Journal of Inorganic and Organometallic Polymers and Materials, 2010, 20(1): 46-52. DOI:10.1007/s10904-009-9304-6 |
| [30] |
GUO L, ZHANG Z J, ZHU Y P, et al. Synthesis of polysiloxane-polyester copolymer by lipase-catalyzed polycondensation[J]. Journal of Applied Polymer Science, 2008, 108(3): 1901-1907. DOI:10.1002/app.27807 |
| [31] |
KHATRI V, BHATIA S, ACHAZI K, et al. Lipase-mediated synthesis of sugar-PEG-based amphiphiles for encapsulation and stabilization of indocyanine green[J]. RSC Advances, 2017, 7(60): 37534-37541. DOI:10.1039/C7RA04994C |
| [32] |
PERIN G B, FELISBERTI M I. Enzymatic synthesis and structural characterization of methacryloyl-D-fructose-and methacryloyl-D-glucose-based monomers and poly (methacryloyl-D-fructose)-based hydrogels[J]. Journal of Chemical Technology & Biotechnology, 2018, 93(6): 1694-1704. |
| [33] |
HU J, GAO W, KULSHRESTHA A, et al. "Sweet Polyesters": lipase-catalyzed condensation-polymerizations of alditols[M]//CHENG H N, GROSS R A. Polymer biocatalysis and biomaterials Ⅱ. Washington, D. C. : American Chemical Society, 2008: 275-284.
|
| [34] |
LASSALLE V, GALLAND G B, FERREIRA M L. Lipase-catalyzed copolymerization of lactic and glycolic acid with potential as drug delivery devices[J]. Bioprocess and Biosystems Engineering, 2008, 31(5): 499-508. DOI:10.1007/s00449-007-0188-y |
| [35] |
EBATA H, TOSHIMA K, MATSUMURA S. Lipase-catalyzed synthesis and curing of high-molecular-weight polyricinoleate[J]. Macromolecular Bioscience, 2007, 7(6): 798-803. DOI:10.1002/mabi.200700018 |
| [36] |
EBATA H, YASUDA M, TOSHIMA K, et al. Poly (ricinoleic acid) based novel thermosetting elastomer[J]. Journal of Oleo Science, 2008, 57(6): 315-320. DOI:10.5650/jos.57.315 |
| [37] |
EBATA H, TOSHIMA K, MATSUMURA S. Lipase-catalyzed synthesis and properties of poly[(12-hydroxydodecanoate)-co-(12-hydroxystearate)] directed towards novel green and sustainable elastomers[J]. Macromolecular Bioscience, 2008, 8(1): 38-45. DOI:10.1002/mabi.200700134 |
| [38] |
JIANG Y, WOORTMAN A J J, VAN EKENSTEIN G O R A, et al. Environmentally benign synthesis of saturated and unsaturated aliphatic polyesters via enzymatic polymerization of biobased monomers derived from renewable resources[J]. Polymer Chemistry, 2015, 6(30): 5451-5463. DOI:10.1039/C5PY00660K |
| [39] |
NGUYEN H D, LÖF D, HVILSTED S, et al. Highly branched bio-based unsaturated polyesters by enzymatic polymerization[J]. Polymers, 2016, 8(10): 363. DOI:10.3390/polym8100363 |
| [40] |
BRÄNNSTRÖM S, FINNVEDEN M, JOHANSSON M, et al. Itaconate based polyesters: selectivity and performance of esterification catalysts[J]. European Polymer Journal, 2018, 103: 370-377. DOI:10.1016/j.eurpolymj.2018.04.017 |
| [41] |
PELLIS A, HANSON P A, COMERFORD J W, et al. Enzymatic synthesis of unsaturated polyesters: functionalization and reversibility of the aza-Michael addition of pendants[J]. Polymer Chemistry, 2019, 10(7): 843-851. DOI:10.1039/C8PY01655K |
| [42] |
GUARNERI A, CUTIFANI V, CESPUGLI M, et al. Functionalization of enzymatically synthesized rigid poly (itaconate)s via post-polymerization aza-Michael addition of primary amines[J]. Advanced Synthesis & Catalysis, 2019, 361(11): 2559-2573. |
| [43] |
BARRETT D G, MERKEL T J, LUFT J C, et al. One-step syntheses of photocurable polyesters based on a renewable resource[J]. Macromolecules, 2010, 43(23): 9660-9667. DOI:10.1021/ma1015424 |
| [44] |
JIANG Y, WOORTMAN A J, VAN EKENSTEIN G O R A, et al. Enzyme-catalyzed synthesis of unsaturated aliphatic polyesters based on green monomers from renewable resources[J]. Biomolecules, 2013, 3(3): 461-480. |
| [45] |
YANG Y Y, LU W H, ZHANG X Y, et al. Two-step biocatalytic route to biobased functional polyesters from ω-carboxy fatty acids and diols[J]. Biomacromolecules, 2010, 11(1): 259-268. DOI:10.1021/bm901112m |
| [46] |
BASSANINI I, HULT K, RIVA S. Dicarboxylic esters: useful tools for the biocatalyzed synthesis of hybrid compounds and polymers[J]. Beilstein Journal of Organic Chemistry, 2015, 11(1): 1583-1595. |
| [47] |
TAMBE A, VYASARAYANI R, DATLA A, et al. Macroporous poly (vinyl acetate-co-divinyl benzene) copolymer beads as adsorptive support for the direct immobilization of Candida antarctica lipase B[J]. Enzyme Engineering, 2015, 4(2): 1000130. |
| [48] |
WEINBERGER S, PELLIS A, COMERFORD J W, et al. Efficient physisorption of Candida antarctica lipase B on polypropylene beads and application for polyester synthesis[J]. Catalysts, 2018, 8(9): 369. DOI:10.3390/catal8090369 |
| [49] |
NICOLÁS P, LASSALLE V L, FERREIRA M L. About the role of typical spacer/crosslinker on the design of efficient magnetic biocatalysts based on nanosized magnetite[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 122: 296-304. DOI:10.1016/j.molcatb.2015.09.013 |
| [50] |
FERNANDEZ-LOPEZ L, VIRGEN-ORTÍZ J J, PEDRERO S G, et al. Optimization of the coating of octyl-CALB with ionic polymers to improve stability and decrease enzyme leakage[J]. Biocatalysis and Biotransformation, 2018, 36(1): 47-56. DOI:10.1080/10242422.2016.1278212 |
| [51] |
PIZARRO C, BRAÑES M C, MARKOVITS A, et al. Influence of different immobilization techniques for Candida cylindracea lipase on its stability and fish oil hydrolysis[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 78: 111-118. DOI:10.1016/j.molcatb.2012.03.012 |
| [52] |
BARBOSA O, TORRES R, ORTIZ C, et al. The slow-down of the CALB immobilization rate permits to control the inter and intra molecular modification produced by glutaraldehyde[J]. Process Biochemistry, 2012, 47(5): 766-774. DOI:10.1016/j.procbio.2012.02.009 |
| [53] |
RUEDA N, ALBUQUERQUE T L, BARTOLOME-CABRERO R, et al. Reversible immobilization of lipases on heterofunctional octyl-amino agarose beads prevents enzyme desorption[J]. Molecules, 2016, 21(5): 646. DOI:10.3390/molecules21050646 |
| [54] |
ANSORGE-SCHUMACHER M B, THUM O. Immobilised lipases in the cosmetics industry[J]. Chemical Society Reviews, 2013, 42(15): 6475-6490. DOI:10.1039/c3cs35484a |
| [55] |
TOLEDO M V, JOSÉ C, COLLINS S E, et al. Towards a green enantiomeric esterification of R/S-ketoprofen: a theoretical and experimental investigation[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 118: 52-61. DOI:10.1016/j.molcatb.2015.05.003 |
| [56] |
DOS SANTOS J C S, BARBOSA O, ORTIZ C, et al. Importance of the support properties for immobilization or purification of enzymes[J]. ChemCatChem, 2015, 7(16): 2413-2432. DOI:10.1002/cctc.201500310 |
| [57] |
FORSYTH C, PATWARDHAN S V. Controlling performance of lipase immobilised on bioinspired silica[J]. Journal of Materials Chemistry B, 2013, 1(8): 1164-1174. DOI:10.1039/c2tb00462c |
| [58] |
MARTINS A B, GRAEBIN N G, LORENZONI A S G, et al. Rapid and high yields of synthesis of butyl acetate catalyzed by Novozym 435:reaction optimization by response surface methodology[J]. Process Biochemistry, 2011, 46(12): 2311-2316. DOI:10.1016/j.procbio.2011.09.011 |
| [59] |
MARTINS A B, SCHEIN M F, FRIEDRICH J L R, et al. Ultrasound-assisted butyl acetate synthesis catalyzed by Novozym 435:enhanced activity and operational stability[J]. Ultrasonics Sonochemistry, 2013, 20(5): 1155-1160. DOI:10.1016/j.ultsonch.2013.01.018 |
| [60] |
SELVAKUMAR P, SIVASHANMUGAM P. Ultrasound assisted oleaginous yeast lipid extraction and garbage lipase catalyzed transesterification for enhanced biodiesel production[J]. Energy Conversion and Management, 2019, 179: 141-151. DOI:10.1016/j.enconman.2018.10.051 |
| [61] |
NORO J, REIS R L, CAVACO-PAULO A, et al. Ultrasound-assisted biosynthesis of novel methotrexate-conjugates[J]. Ultrasonics Sonochemistry, 2018, 48: 51-56. DOI:10.1016/j.ultsonch.2018.05.017 |
| [62] |
TACIAS-PASCACIO V G, TORRESTIANA-SÁNCHEZ B, DAL MAGRO L, et al. Comparison of acid, basic and enzymatic catalysis on the production of biodiesel after RSM optimization[J]. Renewable Energy, 2019, 135: 1-9. DOI:10.1016/j.renene.2018.11.107 |
| [63] |
NIKULIN M, ŠVEDAS V. Prospects of using biocatalysis for the synthesis and modification of polymers[J]. Molecules, 2021, 26(9): 2750. DOI:10.3390/molecules26092750 |