细菌生物膜是由细菌菌群分泌的黏液所形成的保护膜,可以避免或减少菌体受到外界环境的侵害。相对单个、分散、游离细菌的生存状态,生物膜是细菌适应外界环境的一种特殊生存形式。细菌生物膜是导致食源性疾病的主要诱因,可以造成食物变质,引发公共卫生问题[1-2],因此在食品安全领域备受瞩目[3]。根据美国全国卫生研究所(NIH)预计,当食品污染事件发生时,问题的来源往往就是生物膜[4]。1996年因大肠杆菌(Escherichia coli)O157污染导致的日本多所小学集体食物中毒事件,是人们熟知的重大公共卫生事件之一。因此,消除或抑制细菌生物膜对于保障人们的身体健康具有重要意义。
细菌生物膜可以使致病菌的耐药性提高,还能躲避宿主免疫系统的攻击[5-6],具有顽固难清除的特点[7]。目前常用的消毒剂和抗菌剂对致病菌生物膜的清除效果并不明显,且这些消毒剂多为化学物质,对环境不友好。因此,寻找安全有效的消毒剂是食品安全领域亟待解决的问题之一。
近年来,天然植物成分对生物膜的抑制成为研究热点之一。天然植物中活性成分的种类繁多,且具有无毒、安全、环境友好等特点,成为筛选抑制细菌生物膜的优势资源库[8-13]。药用植物银杏(Ginkgo biloba)是我国传统且特有的树种,其中多种活性成分具有抑菌、抗感染的效果,作用靶点多,在治疗细菌感染方面独具优势。吴海霞[14]研究证明,银杏种仁酚酸对大肠杆菌和枯草芽孢杆菌均有较强的抑制作用,银杏种仁多糖对枯草芽孢杆菌有较强的抑制作用,银杏种仁蛋白对革兰氏阴性和阳性细菌均有抑制作用。黄小炯等[15]研究发现银杏果中的抗菌蛋白对大肠杆菌有较强的抑菌效果。赵琪珂[16]研究表明银杏叶多糖对大肠杆菌、枯草芽孢杆菌、八叠球菌和金黄色葡萄球菌均有不同程度的抑制作用,其中对大肠杆菌的抑制效果最好。邵菊芳[17]研究发现,当2.25 mg/mL银杏细胞黄酮与大肠杆菌作用10 h时,对大肠杆菌的抑制率高达81%。以上研究主要集中在银杏各成分对细菌菌体的抑制方面,而对细菌生物膜影响的研究甚少。因此,为了开发潜在的植物源杀菌消毒剂,本文以乙醇为提取溶剂从银杏叶中提取总黄酮,考察了银杏叶黄酮对大肠杆菌生物膜形成和黏附性的影响,以期为解决食品领域的细菌生物膜污染问题提供参考。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料银杏叶采自中国矿业大学南湖校区校园内银杏树,品种为佛手;大肠杆菌BL21菌株、LB无菌液体培养基、U型96孔板,生工生物工程(上海)股份有限公司;芦丁标准品、无水乙醇、亚硝酸钠、硝酸铝、牛肉膏、酵母膏、蛋白胨、琼脂、结晶紫、冰乙酸、甲醇、氯化钾、氯化钠、磷酸氢二钠、磷酸二氢钾、葡萄糖、3, 5-二硝基水杨酸(DNS)试剂、酚酞、盐酸、氢氧化钠,均为分析纯,国药集团化学试剂有限公司;DA201大孔树脂,天津波鸿树脂科技有限公司。
1.1.2 实验仪器DZF-6050型真空干燥箱,上海一恒科学仪器有限公司;UV1780型紫外可见分光光度计,岛津企业管理(中国)有限公司;EL-204型分析天平,梅特勒-托利多仪器(上海)有限公司;SCIENTZ-Ⅱ型超声波粉碎仪,宁波新芝生物科技股份有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;PYX-DHS-350型恒温培养箱、HYL-B型恒温摇床,太仓市璜泾镇强乐实验设备厂;SW-CJ-2D型超净工作台,苏州安泰空气技术有限公司;2-16P型高速离心机,德国Sigma公司。
1.2 总黄酮标准曲线绘制[18]配制质量浓度为0.2 mg/mL的芦丁标准液100 mL,分别取芦丁标准液1.0、2.0、3.0、4.0、5.0、6.0 mL置于25 mL刻度试管中,用30%(体积分数)乙醇补至12.5 mL,加入0.7 mL NaNO2溶液(0.05 g/mL),摇匀,放置5 min后加入0.7 mL Al(NO3)3溶液(0.1 g/mL),放置5 min后加入5 mL 1 mol/L NaOH溶液,混匀,用30%乙醇稀释至刻度,混匀,静置10 min。使用紫外可见分光光度计于510 nm波长处测定吸光度,以芦丁的质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3 总黄酮的提取纯化采摘新鲜银杏叶500 g,于65 ℃烘干至恒重,研磨成粉末,过60目筛(筛孔尺寸为0.25 mm)备用[19]。称取银杏叶粉末10 g,以150 mL 75%(体积分数)乙醇为提取溶剂,超声波破碎处理,于30 ℃振荡2 s、间歇1 s,处理20 min。置于65 ℃的恒温水浴中1 h,过滤,将滤渣重新加入150 mL 75%乙醇中,加热3 h,过滤,弃滤渣,合并滤液[20]。利用1.2节绘制的标准曲线计算总黄酮的提取率,计算公式如下。
| $ E=\frac{m_{0}}{m} \times 100 \% $ |
式中,E为总黄酮的提取率,%;m0为提取液中黄酮的质量,g;m为银杏叶粉末的质量,g。
使用DA201大孔树脂将黄酮初提液纯化[21],使用旋转蒸发仪将纯化后的黄酮提取液减压浓缩,真空干燥,制得干粉保存备用。
1.4 生物膜的培养[22]将活化的大肠杆菌BL21接种至100 mL LB液体培养基中,于37 ℃以200 r/min在恒温摇床中培养24 h,取对数生长期的细菌稀释100倍,以每孔0.1 mL加入到U型96孔板中。每孔菌液中加入0.1 mL LB培养基,混匀,以每孔0.2 mL的LB培养基为对照,在恒温培养箱中于37 ℃恒温培养。
1.5 生物膜生长曲线测定吸去菌液,用磷酸盐缓冲液(PBS,pH=7.4) 洗板3次,吸去洗液后晾干。加入甲醇固定20 min,吸去液体后晾干。将0.05 mL结晶紫染色液(0.01 g/mL) 加入孔板,轻摇使染色均匀。静置5 min,用去离子水冲洗孔板,晾干。吸取0.2 mL 33%(体积分数,下同)冰乙酸加入孔板,待生物膜完全溶解,加入到25 mL刻度试管中,用33%冰乙酸补至5 mL。使用紫外可见分光光度计在600 nm处测量不同培养时间的溶液的吸光度,以培养时间为横坐标,吸光度为纵坐标,绘制生物膜生长曲线。
1.6 大肠杆菌抑菌率测定[23]将黄酮干粉配制成质量浓度为16、8、4、2、1、0.5、0.25 mg/mL的7个梯度,以水为空白对照。取各浓度的黄酮溶液稀释1倍,以每孔0.1 mL加入到U型96孔板中,每个浓度做3个平行,共接种24孔。将活化培养24 h的大肠杆菌菌液稀释10万倍,各孔黄酮稀释液中接种0.1 mL菌液,于37 ℃在恒温培养箱中培养24 h。将培养液涂布在牛肉膏蛋白胨培养基上,每组涂布3个平板。于37 ℃恒温培养24 h,对菌落进行计数。没有大肠杆菌生长的平板上对应的银杏叶黄酮浓度为最小抑菌浓度(MIC),按照下式计算对大肠杆菌的抑菌率。
| $ R_{\mathrm{i}}=\frac{n_{0}-n}{n_{0}} \times 100 \% $ |
式中,Ri为抑菌率,%;n0为空白对照的菌落数;n为实验组的菌落数。
1.7 银杏叶黄酮对生物膜的影响 1.7.1 生物膜的分离按照1.4节的方法接种大肠杆菌,将质量浓度为0(空白对照)、0.5、1、2倍MIC的黄酮溶液稀释1倍后取1 mL加入到菌液中,于37 ℃恒温培养48 h。称量各离心管的质量后,参照1.5节的方法溶解生物膜后,将各孔板中的菌液分别移入离心管,于7 800 r/min离心5 min,弃上清液,测定离心管加沉淀物的质量,按照下式计算生物膜质量。
| $ G_{\mathrm{f}}=G-G_{\mathrm{t}} $ |
式中,Gf为生物膜质量,mg;G为离心管加沉淀物的质量,mg;Gt为离心管的质量,mg。
1.7.2 生物膜形成抑制率及黏附性抑制率测定按1.4节的培养方法,经0(空白对照)、0.25、0.5、1倍MIC的银杏叶黄酮处理的大肠杆菌生物膜,于37 ℃培养24 h。按1.7.1节的方法分离生物膜,测定生物膜质量,按照下式计算生物膜形成抑制率。
| $ R_{\mathrm{f}}=\frac{G_{0}-G_{1}}{G_{0}} \times 100 \% $ |
式中,Rf为生物膜形成抑制率,%;G0为空白对照的生物膜质量,mg;G1为银杏叶黄酮抑制后的生物膜质量,mg。
按照1.5节的方法将生物膜进行染色洗板,用33%冰乙酸溶解生物膜,并补至3 mL。使用紫外可见分光光度计在600 nm处测量各样品染色液的吸光度,按照下式计算生物膜黏附性抑制率。
| $ R_{\mathrm{a}}=\frac{A_{0}-A}{A_{0}} \times 100 \% $ |
式中,Ra为黏附性抑制率,%;A0为空白对照的吸光度;A为实验组的吸光度。
1.7.3 葡萄糖标准曲线绘制[24]配制10 mg/mL葡萄糖标准液,分别取1.6、3.2、4.8、6.4、8、9.6 mL加入到25 mL刻度试管,加去离子水补至20 mL,加入1.5 mL DNS试剂后摇匀,沸水浴加热5 min。加去离子水补至25 mL,混匀。以未加入葡萄糖标准液的样液为空白,使用紫外可见分光光度计在540 nm处测定各管溶液的吸光度。以葡萄糖的质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.7.4 胞外多糖的水解、提取及生物膜多糖含量的测定[25]于装有生物膜的离心管中加入0.1 mL 6 mol/L盐酸及0.15 mL去离子水,吸出样液加入到25 mL刻度试管中,在水浴锅中于100 ℃水解30 min。在此过程中防止蒸干,适当加入几滴蒸馏水,水解后测量其体积。待水解液冷却后,加入1滴酚酞指示剂,加入6 mol/L NaOH溶液中和变色,得到待测液,测量其体积。取0.4 mL待测液,加入0.3 mL DNS试剂,在沸水浴中加热5 min,取出后加入去离子水补至5 mL,混匀,得到测定液。以不加生物膜的离心管为空白,使用紫外可见分光光度计在540 nm处测定吸光度,利用葡萄糖标准曲线,按照下式计算胞外多糖含量。
| $ C=\frac{5 A_{0} V M}{0.4 \times 0.9} \times 100 \% $ |
式中,C为胞外多糖含量,%;A0为空白对照的吸光度;V为待测液体积,mL;M为生物膜质量,mg。
2 结果与讨论 2.1 黄酮标准曲线及黄酮含量测定结果图 1为芦丁的标准曲线。芦丁的质量浓度ρ与吸光度A的关系式为:ρ=6.192A-0.000 8,决定系数R2=0.999,表明在0.008~0.048 mg/mL的范围内,芦丁的质量浓度与吸光度的线性关系良好。参照此标准曲线方程,可得乙醇提取后提取液中黄酮的质量浓度为0.15 mg/mL,计算得到提取率为1.71%。经DA201大孔树脂纯化后,纯化液中黄酮的质量浓度为1 mg/mL,减压浓缩后黄酮的质量浓度可达4.635 mg/mL,表明黄酮类化合物经纯化、浓缩,含量得到了显著的提高。
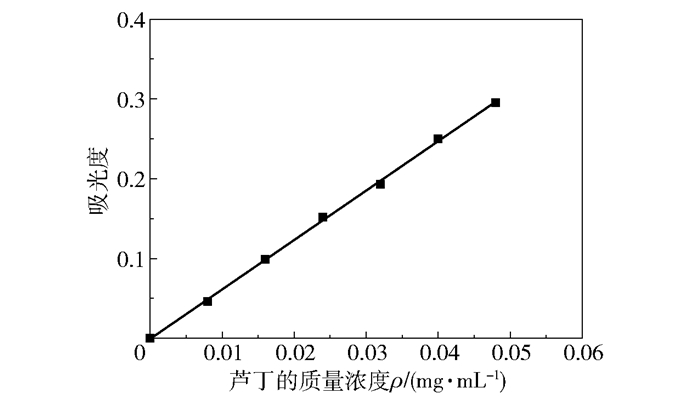
|
图 1 芦丁的标准曲线 Fig.1 Standard curve for rutin |
图 2为大肠杆菌生物膜的生长曲线。生物膜的形成过程分为4个时期:黏附初期、黏附期、成熟期和脱落期[12]。由图 2可知,大肠杆菌菌株在37 ℃培养2 h时完成初黏附,4 h形成成熟的生物膜,4~8 h生物膜脱落,8 h之后生物膜开始新的生长周期。在接下来的周期中,由于代谢产物的积累和营养物质的消耗,生物膜的生长变慢,周期变长。根据生长曲线,培养时间为12 h时生物膜最强壮,胞外基质最丰富,黏附性最强。
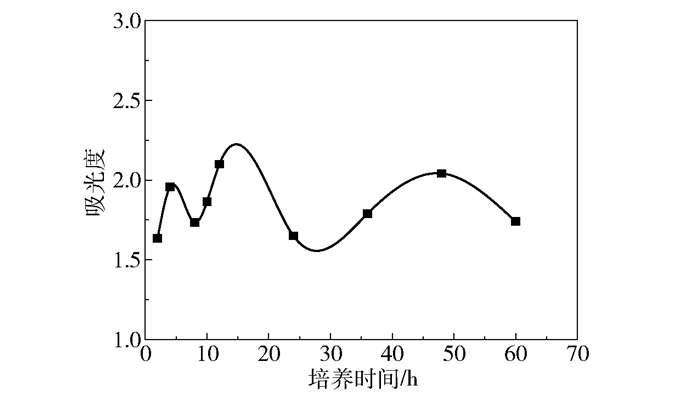
|
图 2 大肠杆菌生物膜的生长曲线 Fig.2 Growth curve of E. coli biofilm |
图 3为不同质量浓度的银杏叶黄酮对大肠杆菌抑制率的影响。由图 3可知,4 mg/mL和8 mg/mL的银杏叶黄酮对大肠杆菌的生长有显著的抑制作用,抑菌率分别为99.59%和99.25%;0.25~2 mg/mL银杏叶黄酮的抑菌率为82.63%~89.42%;0.125 mg/mL银杏叶黄酮的抑菌率与空白对照组无明显差别,抑菌率约为16%。由此得出银杏叶黄酮对大肠杆菌的MIC为4 mg/mL。相对于肉桂(MIC为3.125 mg/mL)、丁香(MIC为6.25 mg/mL)等抑制作用广泛、用量低的植物杀菌剂[26],银杏叶黄酮对大肠杆菌的抑菌活性为中等水平。
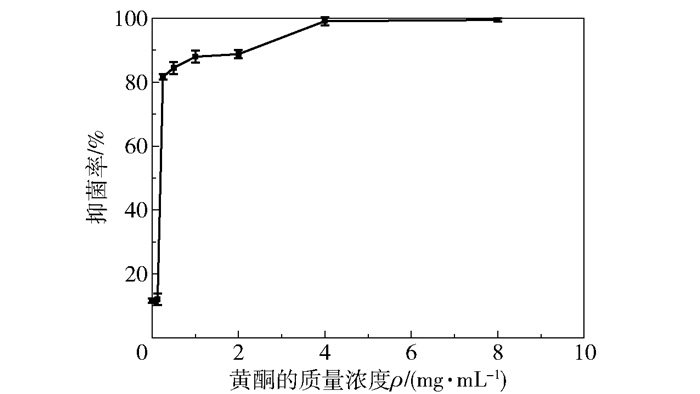
|
n=3,结果以“平均值±标准差”表示,下同。 图 3 不同质量浓度的银杏叶黄酮对大肠杆菌抑菌率的影响 Fig.3 Effect of different mass concentrations of flavonoids from Ginkgo biloba leaves on the antibacterial rate of E. coli |
图 4为银杏叶黄酮对大肠杆菌生物膜形成量及黏附性的影响。由图 4可知,当银杏叶黄酮的质量浓度为0.25倍和0.5倍MIC时,生物膜形成抑制率分别为22.72%和15.91%;质量浓度为1倍MIC时生物膜形成抑制率为59.09%,相比0.25倍和0.5倍MIC组分别提高了36.37%和43.18%。结果表明,银杏叶黄酮的质量浓度为1倍MIC时,对生物膜形成的抑制效果显著。
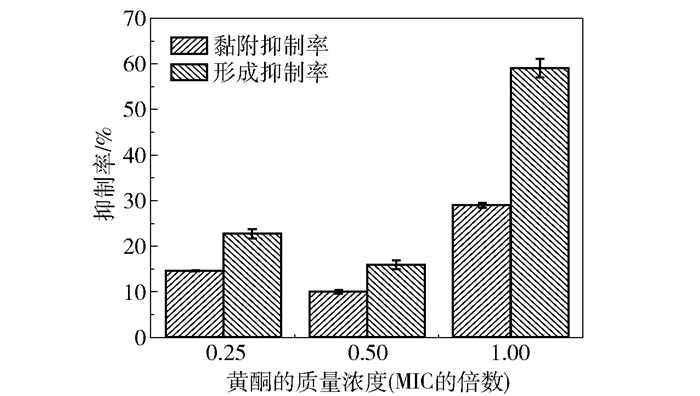
|
图 4 银杏叶黄酮对大肠杆菌生物膜形成量及黏附性的影响 Fig.4 Effects of flavonoids from Ginkgo biloba leaves on the formation and adhesion of E. coli biofilms |
当银杏叶黄酮的质量浓度为0.25倍和0.5倍MIC时,黏附性抑制率分别为14.63%和10.02%;质量浓度为1倍MIC时黏附性抑制率为28.99%,相比0.25倍和0.5倍MIC组分别提高了14.36%和18.97%。结果表明,银杏叶黄酮的质量浓度为1倍MIC时,对生物膜黏附的抑制效果显著。
2.5 葡萄糖标准曲线及银杏叶黄酮对胞外多糖含量的影响图 5为葡萄糖的标准曲线。由图 5可得葡萄糖的质量浓度ρ与吸光度A的关系式为:ρ=0.21A-0.025 2,R2=0.998 1,表明在0.8~4.8 mg/mL的范围内,葡萄糖的质量浓度与吸光度的线性关系良好。
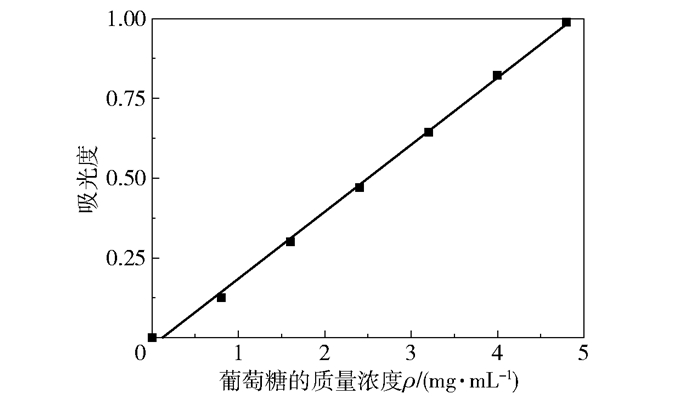
|
图 5 葡萄糖的标准曲线 Fig.5 Standard curve for glucose |
图 6为银杏叶黄酮对大肠杆菌生物膜胞外多糖含量的影响。由图 6可知,银杏叶黄酮的质量浓度为1倍和2倍MIC时对生物膜多糖的抑制效果较为明显,在培养24 h时,胞外多糖含量相比对照组(0 MIC)分别减少了1.83%和2.12%。银杏叶黄酮的质量浓度为0.25倍和0.5倍MIC时,对生物膜多糖合成的抑制效果微弱,在培养48 h时胞外多糖含量分别比对照组减少0.18%和0.6%。结果表明,当银杏叶黄酮的质量浓度在1倍MIC以上时对大肠杆菌生物膜多糖的形成有明显的抑制作用。可以推测,银杏叶黄酮通过抑制胞外聚合物中多糖的分泌,抑制大肠杆菌生物膜的形成及黏附。

|
图 6 不同质量浓度的银杏叶黄酮对大肠杆菌生物膜胞外多糖含量的影响 Fig.6 Effect of different mass concentrations of flavonoids from Ginkgo biloba leaves on the content of extracellular polysaccharides in E. coli biofilms |
银杏叶黄酮可抑制大肠杆菌菌体的生长,MIC为4 mg/mL;对大肠杆菌生物膜的形成和黏附有抑制作用,银杏叶黄酮的质量浓度为1倍MIC时,生物膜形成抑制率为59.09%,黏附性抑制率为28.99%;银杏叶黄酮的质量浓度在1倍MIC以上时,对大肠杆菌生物膜多糖的形成有明显的抑制作用。
| [1] |
RANGEL J M, SPARLING P H, CROWE C, et al. Epidemiology of Escherichia coli O157:H7 outbreaks, United States, 1982—2002[J]. Emerging Infectious Diseases, 2005, 11(4): 603-609. DOI:10.3201/eid1104.040739 |
| [2] |
刘飞, 宋定州, 李键, 等. 产志贺毒素大肠杆菌的流行病学及致病因子的研究进展[J]. 中国畜牧兽医, 2014, 41(1): 187-191. LIU F, SONG D Z, LI J, et al. Research progress on Shiga toxin-producing Escherichia coli epidemiology and virulence factors[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(1): 187-191. (in Chinese) |
| [3] |
段韵涵, 韩北忠, 杨葆华, 等. 培养条件对金黄色葡萄球菌生物被膜生长的影响[J]. 中国酿造, 2008(3): 17-20. DUAN Y H, HAN B Z, YANG B H, et al. Effect of cultivation conditions on growth of Staphylococcus aureus biofilms[J]. China Brewing, 2008(3): 17-20. (in Chinese) DOI:10.3969/j.issn.0254-5071.2008.03.007 |
| [4] |
CHICUREL M. Bacterial biofilms and infections. Slimebusters[J]. Nature, 2000, 408(6810): 284-286. DOI:10.1038/35042737 |
| [5] |
ALESSANDRIA V, RANTSIOU K, CAVALLERO M C, et al. Effect of atmospheric pressure plasma on Listeria monocytogenes attached to abiotic surfaces[J]. Journal of Food Protection, 2019, 82(2): 233-237. DOI:10.4315/0362-028X.JFP-18-228 |
| [6] |
FLYNN P B, GILMORE B F. Understanding plasma biofilm interactions for controlling infection and virulence[J]. Journal of Physics D: Applied Physics, 2018, 51(26): 263001. DOI:10.1088/1361-6463/aac475 |
| [7] |
SANDASI M, LEONARD C M, VAN VUUREN S F, et al. Peppermint (Mentha piperita) inhibits microbial biofilms in vitro[J]. South African Journal of Botany, 2011, 77: 80-85. DOI:10.1016/j.sajb.2010.05.011 |
| [8] |
吴泽钰. 柚皮苷对主要致龋细菌及生物膜作用的实验研究[D]. 乌鲁木齐: 新疆医科大学, 2020. WU Z Y. Experimental study on the effect of naringin on oral major cariogenic bacteria and biofilm[D]. Urumqi: Xinjiang Medical University, 2020. (in Chinese) |
| [9] |
袁曦玉. 新疆软紫草对主要致龋细菌及生物膜作用的实验研究[D]. 乌鲁木齐: 新疆医科大学, 2020. YUAN X Y. Experimental study on the effect of Arnebia euchroma on main cariogenic bacteria and biofilms[D]. Urumqi: Xinjiang Medical University, 2020. (in Chinese) |
| [10] |
HONRAET K, NELIS H J. Use of the modified robbins device and fluorescent staining to screen plant extracts for the inhibition of S. mutans biofilm formation[J]. Journal of Microbiological Methods, 2006, 64: 217-224. DOI:10.1016/j.mimet.2005.05.005 |
| [11] |
WANG Y, LEE S M, DYKES G A. Potential mechanisms for the effects of tea extracts on the attachment, biofilm formation and cell size of Streptococcus mutans[J]. Biofouling, 2013, 29(3): 307-318. DOI:10.1080/08927014.2013.774377 |
| [12] |
黄晓敏, 王婧婷, 汪若波, 等. 五倍子水提取物对金黄色葡萄球菌生物膜的影响[J]. 中国现代医学杂志, 2009, 19(4): 536-539, 543. HUANG X M, WANG J T, WANG R B, et al. Effects of Gallnut water extract on Staphylococcus aureus biofilm[J]. China Journal of Modern Medicine, 2009, 19(4): 536-539, 543. (in Chinese) DOI:10.3969/j.issn.1005-8982.2009.04.014 |
| [13] |
FURIGA A, ROQUES C, BADET C. Preventive effects of an original combination of grape seed polyphenols with amine fluoride on dental biofilm formation and oxidative damage by oral bacteria[J]. Journal of Applied Microbiology, 2014, 116(4): 761-771. DOI:10.1111/jam.12395 |
| [14] |
吴海霞. 银杏种仁抑菌蛋白及其抑菌机制研究[D]. 南京: 南京林业大学, 2014. WU H X. Study on antimicrobial activity and mechanism of protein from Ginkgo biloba seeds[D]. Nanjing: Nanjing Forestry University, 2014. (in Chinese) |
| [15] |
黄小炯, 区子弁, 王琴. 银杏抗菌蛋白的提取及其抗菌性研究[J]. 食品工业科技, 2008, 29(10): 139-141, 145. HUANG X J, OU Z B, WANG Q. Study on extract of antibacterial protein from Ginkgo biloba[J]. Science and Technology of Food Industry, 2008, 29(10): 139-141, 145. (in Chinese) |
| [16] |
赵琪珂. 银杏叶多糖的提取条件优化及抑菌性的研究[D]. 大连: 大连工业大学, 2017. ZHAO Q K. Optimization of extracting conditions and study on antibacterial activity of polysaccharide from Ginkgo biloba[D]. Dalian: Dalian Polytechnic University, 2017. (in Chinese) |
| [17] |
邵菊芳. 基于细胞培养的银杏黄酮类化合物的分离鉴定研究[D]. 徐州: 中国矿业大学, 2013. SHAO J F. Extraction and identification of flavonoids from cultured cell of Ginkgo biloba[D]. Xuzhou: China University of Mining and Technology, 2013. (in Chinese) |
| [18] |
薛志杉, 承伟. 银杏叶黄酮提取工艺的优化[J]. 安徽农业科学, 2011, 39(10): 5751-5752, 5754. XUE Z B, CHENG W. Optimization of extraction process of flavonoids from Ginkgo biloba L. leaf[J]. Journal of Anhui Agricultural Sciences, 2011, 39(10): 5751-5752, 5754. (in Chinese) DOI:10.3969/j.issn.0517-6611.2011.10.031 |
| [19] |
胡清文. 银杏内酯的提取分离及药理作用研究[D]. 济南: 山东大学, 2012. HU Q W. Study on the extraction, isolation, pharmacological effects of ginkgolide[D]. Jinan: Shandong University, 2012. (in Chinese) |
| [20] |
李保同. 银杏叶总黄酮的提取纯化及其抗氧化性能研究[D]. 北京: 北京林业大学, 2016. LI B T. Study on extraction, purification and antioxidant activity of flavonoids from Ginkgo biloba leaves[D]. Beijing: Beijing Forestry University, 2016. (in Chinese) |
| [21] |
刘兰英, 曹有龙, 赵友谊. 枸杞叶黄酮纯化工艺研究[J]. 食品科技, 2009, 34(8): 134-137. LIU L Y, CAO Y L, ZHAO Y Y. Study on purification technology of total flavonoids in wolfberry leaves[J]. Food Science and Technology, 2009, 34(8): 134-137. (in Chinese) |
| [22] |
喻华英, 李启峰. 大肠杆菌生物膜的筛选及生长曲线测定[J]. 中国农学通报, 2014, 30(5): 23-27. YU H Y, LI Q F. Screening biofilm and determination growth biofilm of curve in Escherichia coli[J]. Chinese Agricultural Science Bulletin, 2014, 30(5): 23-27. (in Chinese) |
| [23] |
靳盼盼, 刘亚文, 邵美丽, 等. 香芹酚对食源粪肠球菌生物膜形成的抑制作用[J]. 中国食品学报, 2020, 20(7): 18-26. JIN P P, LIU Y W, SHAO M L, et al. Inhibition effect of carvacrol to biofilm formation of foodborne Enterococcus faecalis[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(7): 18-26. (in Chinese) |
| [24] |
王俊丽, 聂国兴, 李素贞, 等. DNS法测定还原糖含量时最适波长的确定[J]. 河南农业科学, 2010(4): 115-118. WANG J L, NIE G X, LI S Z, et al. Optimal wavelength for determining the content of reducing sugar by DNS method[J]. Journal of Henan Agricultural Sciences, 2010(4): 115-118. (in Chinese) DOI:10.3969/j.issn.1004-3268.2010.04.032 |
| [25] |
原素英, 杨尧, 杨丽霞, 等. 离子色谱法检测冻干AC-Hib联合疫苗成品中的游离多糖[J]. 中国新药杂志, 2018, 27(8): 874-881. YUAN S Y, YANG Y, YANG L X, et al. Determination of free polysaccharides in the AC-Hib conjugate vaccine using high performance anion-exchange chromatography[J]. Chinese Journal of New Drugs, 2018, 27(8): 874-881. (in Chinese) |
| [26] |
李百健, 曾荣, 黄长干, 等. 植物杀菌剂的筛选[J]. 西南大学学报(自然科学版), 2010, 32(10): 28-31. LI B J, ZENG R, HUANG C G, et al. Screening of plant fungicides[J]. Journal of Southwest University(Natural Science), 2010, 32(10): 28-31. (in Chinese) |








