2. 中国农业科学院 植物保护研究所, 北京 100081;
3. 汉堡工业大学, 德国汉堡 21073
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3. Hamburg University of Technology, Hamburg 21073, Germany
为了顺应全球绿色低碳发展的趋势[1],我国于2020年明确设定了“碳达峰”和“碳中和”的目标,并将其纳入生态文明建设的整体布局之中。实现碳中和的主要方式是碳抵消和发展低碳经济[2],而CO2资源化利用(C1合成)是发展低碳经济的重要一环,其主要通过羧基化或还原途径将CO2转化成化学制品或燃料[3-4],因此,C1合成的研究对于CO2的高效资源化利用具有重要意义。目前,已有多条C1合成途径被提出,例如丝氨酸途径[5]、还原甘氨酸途径[6]、还原乙酰辅酶A途径[7]以及核酮糖-磷酸途径[8]等,其中还原甘氨酸途径由于远离中心代谢途径以及具有合理的高化学动力而被认为是最有前景的C1合成途径[9]。还原甘氨酸途径以CO2还原产生的C1化合物——甲酸作为原料,首先,甲酸与辅因子四氢叶酸(THF)相连实现活化,之后被还原生成亚甲基-四氢叶酸(methylene-THF);进一步地,methylene-THF作为C1供体与CO2和NH3联合反应,并在甘氨酸裂解酶系的催化下生成C2化合物——甘氨酸;此后,甘氨酸继续与methylene-THF结合,生成C3化合物——丝氨酸;最终,丝氨酸会被转化为丙酮酸,进入中心代谢网络以合成下游化学品[10-13]。
甘氨酸裂解酶系主导的甘氨酸合成反应是还原甘氨酸途径固碳的关键步骤[14],该酶系在上世纪60年代被发现并在随后的30年中被深入研究[15-18]。甘氨酸裂解酶系主要包含4种蛋白,分别为H-蛋白、P-蛋白、T-蛋白和L-蛋白。其中,H-蛋白是一种穿梭蛋白[19],它在共价连接硫辛酸配体后会分别连接其他3种催化蛋白的催化反应中心以进行循环反应。H-蛋白穿梭在其他三种催化蛋白的活性中心的过程中会与其共价配体形成三种形态,即氧化态(Hox)、过渡态(Hint)和还原态(Hred)。在氧化态和还原态下,H蛋白的共价配体(硫辛酸或二氢硫辛酸)可在水溶液中自由移动[20]。而在过渡态下,H-蛋白的共价配体(硫辛酰胺)在水溶液中容易发生水解(氨甲基易被水解生成甲醛),因此在过渡态下,H-蛋白会采取一种自保护机制将硫辛酰胺配体环抱在自身空腔内部保护起来[19]。在H-蛋白与T-蛋白反应时,T-蛋白会先与H-蛋白接触以解开H-蛋白的自保护机制,此时硫辛酰胺配体被释放至T-蛋白内,从而进行下一步催化反应[21]。
值得注意的是,还原甘氨酸途径中核心产物甘氨酸的合成反应是可逆的,在甘氨酸裂解酶系的主导下,催化反应更趋向于甘氨酸的裂解而非合成[14]。一些研究者试图阐释甘氨酸裂解酶系的催化机制,例如,Gueguen等[22]在1999年提出,H-蛋白中Glu-14对硫辛酰胺臂(硫辛酰胺与H-蛋白Lys-64侧链共价形成的分子摆臂)在疏水空腔中的稳定存在发挥着重要作用,将Glu-14突变为丙氨酸后,疏水空腔被破坏,此时硫辛酰胺臂无法在疏水空腔中稳定存在,从而导致甘氨酸裂解酶系的催化效率大大降低。Okamura-Ikeda等[23]在2010年首次结晶出H-T蛋白复合物,并发现T- 蛋白中的Arg-292对H-T蛋白复合物的自组装发挥关键作用;将Arg-292突变为丙氨酸后,H-蛋白和T-蛋白虽然能够正常表达,但不能正常组装,从而导致甘氨酸的合成/裂解反应几乎不能进行。然而到目前为止,甘氨酸裂解酶系的蛋白相互作用机制仍不清楚,且难以实现甘氨酸裂解酶系催化效率的调控,后者将有助于我们进一步在分子层面上理解甘氨酸裂解/合成反应,并对于通过蛋白质工程提高C1合成效率具有重要的指导意义。
本课题组在前期工作中,采用分子动力学模拟手段对T-蛋白解开H-蛋白自保护的行为进行了研究[24]。通过分析T-蛋白诱导H-蛋白解开自保护过程的动力学轨迹,我们锁定了硫辛酰胺离开空腔过程中的3个潜在的关键氨基酸残基:Ser-67、Asp-68和Tyr-70。由于Ser-67主导的这一阶段在硫辛酰胺释放的分子动力学轨迹中占据的时间最长,并且通过能量分析发现这一阶段的能垒跨度最大,因此我们对Ser-67进行了突变研究,发现Ser-67位点对甘氨酸裂解酶系的整体酶活有重要影响。然而,另外两个氨基酸残基Asp-68和Tyr-70位点如何影响甘氨酸裂解酶系的整体酶活目前仍不清楚。因此,本文进一步对Asp-68和Tyr-70进行突变,探究Asp-68和Tyr-70位点对甘氨酸裂解酶系整体酶活的影响,并尝试从分子层面上阐释酶活的变化机制。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料大肠杆菌(Escherichia coli)来源的H-蛋白野生型、P-蛋白、T-蛋白和L-蛋白基因的美国国家生物技术信息中心(NCBI)序列号分别为NP_417380.1、P33195.3、P27248.3和P0A9P0.2,这4种基因的表达载体均为pET-28a,构建出的重组质粒由实验室保存使用;E. coli BL21(DE3)及E. coli TOP10感受态购自上海唯地生物技术有限公司;定点突变试剂盒(Mut Express II Fast Mutagenesis Kit V2)购自南京诺唯赞生物科技股份有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)相关试剂、琼脂糖凝胶电泳相关试剂购自南京金斯瑞生物科技有限公司;Luria-Bertani(LB)液体培养基、LB固体培养基相关试剂、氯化钠、Tris-HCl和咪唑购自索莱宝生物科技有限公司;卡那霉素购自国药集团化学试剂有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、硫辛酸购自上海源叶生物科技有限公司。
1.1.2 实验仪器聚合酶链式反应(PCR)仪(T100-186109型,BIO-RAD公司);立式压力蒸汽灭菌锅(YXQ.SG41.280型,宁波久兴公司);隔水式恒温培养箱(LW1908型,Longyue公司);多功能组合式摇床(HYG-C3型,苏州培英实验设备有限公司);高速冷冻离心机(CR22G型,日本日立公司);超声细胞破碎仪(JY92-II型,宁波新芝公司);ÄKTA蛋白层析系统(美国GE Healthcare公司);镍柱(Ni-NTA Fast Flow column,5 mL,美国GE Healthcare公司);凝胶成像仪(C30型,Azure Biosystems公司);酶标仪(Enspire型,PerkinElmer公司);SDS-PAGE电泳仪(Mini-PROTEAN Tetra System型,BIO-RAD公司);超净工作台(CHSD1500型,苏州博莱尔净化设备有限公司);台式离心机(V126716型,Eppendorf公司);琼脂糖凝胶电泳仪(Mini-Sub Cell GT型,BIO-RAD公司)。
1.2 实验方法 1.2.1 质粒构建H-蛋白Asp-68位突变体质粒和Tyr-70位突变体质粒的构建参照定点突变试剂盒提供的方法进行,具体涉及的引物如表 1所示。引物的DNA熔解温度(Tm)均为(60±1) ℃。PCR反应体系为:1 μL Phanta® Max Super-Fidelity DNA Polymerase、25 μL 2×Max Buffer、1 μL dNTP、2 μL上游引物、2 μL下游引物、1 μL模板质粒、18 μL超纯水。PCR扩增条件为:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸4 min,循环29次,72 ℃终延伸10 min,12 ℃保存。扩增结束后,使用琼脂糖凝胶电泳(120 V, 30 min, 常温常压)对扩增产物进行分析,所用琼脂糖的质量浓度为10 g/L。然后使用Dpn1消解PCR产物中的模板质粒(37 ℃,1 h)。使用该Dpn1消解产物进行同源重组(37 ℃,30 min),完成质粒环化过程。将重组产物转化至E. coli TOP10感受态中,经复苏后涂布于含有50 μg/mL卡那霉素的LB平板上,于37 ℃静置培养12 h,将平板菌落送至苏州金唯智公司进行测序鉴定,将鉴定成功的质粒保存备用。
| 下载CSV 表 1 引物序列 Table 1 Primer sequences |
通过化学热激法将H-蛋白野生型质粒和各突变体质粒转入E. coli BL21(DE3)感受态细胞中,经复苏后将菌体涂布于含有50 μg/mL卡那霉素的LB平板上,于37 ℃培养12 h。随后挑取平板菌落中的单克隆菌体至4 mL的LB培养基(含50 μg/mL卡那霉素)中,在37 ℃、220 r/min下振荡培养。培养3~4 h后,取1 mL菌液接种至100 mL含有50 μg/mL卡那霉素的LB培养基中,在37 ℃、220 r/min下培养,待菌液在600 nm处的吸光度达到0.7左右时(约3 h),添加终浓度为0.2 mmol/L的IPTG溶液。同时,向培养基中加入150 μmol/L硫辛酸对表达的ecHapo蛋白进行酯化,使其形成硫辛酸臂,然后于30 ℃进行蛋白诱导表达12 h。诱导结束后,通过离心(7 459×g) 收集菌体。此外,还对P-蛋白、T-蛋白和L-蛋白进行了异源表达,诱导过程中无需加入硫辛酸,其他操作方法与H-蛋白一致。
蛋白纯化均通过镍柱亲和层析法进行。使用50 mmol/L的Tris ·HCl(pH=7.5)溶液重悬菌体。将重悬后的菌体进行超声破碎处理10 min(每运行5 s停3 s),然后将破碎液进行低温冷冻离心30 min(4 ℃,7 459×g),得到的蛋白上清液用于下一步蛋白纯化,后续操作均在ÄKTA蛋白层析系统上进行。将含有蛋白的上清液进行过膜处理(膜孔径0.2 μm),使用Buffer A(500 mmol/L氯化钠、50 mmol/L Tris-HCl、20 mmol/L咪唑,pH7.4)将蛋白样品上样至镍柱中,然后使用5%的Buffer B(500 mmol/L氯化钠、50 mmol/L Tris-HCl、500 mmol/L咪唑,pH7.4)洗脱杂蛋白,洗脱体积为10倍柱体积。最后采用线性洗脱方式(6%~100% Buffer B)洗脱目标蛋白,洗脱体积为20倍柱体积。使用50 mmol/L的Tris-HCl溶液(pH=7.5)将纯化后的目标蛋白稀释至咪唑浓度低于1 mmol/L。使用SDS-PAGE凝胶电泳对纯化蛋白进行分析(150 V, 60 min,常温常压),所用聚丙烯酰胺的质量浓度为100 g/L。使用凝胶成像仪观察条带位置并拍照。
1.2.3 酶活测定通过测定还原型辅酶Ⅰ(NADH)在340 nm下的吸光度变化来表征甘氨酸裂解酶系整体裂解方向的催化活性。酶活测定体系为:200 μL体系、1 mmol/L甘氨酸、1 mmol/L NAD+、1 mmol/L四氢叶酸、0.1 mmol/L磷酸吡哆醛、6 μmol/L P-蛋白、13 μmol/L T-蛋白、8 μmol/L L-蛋白、100 mmol/L Tris-HCl(pH=7.5)以及6 μmol/L H-蛋白野生型或突变型,甘氨酸作为整体反应的启动项最后加入。加入甘氨酸后立即将体系置于酶标仪中测定NADH的吸光度,每间隔5 s测定一次。整体反应温度设定为37 ℃,以反应5 min内初始阶段的线性反应速率计算酶活。酶活的定义为:每分钟生成1 μmoL NADH所用H-蛋白的量为一个酶活单位(U)。酶活测定均平行进行3次,结果取平均值±标准差。
统计学检验由R version 3.5.3运行获得。通过方差分析(F检验)计算样本中两组数据之间的P值,P < 0.05认为差异具有统计学意义。
1.2.4 突变体的结构预测和可视化H-蛋白68位突变体模型(H-D68R,H-D68G)和70位突变体模型(H-Y70R,H-Y70L)均由Alphafold2构建(源代码:https://github.com/deepmind/alphafold)[25]。每个突变体建模完成之后会产生ranked_{0, 1, 2, 3, 4}.pdb共5个模型结构,且这5个模型结构均已经过能量优化并按照模型置信度的大小排列。其中ranked_0.pdb的置信度最高,本研究均选用ranked_0.pdb作为最终建模结果,以便从分子层面上对酶活结果进行分析和阐释。本文中蛋白空腔体积均由在线服务器3Vee (http://3vee.molmovdb.org/)计算得出,所有蛋白质的可视化均由PyMOL软件完成。
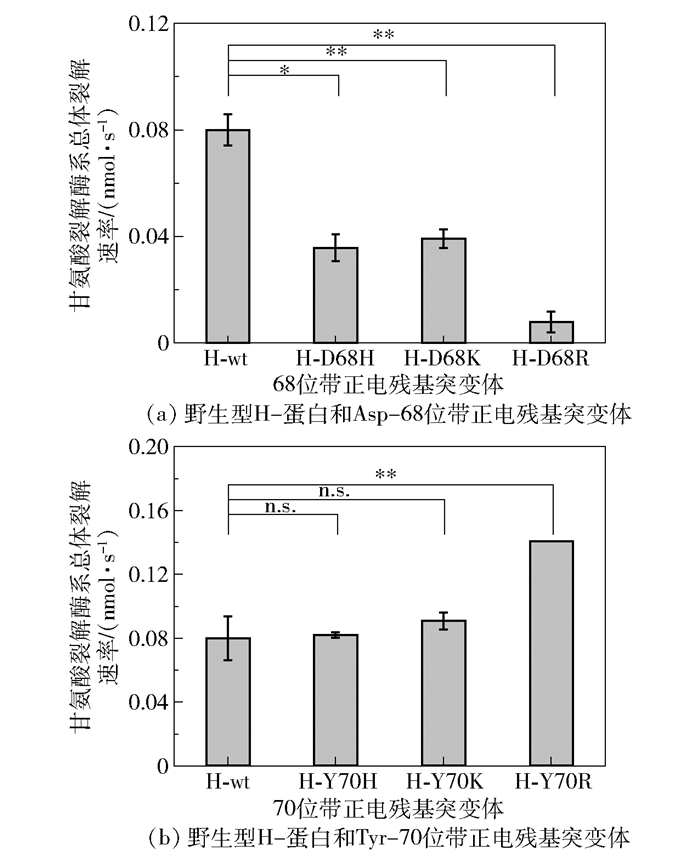
2 结果与讨论 2.1 H-蛋白Asp-68和Tyr-70位带正电突变结果在H-蛋白Ser-67位点的研究中,我们将空腔内关键氨基酸Ser-67突变为侧链带正电的氨基酸后,甘氨酸裂解酶系的整体酶活相对野生型均有一定下降[24]。本研究将Asp-68和Tyr-70位点分别突变为精氨酸(Arg)、赖氨酸(Lys)和组氨酸(His),其中,Asp-68对应的突变体分别记为H-D68R、H-D68K和H-D68H,Tyr-70对应的突变体分别记为H-Y70R、H-Y70K和H-Y70H,考察突变体相对野生型的甘氨酸裂解酶系的整体酶活变化。
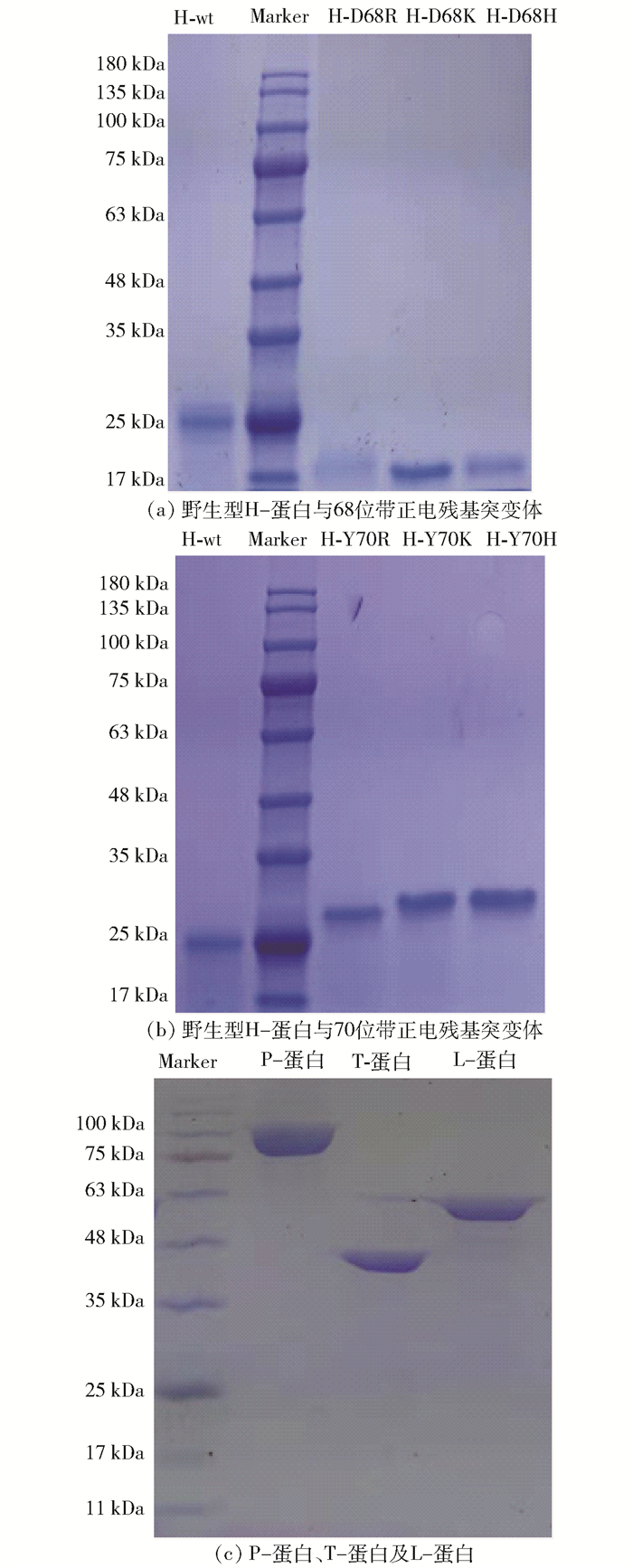
2.1.1 蛋白表达和纯化结果图 1(a)和1(b)分别为68位带正电残基突变体和70位带正电残基突变体的SDS-PAGE结果。通过异源表达及蛋白纯化,野生型H-蛋白(H-wt)、Asp-68位带正电残基突变体和Tyr-70位带正电残基突变体在SDS-PAGE上均呈现均一条带,表明成功得到H-蛋白及其突变体的纯化蛋白,其纯度满足酶活测定的要求。但是,H-蛋白突变体和野生型H-蛋白的表观分子量(约25 kDa)和理论分子量(约14 kDa)并不一致,这可能是由于H-蛋白具有良好的热稳定性,在电泳之前的沸水灭活处理并不能使蛋白的三维结构被完全破坏,导致H-蛋白在电泳图中的条带位置并不完全由理论分子量决定,从而呈现出条带位置的差异[26]。此外,我们还对甘氨酸裂解酶系中的P-蛋白(约104 kDa)、T-蛋白(约41 kDa)和L-蛋白(约51 kDa)进行了异源表达及纯化实验,其凝胶电泳结果如图 1(c)所示,结果表明成功得到纯化蛋白,其纯度满足酶活测定要求,得到的纯化蛋白用于后续甘氨酸裂解酶系的整体酶活测定。

|
图 1 野生型H-蛋白、H蛋白68位带正电残基突变体、H蛋白70位带正电残基突变体、P-蛋白、T-蛋白及L-蛋白的SDS-PAGE结果 Fig.1 SDS-PAGE results of wild-type H-protein, H-protein D68 mutants with positively charged residues, H-protein Y70 mutants with positively charged residues and proteins P, T, L |
分别测定野生型H-蛋白以及Asp-68和Tyr-70带正电残基突变体的酶活,结果如图 2所示。图 2(a)中,Asp-68突变体的甘氨酸裂解酶系整体酶活相对野生型均有不同程度的降低,H-D68K、H-D68H和H-D68R的酶活分别降低了44.6%、48.9%和90.2%,表明H-蛋白的Asp-68位点对于甘氨酸裂解酶系的整体酶活具有重要影响。上述Asp-68位带正电残基突变体的酶活均降低,这与Ser-67位带正电残基突变体的酶活变化趋势类似(H-S67R、H-S67K和H-S67H的酶活相对野生型H-蛋白分别降低了9.3%、6.5%和3.1%)[24]。Tyr-70位点在甘氨酸裂解酶系的整体酶活中也发挥了重要作用(图 2(b)),与Ser-67位点和Asp-68位点不同的是,当Tyr-70位点突变为带正电的氨基酸时,突变体的甘氨酸裂解酶系整体酶活相对野生型均没有降低,其中H-Y70R突变体的整体酶活相较于野生型提高了75.6%。
|
*P < 0.05,** P < 0.01,n.s.表示P>0.05,下同。 图 2 野生型H-蛋白与Asp-68、Tyr-70位带正电残基突变体的酶活比较 Fig.2 Comparison of enzyme activities of wild-type H-protein and mutants with positively charged residues at Asp-68 and Tyr-70 |
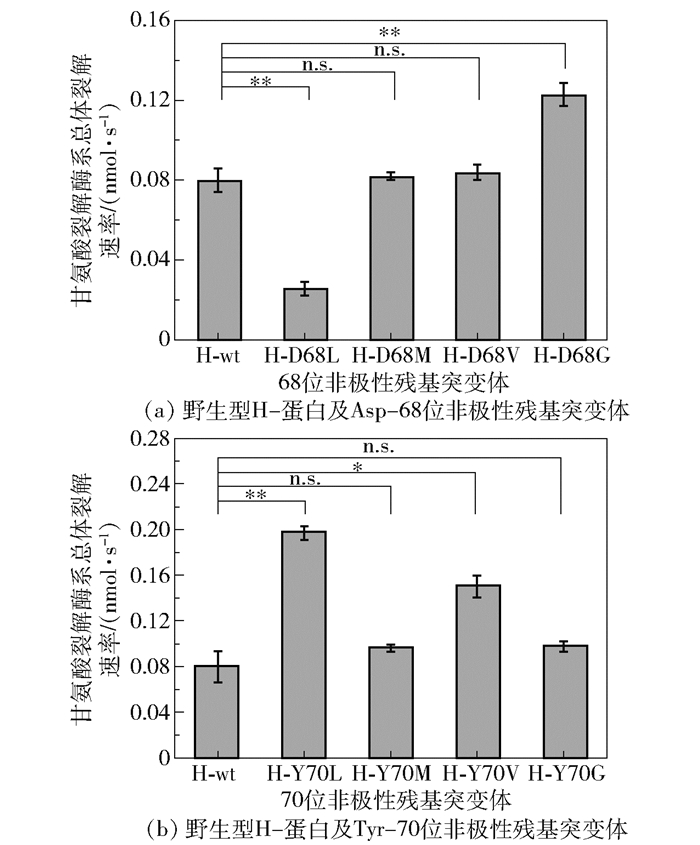
在前期研究中,我们发现当H-蛋白空腔内的关键氨基酸残基Ser-67位点突变为非极性侧链氨基酸残基后,大部分突变体的酶活相较于野生型呈现提高的趋势[24]。在本研究中我们继续开展Asp-68和Tyr-70的非极性突变研究,将Asp-68和Tyr-70分别突变为甘氨酸(Gly)、缬氨酸(Val)、甲硫氨酸(Met)和亮氨酸(Leu)这4种非极性氨基酸,其中,Asp-68对应的突变体分别记为H-D68G、H-D68V、H-D68M和H-D68L,Tyr-70对应的突变体分别记为H-Y70G、H-Y70V、H-Y70M和H-Y70L,分析突变前后甘氨酸裂解酶系的整体酶活变化。
2.2.1 蛋白表达与纯化结果图 3(a)和3(b)分别为68位非极性残基突变体和70位非极性残基突变体的SDS-PAGE结果。通过异源表达及蛋白纯化,野生型H-蛋白、Asp-68位非极性残基突变体和Tyr-70位非极性残基突变体均呈现均一条带,表明蛋白表达及纯化成功,其纯度满足酶活测定要求。图 3中H蛋白突变体和野生型H-蛋白的条带位置差异主要是由于H-蛋白具有良好的热稳定性,在电泳之前的沸水灭活处理不能使蛋白三维结构被完全破坏[26]。
|
图 3 野生型H-蛋白、H蛋白68位非极性残基突变体和H蛋白70位非极性残基突变体的SDS-PAGE结果 Fig.3 SDS-PAGE results of wild-type H-protein, H-protein D68 mutants with nonpolar residues and H-protein Y70 mutants with nonpolar residues |
分别测定野生型H-蛋白、Asp-68位非极性残基突变体和Tyr-70位非极性残基突变体的甘氨酸酶系整体酶活,结果如图 4所示。图 4(a)中,除H-D68L外,Asp-68位非极性残基突变体的甘氨酸裂解酶系整体酶活相对于野生型H-蛋白均没有下降,H-D68G突变体的整体酶活相对野生型H-蛋白提高了53.6%。图 4(b)中,Tyr-70位点的4个非极性突变体的整体酶活相较于野生型均没有下降,H-Y70V和H-Y70L突变体的酶活相较于野生型分别提高了87%和146%。以上结果表明,将氨甲基掉落过程的潜在关键极性氨基酸突变为非极性氨基酸后,甘氨酸酶系的整体酶活变化总体上倾向于维持或提升,仅H-D68L突变体对整体酶活不利。
|
图 4 野生型H-蛋白与Asp-68、Tyr-70位非极性残基突变体的酶活比较 Fig.4 Comparison of enzyme activities of wild-type H-protein and mutants with nonpolar residues at Asp-68 and Tyr-70 |
为了进一步在分子层面上理解正电突变和非极性突变对酶活的影响,我们选择酶活变化比较明显的H-蛋白突变体:H-D68R、H-D68G和H-Y70R、H-Y70L作为研究对象,建立突变体蛋白模型并分析突变前后硫辛酰胺与H-蛋白空腔内的氨基酸相互作用的变化,结果如图 5所示。野生型H-蛋白的Asp-68残基会与硫辛酰胺中氨甲基的氮原子形成氢键相互作用,当D68残基突变为R68后,其侧链氨基酸残基带正电,与同样带正电的氨甲基产生静电斥力。由于突变后的R68残基空间位置处于氨甲基基团的下方,此方向的静电斥力依然使硫辛酰胺难以掉落,且R68残基侧链更长,静电斥力存在的时间较长。在这种情况下,硫辛酰胺在H-蛋白空腔内的运动会受到长时间的阻碍,硫辛酰胺的释放速度会进一步减慢,导致甘氨酸裂解酶系的整体酶活降低。当D68突变为G68后,野生型H-蛋白中原有的氢键相互作用消失,这一过程中硫辛酰胺的释放不受68位氨基酸的影响,而且甘氨酸侧链仅有一个氢原子,占据的空间更小,H-蛋白的空腔体积由野生型的490 Å3扩大至560 Å3,有助于硫辛酰胺的释放,使得甘氨酸裂解酶系的整体酶活上升。Tyr-70位点位于H-蛋白空腔的边缘位置,在硫辛酰胺掉落过程中会与之形成氢键,从而影响硫辛酰胺离开疏水空腔。当Y70突变为R70后,相互作用由氢键变为静电斥力。与Asp-68位点不同的是,70位氨基酸残基在空间位置上处于氨甲基基团的上方,此方向的静电斥力会促进硫辛酰胺的释放,引起甘氨酸裂解酶系的整体酶活上升。当Y70突变为L70时,非极性氨基酸Leu与硫辛酰胺的氨甲基无法形成相互作用,原有的氢键相互作用消失,有利于硫辛酰胺的释放。Leu侧链在空间位置上朝向空腔外部,占据的空腔体积小,空腔体积由野生型的490 Å3扩大至558 Å3,使得硫辛酰胺在空腔内的活动范围变大,进一步促进硫辛酰胺的释放,使甘氨酸裂解酶系的整体酶活提高。

|
图 5 野生型H-蛋白、68位突变体(H-D68R、H-D68G)和70位突变体(H-Y70R、H-Y70L)中关键氨基酸残基与氨甲基相互作用的变化 Fig.5 Changes of interaction between the aminomethyl moiety and the key amino acid residues in the wild-type H-protein, the 68-position mutants (H-D68R, H-D68G) and the 70-position mutants (H-Y70R, H-Y70L) |
本文对T-蛋白诱导H-蛋白释放硫辛酰胺过程的潜在关键氨基酸残基Asp-68和Tyr-70进行了系统突变,探究Asp-68和Tyr-70位点对甘氨酸裂解酶系整体酶活的影响。结果表明,当Asp-68突变为带正电的氨基酸后,突变体的整体酶活相对野生型呈现下降趋势,其中H-D68R突变体的酶活下降了90.2%。当Asp-68突变为非极性氨基酸后,突变体的整体酶活倾向于维持或提升,其中H-D68G突变体的酶活相较野生型H-蛋白提高了53.6%。Tyr-70突变为带正电氨基酸或非极性氨基酸后,可维持或提升甘氨酸裂解酶系的整体酶活,其中H-Y70L突变体的酶活相较于野生型提高了146%。突变前后硫辛酰胺与H-蛋白空腔内氨基酸的相互作用分析结果表明,甘氨酸裂解酶系整体酶活的变化是H-蛋白的68和70位残基的突变阻碍或促进硫辛酰胺释放所导致的。
本研究通过对H-蛋白进行定向突变,实现对甘氨酸裂解酶系整体酶活的调控,对于定量调控甘氨酸裂解酶系的催化效率和深入理解硫辛酰胺的释放过程具有重要作用。同时,为类似的多酶体系复合物(如丙酮酸脱氢酶系和酮戊二酸脱氢酶系)的深入研究和定向改造提供思路。在后续的研究中,我们将对硫辛酰胺进入H-蛋白空腔过程的机制和相互作用的方式进行研究,在硫辛酰胺的进入与释放两方面综合实现对甘氨酸裂解酶系酶活的精准调控,为甘氨酸合成的定向改造以及提高C1合成效率提供理论指导。
| [1] |
MULUGETTA Y, URBAN F. Deliberating on low carbon development[J]. Energy Policy, 2010, 38(12): 7546-7549. DOI:10.1016/j.enpol.2010.05.049 |
| [2] |
GIL L, BERNARDO J. An approach to energy and climate issues aiming at carbon neutrality[J]. Renewable Energy Focus, 2020, 33: 37-42. DOI:10.1016/j.ref.2020.03.003 |
| [3] |
ANWAR M N, FAYYAZ A, SOHAIL N F, et al. CO2 utilization: turning greenhouse gas into fuels and valuable products[J]. Journal of Environmental Management, 2020, 260: 110059. DOI:10.1016/j.jenvman.2019.110059 |
| [4] |
ALPER E, ORHAN O Y. CO2 utilization: developments in conversion processes[J]. Petroleum, 2017, 3(1): 109-126. DOI:10.1016/j.petlm.2016.11.003 |
| [5] |
YU H, LIAO J C. A modified serine cycle in Escherichia coli coverts methanol and CO2 to two-carbon compounds[J]. Nature Communications, 2018, 9(1): 3992. DOI:10.1038/s41467-018-06496-4 |
| [6] |
CLAASSENS N J. Reductive glycine pathway: a versatile route for one-carbon biotech[J]. Trends in Biotechnology, 2021, 39(4): 327-329. DOI:10.1016/j.tibtech.2021.02.005 |
| [7] |
BAR-EVEN A. Formate assimilation: the metabolic architecture of natural and synthetic pathways[J]. Biochemistry, 2016, 55(28): 3851-3863. DOI:10.1021/acs.biochem.6b00495 |
| [8] |
FEI Q, GUARNIERI M T, TAO L, et al. Bioconversion of natural gas to liquid fuel: opportunities and challenges[J]. Biotechnology Advances, 2014, 32(3): 596-614. DOI:10.1016/j.biotechadv.2014.03.011 |
| [9] |
BAR-EVEN A, NOOR E, LEWIS N E, et al. Design and analysis of synthetic carbon fixation pathways[J]. Proceedings of the National Academy of Sciences, 2010, 107(19): 8889-8894. DOI:10.1073/pnas.0907176107 |
| [10] |
LI Y, CHEN J, LUN S Y. Biotechnological production of pyruvic acid[J]. Applied Microbiology and Biotechnology, 2001, 57(4): 451-459. DOI:10.1007/s002530100804 |
| [11] |
FINOGENOVA T V, MORGUNOV I G, KAMZOLOVA S V, et al. Organic acid production by the yeast Yarrowia lipolytica: a review of prospects[J]. Applied Biochemistry and Microbiology, 2005, 41(5): 418-425. DOI:10.1007/s10438-005-0076-7 |
| [12] |
XU P, QIU J H, GAO C, et al. Biotechnological routes to pyruvate production[J]. Journal of Bioscience and Bio- engineering, 2008, 105(3): 169-175. DOI:10.1263/jbb.105.169 |
| [13] |
KOH-BANERJEE P K, FERREIRA M P, GREENWOOD M, et al. Effects of calcium pyruvate supplementation during training on body composition, exercise capacity, and metabolic responses to exercise[J]. Nutrition, 2005, 21(3): 312-319. DOI:10.1016/j.nut.2004.06.026 |
| [14] |
KIKUCHI G, MOTOKAWA Y, YOSHIDA T, et al. Glycine cleavage system: reaction mechanism, physiological significance, and hyperglycinemia[J]. Proceedings of the Japan Academy Series B—Physical and Biological Sciences, 2008, 84(7): 246-263. DOI:10.2183/pjab.84.246 |
| [15] |
OKAMURA-IKEDA K, OHMURA Y, FUJIWARA K, et al. Cloning and nucleotide sequence of the gcv operon encoding the Escherichia coli glycine-cleavage system[J]. European Journal of Biochemistry, 1993, 216(2): 539-548. DOI:10.1111/j.1432-1033.1993.tb18172.x |
| [16] |
MACHEREL D, BOURGUIGNON J, FOREST E, et al. Expression, lipoylation and structure determination of recombinant pea H-protein in Escherichia coli[J]. European Journal of Biochemistry, 1996, 236(1): 27-33. DOI:10.1111/j.1432-1033.1996.00027.x |
| [17] |
OKAMURA-IKEDA K, FUJIWARA K, MOTOKAWA Y. The amino-terminal region of the Escherichia coli T-protein of the glycine cleavage system is essential for proper association with H-protein[J]. European Journal of Biochemistry, 1999, 264(2): 446-452. DOI:10.1046/j.1432-1327.1999.00637.x |
| [18] |
KUME A, KOYATA H, SAKAKIBARA T, et al. The glycine cleavage system: molecular cloning of the chicken and human glycine decarboxylase cDNAs and some characteristics involved in the deduced protein structures[J]. The Journal of Biological Chemistry, 1991, 266(5): 3323-3329. DOI:10.1016/S0021-9258(18)49991-7 |
| [19] |
PERHAM R N. Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions[J]. Annual Review of Biochemistry, 2000, 69(1): 961-1004. DOI:10.1146/annurev.biochem.69.1.961 |
| [20] |
DOUCE R, BOURGUIGNON J, NEUBURGER M, et al. The glycine decarboxylase system: a fascinating complex[J]. Trends in Plant Science, 2001, 6(4): 167-176. DOI:10.1016/S1360-1385(01)01892-1 |
| [21] |
GUILHAUDIS L, SIMORRE J P, BLACKLEDGE M, et al. Combined structural and biochemical analysis of the H-T complex in the glycine decarboxylase cycle: evidence for a destabilization mechanism of the H-protein[J]. Biochemistry, 2000, 39(15): 4259-4266. DOI:10.1021/bi992674w |
| [22] |
GUEGUEN V, MACHEREL D, NEUBURGER M, et al. Structural and functional characterization of H protein mutants of the glycine decarboxylase complex[J]. The Journal of Biological Chemistry, 1999, 274(37): 26344-26352. DOI:10.1074/jbc.274.37.26344 |
| [23] |
OKAMURA-IKEDA K, HOSAKA H, MAITA N, et al. Crystal structure of aminomethyltransferase in complex with dihydrolipoyl-H-protein of the glycine cleavage system: implications for recognition of lipoyl protein substrate, disease-related mutations, and reaction mechanism[J]. The Journal of Biological Chemistry, 2010, 285(24): 18684-18692. DOI:10.1074/jbc.M110.110718 |
| [24] |
ZHANG H, LI Y C, NIE J L, et al. Structure-based dynamic analysis of the glycine cleavage system suggests key residues for control of a key reaction step[J]. Communications Biology, 2020, 3(1): 756. DOI:10.1038/s42003-020-01401-6 |
| [25] |
JUMPER J, EVANS R, PRITZEL A, et al. Highly accurate protein structure prediction with AlphaFold[J]. Nature, 2021, 596(7873): 1-11. DOI:10.1038/d41586-021-02137-x |
| [26] |
ZHANG X Y, LI M, XU Y Y, et al. Quantitative study of H protein lipoylation of the glycine cleavage system and a strategy to increase its activity by co-expression of LplA[J]. Journal of Biological Engineering, 2019, 13(1): 32. DOI:10.1186/s13036-019-0164-5 |








