2. 深圳市中医院, 深圳 518000
2. Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518000, China
雷公藤(Tripterygium wilfordii Hook F)系卫矛科植物,主要产自浙江、江苏等地。雷公藤作为一种传统中药材,始记于《神农本草经》[1],其性凉味辛,归肝、肾经,具有免疫调节和抗炎作用[2],是临床上首选的中药免疫抑制剂。然而雷公藤的治疗剂量接近中毒剂量[1],极大地限制了在临床上的广泛应用。因此,雷公藤的减毒持效研究成为近年关注的焦点。雷公藤的主要化学成分为生物碱类、萜类,其中,生物碱类主要成分有雷公藤春碱、雷公藤晋碱、雷公藤次碱、雷公藤定碱;二萜类主要成分有雷公藤甲素、雷酚内酯;三萜类主要成分有雷公藤红素、雷公藤内酯甲。它们既是雷公藤的主要药效成分,同时也是减毒持效的主要监测对象。
双向固体发酵技术(bidirectional solid fermentation)是以药用真菌发酵药性基质的一种技术[3],产物药性菌质常表现出高于真菌和药性基质相加的药效[2-4],该技术具有增效、解毒、扩大药用范围等显著优势。灵芝(Ganoderma lucidum Karst)是多孔菌科真菌,同时也是药理活性优良的药材。在双向固体发酵中,灵芝作为发酵菌种已经得到许多应用,例如可以明显增强草乌的抗炎镇痛作用[5],有助于附片的解毒增效[6],对于中药的毒性和药效有很好的改善作用。作为发酵中药的常用菌种,灵芝也是发酵雷公藤的良好选择,其产物命名为灵雷菌质。庄毅等[7]建立了灵芝双向固体发酵雷公藤的工艺,发现发酵30天得到的灵雷菌质相比于雷公藤生药表现出了减毒持效的作用。侯志帆等[8]检测了雷公藤发酵前后的成分变化,结果表明双向固体发酵可以降低雷公藤中有毒化合物的含量。以上研究仅检测了小鼠给药后的死亡情况和淋巴细胞的增殖情况,并且仅进行了液相色谱检测,辨认出雷公藤甲素和邻苯二甲酸酯类成分含量的下降。而灵雷菌质对于炎症因子释放的影响还未见报道,对于人正常肝细胞的体外毒性还未经检验,并且雷公藤的主要成分在双向固体发酵中的变化也没有监测。
研究表明,雷公藤的抗炎作用与机体细胞因子的调节有关,现有成药雷公藤多苷(tripterygium glycosides)主要通过影响toll样受体4/核因子-κB(TLR4/NF-κB)信号通路,拮抗和抑制炎症因子的释放,包括人肿瘤坏死因子TNF-α[9]、人白细胞介素IL-1β和IL-6[10-11]等,从而发挥抗炎作用[12-13]。脂多糖(lipopolysaccharide,LPS)可以识别并激活TLR4,常用于启动炎症反应。巨噬细胞通常处于基态,活化后可向促炎的M1和免疫抑制的M2两种表型进行转化[14]。巨噬细胞受LPS刺激后,活化成M1表型,分泌TNF-α、IL-6等M1型标志物以及一氧化氮合酶iNOS等炎症因子,可以用作药物抗炎的研究模型[15]。
体外研究表明,雷公藤甲素可以通过启动肝细胞氧化应激而导致肝损伤。在人正常肝细胞L02中,雷公藤甲素(处理浓度60~180 nmol/L,处理时间12~48 h)表现出时间和剂量依赖的细胞毒性[16],通过引发人正常肝细胞L02活性氧水平升高[17]、线粒体膜电位去极化,从而诱导间质细胞凋亡。动物实验也显示,肝脏是雷公藤毒性损伤的易感靶器官之一[18]。雷公藤肝毒性与功效密切相关,高剂量的雷公藤可使肝脏形成实质性损伤甚至坏死[19]。
本文以灵芝为药用真菌,采用双向固体发酵技术发酵药性基质雷公藤,得到发酵30天和40天的产物灵雷菌质,比较它们对LPS诱导的M1型巨噬细胞释放炎症因子以及对人正常肝细胞增殖的影响,并使用液相色谱-质谱联用(LC-MS)方法分析了雷公藤在发酵前后的成分变化。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料雷公藤购自上海源叶生物科技有限公司,灵芝菌种购自中国微生物菌种保藏管理中心,小鼠RAW264.7细胞系购自江苏凯基生物技术股份有限公司,人正常肝细胞L02细胞系购自北纳创联生物科技有限公司,TNF-α酶联免疫吸附测定(ELISA)试剂盒和IL-6 ELISA试剂盒购自默沙克生物技术有限公司,LPS和CCK-8试剂盒购自北京索莱宝科技有限公司,高糖DMEM培养基和RPMI-1640培养基购自北京沃卡威生物技术有限公司,雷公藤甲素、雷公藤红素、雷酚内酯标准品购自上海源叶生物科技有限公司;其他试剂均为分析纯,购自北京奥博星生物技术有限公司。
1.1.2 仪器超净工作台(SW-CJ-1D型,苏州净化设备有限公司),细胞培养箱(311型,Thermo Fisher公司),恒温恒湿培养箱(LHC-150型,北京陆希科技有限公司),高压灭菌锅(BKQ-B50Ⅱ型,山东博科生物产业有限公司),电子天平(BSA224S型,Sartorius公司),酶标仪(K3Plus型,上海宝予德科学仪器有限公司),离心机(Heraeus Pico 17型,Thermo Fisher公司),恒温干燥箱(DGG-9070A型,上海森信实验仪器有限公司),超高效液相色谱四级杆飞行时间串联质谱仪(XEVO-G2QTOF#YCA121型,Waters公司)。
1.2 双向固体发酵在无菌条件下从灵芝母种斜面上切取0.5 cm3菌块,转接到马铃薯葡萄糖琼脂(PDA)斜面培养基上,置于28 ℃、相对湿度60%的条件下培养6天进行活化[20-21]。在无菌条件下从活化的灵芝斜面上切取3~4块1 cm3菌块,接入装有100 mL液体种子培养基的250 mL锥形瓶中,置于28 ℃且避光的条件下以120 r/min培养6天,挑选液体澄清、菌球大小均匀的液体种子作为发酵菌种。液体种子培养基配方:葡萄糖20 g/L,酵母粉5 g/L,KH2PO4 1.5 g/L,MgSO4 0.75 g/L,CaCO3 2.5 g/L,VB1 0.1 g/L。
将雷公藤于55 ℃干燥粉碎,过五号筛(筛孔尺寸为0.177 mm)后用量筒量取粉末,以100 mL/瓶的量加入到250 mL锥形瓶中,121 ℃灭菌20 min后均匀接种灵芝菌种,接种量分别为7 mL/100 mL(命名为N1组)和10 mL/100 mL(命名为N2组),每组设置3个平行对照。置于27 ℃[22]、相对湿度60%且避光的条件下培养,定期补充一定水分,每天观察灵芝的生长情况并拍照记录全瓶期、旺盛度等。在发酵的第30天和第40天,从N1组和N2组中收集灵雷菌质,于55 ℃干燥粉碎,所得灵雷菌质粉末分别标记为N1-G30(N1组发酵30天)、N2-G30(N2组发酵30天)、N1-G40(N1组发酵40天)、N2-G40(N2组发酵40天)。固态发酵培养基中仅含雷公藤中药基质。
精密称取灵雷菌质及雷公藤粉末0.2 g,置于2 mL无菌管中进行提取,加入无水甲醇1.5 mL,于30 ℃、500 W超声提取1 h,冷却至室温,以12 000 r/min离心10 min,分离得到上清液。随机取样10组,每组样本重复提取3次。混合每组上清液,经过0.22 μm微孔滤膜后,将一部分滤液直接用于成分检测,另一部分继续冻干,然后精密称取0.1 mg重新溶解于1 mL超纯水中,于121 ℃灭菌20 min,然后稀释成不同浓度用于细胞试药。
1.3 细胞培养小鼠RAW264.7细胞置于37 ℃、含5% CO2的细胞培养箱中培养,以含有10%胎牛血清、100 U/mL青霉素和链霉素双抗的高糖DMEM培养基为完全培养基,传代周期为2~3天,选取对数生长期细胞进行试验。
人正常肝细胞L02置于37 ℃、含5%CO2的细胞培养箱中培养,以含有10%胎牛血清的RPMI-1640培养基为完全培养基,传代周期为2~3天,选取对数生长期细胞进行试验。
1.4 ELISA试验通过ELISA试验检测灵雷菌质对小鼠RAW264.7细胞释放TNF-α和IL-6的影响。小鼠RAW264.7细胞以每孔10 000个/100 μL接种于96孔板,LPS处理的质量浓度为1 μg/mL,雷公藤、灵雷菌质处理的质量浓度为3.75 μg/mL。设置对照组(加入LPS但未加样品(雷公藤、灵雷菌质)),试验组(加入LPS和样品)。将各组置于37 ℃、含5% CO2的细胞培养箱中培养48 h,离心后仔细收集上清,使用ELISA试剂盒检测TNF-α和IL-6的相对含量。
1.5 CCK-8试验通过CCK-8试验检测灵雷菌质对人正常肝细胞L02增殖的影响。人正常肝细胞L02以每孔10 000个/100 μL接种于96孔板,雷公藤和灵雷菌质处理的质量浓度为1.88、3.75、7.5 μg/mL。设置对照组(有细胞但未加样品(雷公藤、灵雷菌质)),试验组(有细胞且加入样品)。使用CCK-8试剂盒测定细胞吸光度值,按照式(1)计算细胞活力。
| $ C=\frac{A_{\mathrm{c}}-A_{0}}{A_{\mathrm{b}}-A_{0}} \times 100 \% $ | (1) |
式中,C为细胞活力,Ac为试验组吸光度值,Ab为对照组吸光度值,A0为背景吸光度值。
1.6 LC-MS测试通过LC-MS对比雷公藤和灵雷菌质的成分差异[23-24]。将样品适当稀释后进行检测。色谱运行条件:以水-乙腈为流动相进行梯度洗脱,流速0.2 mL/min,柱温45 ℃,进样量5 μL。质谱运行条件:ESI+,扫描质量范围为质荷比m/z 50~1 500,毛细管电压3 000 V,检测器电压3 000 V,步长5 spectra/s。运用MassLynx V4.1软件处理分析数据,采用Elemental composition计算m/z对应的分子式,推测相关成分。结果具有高分辨率,对于m/z 956,分辨率≥ 20 000半高全宽(FWHM),且不损失灵敏度;对于m/z 152.071 2,分辨率≥10 000 FWHM,且不损失灵敏度。分析时调用4位的m/z。
1.7 统计学分析实验数据采用Origin统计软件(2018版)进行分析,样本均数的比较采用完全随机设计的单因素方差分析。P < 0.05表示差异有统计学意义。重复数n=3,结果以平均值±标准差表示。
2 结果与讨论 2.1 雷公藤双向型固体发酵过程观察雷公藤接种灵芝进行双向固体发酵,在发酵过程中密切观察N1组和N2组锥形瓶中灵芝的生长状况,并拍照记录,结果如图 1所示。发酵第8天,N2组开始出现灵芝菌丝;发酵第14天,N1组开始出现灵芝菌丝;发酵第17天,N2组中灵芝已基本长满全瓶;发酵第22天,N1组中灵芝已长至半瓶,N2组已完全长满全瓶;发酵第25天,N1组中灵芝已基本长满全瓶;发酵第30天,N1组中灵芝已完全长满全瓶,N2组中部分灵芝成柱状生长;发酵第40天,N1组中出现柱状灵芝,N2组中柱状灵芝生长迅速。结果表明,在7 mL/100 mL和10 mL/100 mL的接种量下,30天可以使灵芝对雷公藤进行充分发酵,并且接种量较多的灵芝生长更快。

|
图 1 N1组和N2组中灵芝的生长状况 Fig.1 Growth status of Ganoderma lucidum in N1 and N2 groups |
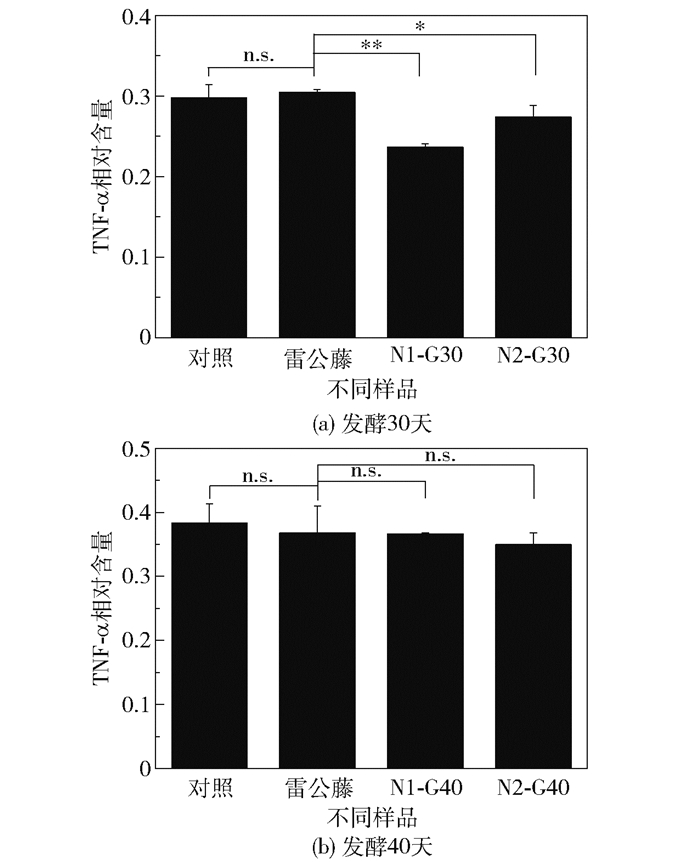
图 2为不同样品对LPS诱导RAW264.7细胞释放TNF-α的影响。由图 2(a)可知,N1-G30和N2-G30组的TNF-α相对含量均低于雷公藤组。N1-G30组的TNF-α相对含量为0.236,与雷公藤组相比降低了22.37%(P < 0.01);N2-G30组的TNF-α相对含量为0.274,与雷公藤组相比降低了9.87%(P < 0.05)。由图 2(b)可知,N1-G40和N2-G40组的TNF-α相对含量与雷公藤组没有显著差异(P>0.05)。
|
*P<0.05,**P<0.01,n.s.表示P>0.05,下同。 图 2 不同样品对LPS诱导RAW264.7细胞释放TNF-α的影响 Fig.2 Effects of different samples on the content of TNF-α released from RAW264.7 cells induced by LPS |
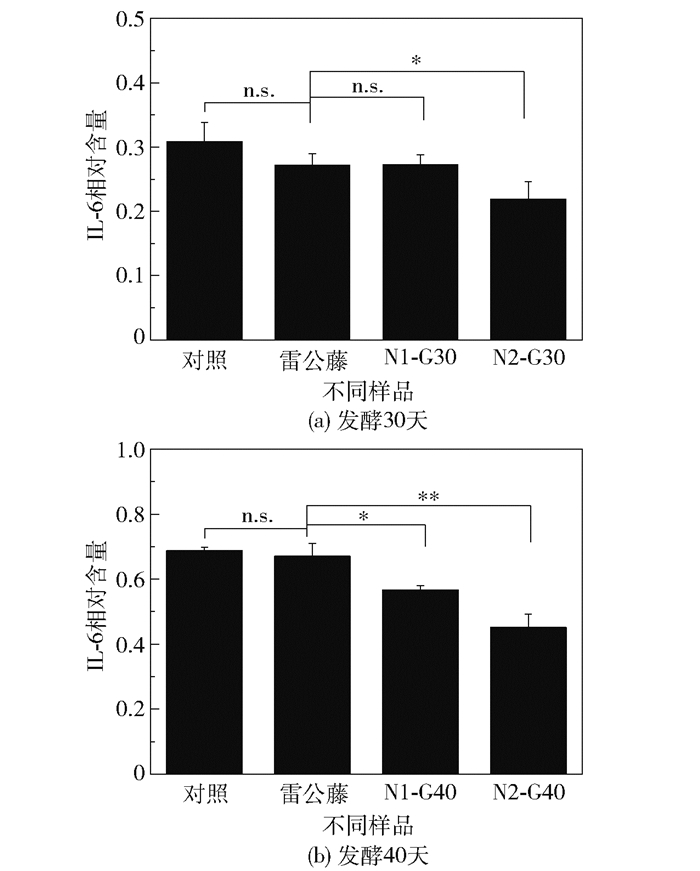
图 3为不同样品对LPS诱导RAW264.7细胞释放IL-6的影响。由图 3(a)可知,仅N2-G30组的IL-6相对含量低于雷公藤组,N2-G30组的IL-6相对含量为0.220,与雷公藤组相比降低了19.12%(P < 0.05)。由图 3(b)可知,N1-G40和N2-G40组的IL-6相对含量均低于雷公藤组。N1-G40组的IL-6相对含量为0.567,与雷公藤组相比降低了15.5%(P < 0.05);N2-G40组的IL-6相对含量为0.451,与雷公藤相比降低了32.79%(P < 0.01)。
|
图 3 不同样品对LPS诱导RAW264.7细胞释放IL-6的影响 Fig.3 Effects of different samples on the content of IL-6 released from RAW264.7 cells induced by LPS |
综合以上结果可知,在3.75 μg/mL的质量浓度下,对于LPS诱导的小鼠RAW264.7细胞释放TNF-α的抑制作用,N1-G30、N2-G30组强于雷公藤组;对于LPS诱导的RAW264.7细胞释放IL-6的抑制作用,N2-G30、N1-G40、N2-G40组强于雷公藤组。虽然各雷公藤组与对照组相比没有抑制炎症因子的释放,但是文献中已有雷公藤在体外抑制炎症因子的报道[25],可能是因为醇提取的条件、试验的质量浓度无法表现出雷公藤的抗炎活性。灵雷菌质的醇提取物中,只有N2-G30对小鼠RAW264.7细胞释放TNF-α和IL-6同时有抑制作用,表现出的抗炎活性有较好的提升。因此,本文进一步探索N2-G30的醇提取物对人正常肝细胞L02增殖的影响。
2.3 灵雷菌质的肝毒性评价图 4为不同质量浓度下雷公藤和N2-G30对人正常肝细胞L02增殖的影响。由结果可知,在1.88 μg/mL的质量浓度下,N2-G30组的细胞活力为51.6%,与雷公藤组相比提高了8.48%(P < 0.05)。在3.75 μg/mL的质量浓度下,N2-G30组的细胞活力为43.76%,与雷公藤组相比提高了14.04%(P < 0.05)。在7.5 μg/mL的质量浓度下,N2-G30组的细胞活力与雷公藤组没有显著差异(P>0.05)。结果表明,与其他质量浓度相比,3.75 μg/mL的N2-G30表现出更好的减毒效果。

|
图 4 不同质量浓度下不同样品对L02细胞增殖的影响 Fig.4 Effect of different samples at different mass concentrations on the cell viability of L02 cells |
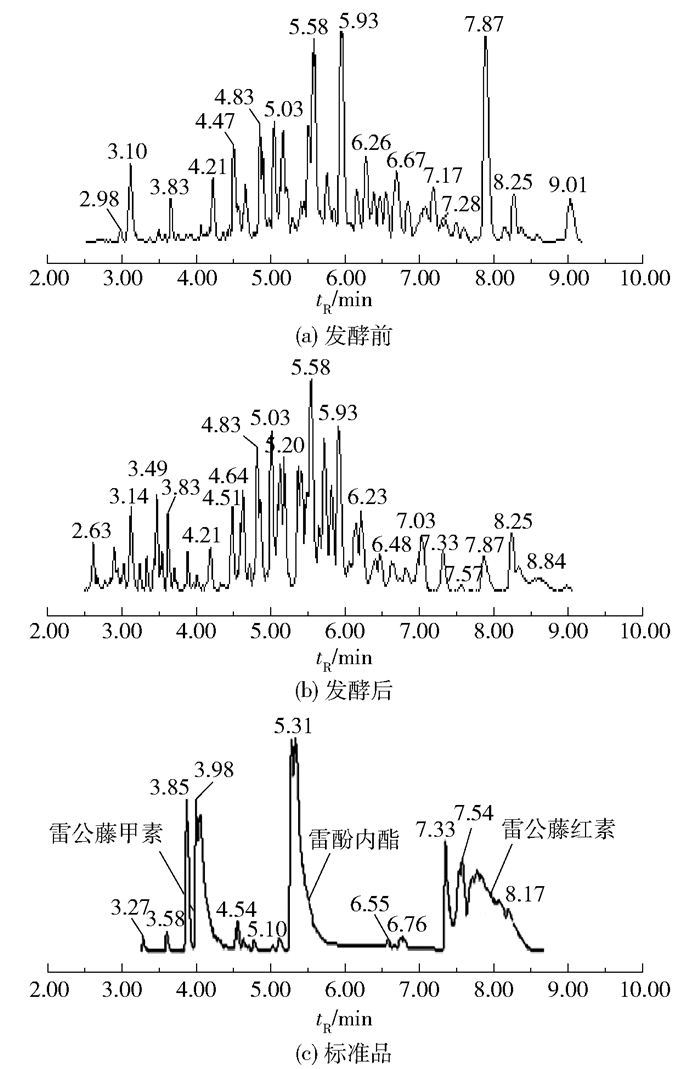
为了进一步探究雷公藤和N2-G30醇提取物的成分差异,选取雷公藤甲素、雷公藤红素、雷酚内酯标准品作为对照进行LC-MS测试,结果如图 5所示。发酵前后的样品在不同保留时间tR处的色谱峰出现了强度不一致的情况,表明灵芝双向固体发酵使雷公藤的成分产生了明显的变化。
|
图 5 雷公藤发酵前后的基峰离子色谱图 Fig.5 Ion chromatograms of basic peaks before and after fermentation of Tripterygium wilfordii |
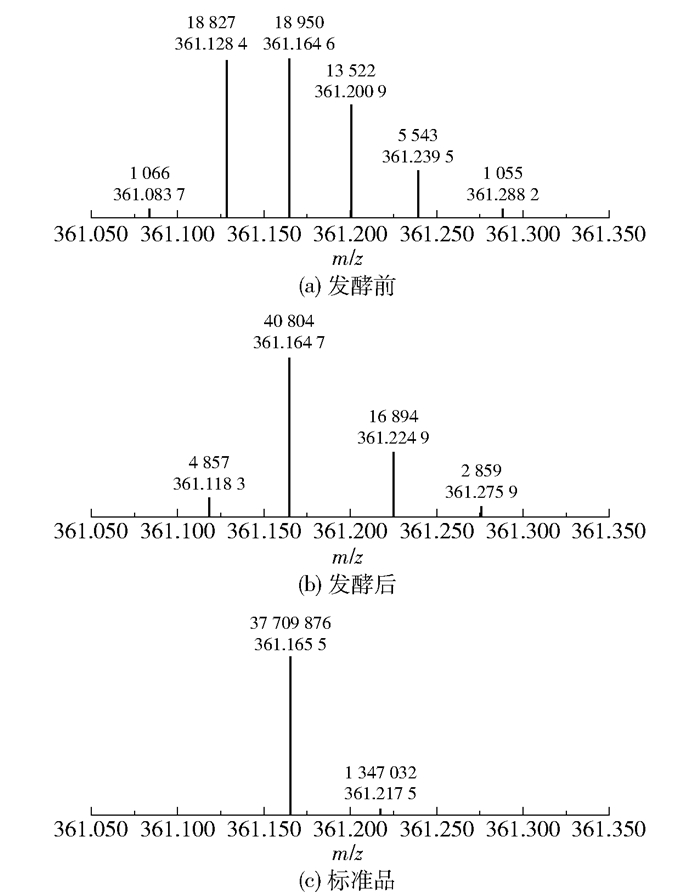
图 6为雷公藤甲素的质谱峰,未提取到色谱峰进行面积积分。雷公藤发酵前后都检测到雷公藤甲素的存在,标准品、雷公藤发酵前、发酵后雷公藤甲素的准分子离子峰分别为m/z 361.165 5[M+H]+、m/z 361.164 6[M+H]+、m/z 361.164 7[M+H]+。雷公藤发酵后的峰强度由发酵前的18 950增加到40 804,表明雷公藤甲素的含量增加,这与雷公藤抗炎活性的维持有关。
|
每个峰的第一行数字表示峰强度,第二行数字表示质荷比,下同。 图 6 雷公藤甲素的质谱峰 Fig.6 Mass spectra peaks of triptolide |
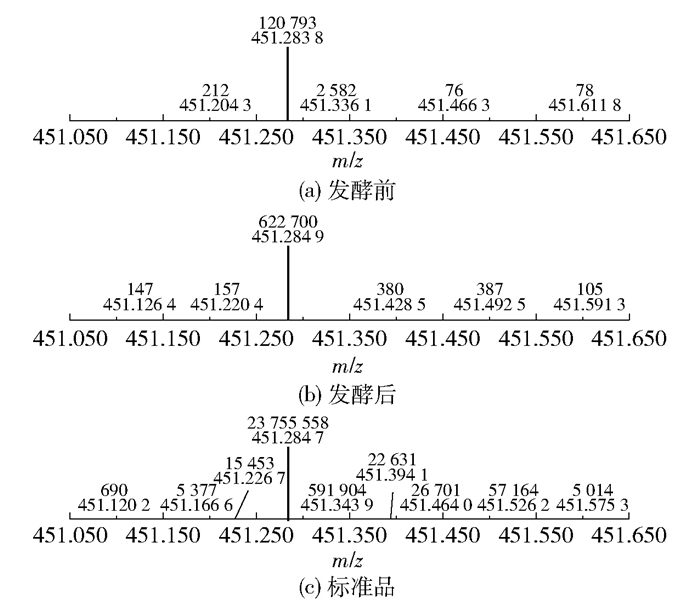
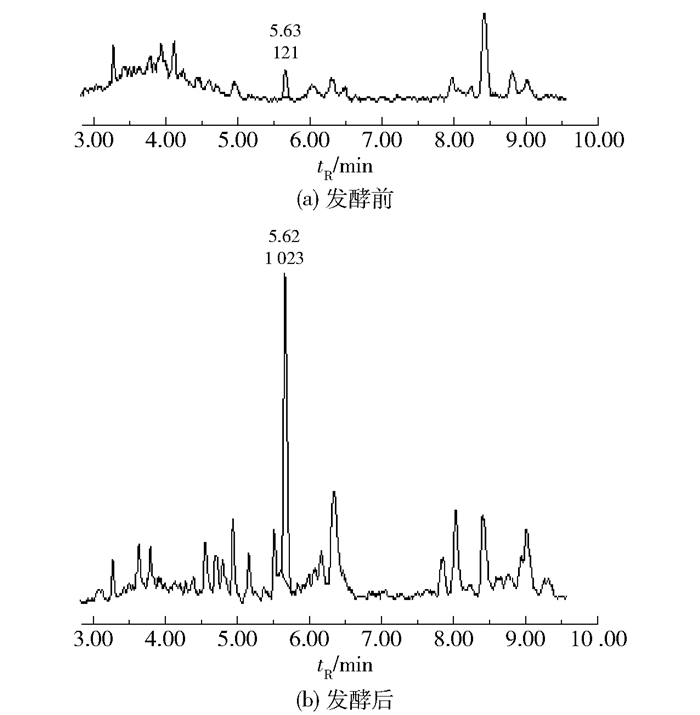
图 7和图 8分别为雷公藤红素的质谱峰和色谱峰。雷公藤发酵前后都检测到雷公藤红素的存在,标准品、雷公藤发酵前、发酵后雷公藤红素的准分子离子峰分别为m/z 451.284 7[M+H]+、m/z 451.283 8[M+H]+、m/z 451.284 9[M+H]+。发酵后雷公藤红素的质谱峰强度由发酵前的120 793增加到622 700,色谱峰面积积分由发酵前的121增加到1 023,均表明雷公藤红素的含量增加,这与雷公藤抗炎活性的维持有关。
|
图 7 雷公藤红素的质谱峰 Fig.7 Mass spectra peaks of celastrol |
|
每个峰的第一行数字表示保留时间,第二行数字表示面积积分。 图 8 雷公藤红素的色谱图 Fig.8 Chromatograms of celastrol |
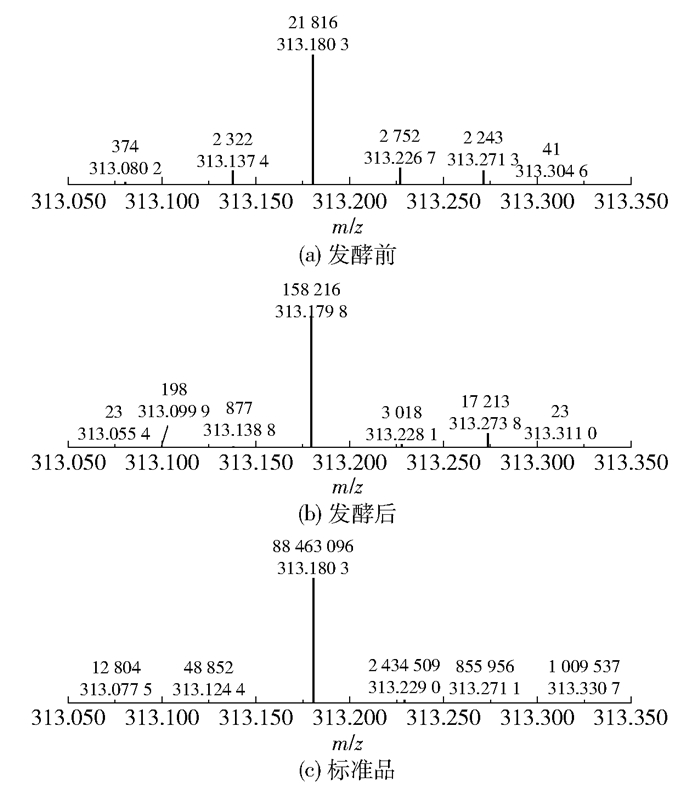
图 9为雷酚内酯的质谱峰,未提取到色谱峰进行面积积分。雷公藤发酵前后都检测到雷酚内酯的存在,标准品、雷公藤发酵前、发酵后雷酚内酯的准分子离子峰分别为m/z 313.180 3[M+H]+、m/z 313.180 3[M+H]+、m/z 313.179 8[M+H]+。发酵后的峰强度由发酵前的21 816增加到158 216,表明雷酚内酯的含量增加,这与雷公藤抗炎活性的维持有关。
|
图 9 雷酚内酯的质谱峰 Fig.9 Mass spectra peaks of triptophenolide |
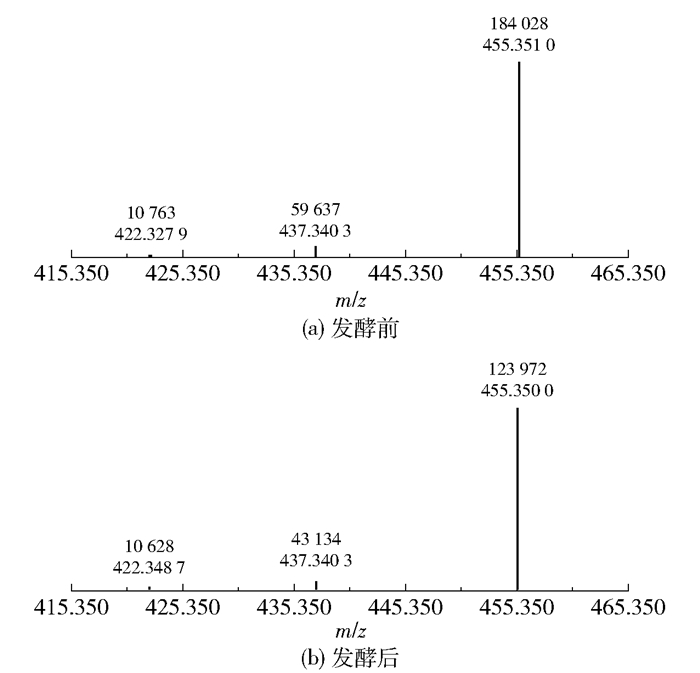
通过m/z查找雷公藤春碱、雷公藤晋碱、雷公藤次碱、雷公藤定碱、雷公藤内酯甲的疑似峰,计算并推测其分子式,结果只得到雷公藤内酯甲,其[M+H]+对应的分子式为C30H47O3。图 10为雷公藤内酯甲的质谱峰,未提取到色谱峰进行面积积分。发酵前、发酵后雷公藤内酯甲的准分子离子峰分别为m/z 455.351 0[M+H]+、m/z 455.350 0[M+H]+,并且都存在丢失中性H2O分子的特征峰m/z 437.340 3[M+H-H2O]+,进一步丢失—CH3碎片形成m/z 422.327 9[M+H-H2O-CH3]+及m/z 422.348 7[M+H-H2O-CH3]+。发酵后的准分子离子峰的峰强度由发酵前的184 028降低至123 972,表明雷公藤内酯甲的含量减少[26],这与雷公藤的减毒作用直接相关。
|
图 10 雷公藤内酯甲的质谱峰 Fig.10 Mass spectra peaks of wilforlide A |
N2-G30的质量浓度为3.75 μg/mL时,对小鼠RAW264.7细胞在脂多糖诱导下释放两种促炎因子TNF-α和IL-6都有抑制作用,并且对人正常肝细胞L02的增殖毒性较小。N2-G30中,雷公藤甲素、雷公藤红素、雷酚内酯含量的增加与雷公藤抗炎活性的维持有关,而雷公藤内酯甲含量的减少与雷公藤的减毒作用直接相关。说明灵芝双向固体发酵(接种量10 mL/100 mL,发酵时间30天)能够通过成分的变化影响雷公藤的活性与毒性,从而促进其减毒持效作用的产生。灵芝双向固体发酵技术在中药减毒持效上的应用是值得重视的,今后应在协调好雷公藤“量-效-毒”关系的基础上,不断改进双向发酵技术,从而在根本上降低雷公藤的毒性,真正实现安全有效地用药。
| [1] |
申琳, 运乃茹. 浅述雷公藤研究进展[J]. 医学信息, 2015, 28(36): 393-394. SHEN L, YUN N R. Research progress of Tripterygium wilfordii[J]. Medical Information, 2015, 28(36): 393-394. (in Chinese) |
| [2] |
农程, 王欣之, 江振洲, 等. 雷公藤对免疫系统作用及机制研究进展[J]. 中国中药杂志, 2019, 44(16): 3374-3383. NONG C, WANG X Z, JIANG Z Z, et al. Progress of effect and mechanisms of Tripterygium wilfordii on immune system[J]. China Journal of Chinese Materia Medica, 2019, 44(16): 3374-3383. (in Chinese) |
| [3] |
庄毅. 药用真菌新型(双向型)固体发酵工程[J]. 中国食用菌, 2002, 21(4): 3-6. ZHUANG Y. New type (two-way pattern) solid fermentation engineering in medicinal mushrooms[J]. Edible Fungi of China, 2002, 21(4): 3-6. (in Chinese) DOI:10.3969/j.issn.1003-8310.2002.04.001 |
| [4] |
杨丽娜. 雷公藤制剂的指纹图谱与抗炎细胞药效学研究[D]. 福州: 福建中医药大学, 2014. YANG L N. Fingerprint and anti-inflammatory cellular pharmacodynamics of Tripterygium wilfordii preparation[D]. Fuzhou: Fujian University of Traditional Chinese Medicine, 2014. (in Chinese) |
| [5] |
王身艳, 余黎, 刘学湘, 等. 灵芝双向固体发酵草乌后菌质抗炎镇痛作用研究[J]. 中国医药生物技术, 2012, 7(5): 352-356. WANG S Y, YU L, LIU X X, et al. Studies on anti-inflammatory and analgesic effects of fungal fermentative products of Aconitum kusnezoffii by Ganoderma lucidum bi-directional solid fermentation[J]. Chinese Medicinal Biotechnology, 2012, 7(5): 352-356. (in Chinese) DOI:10.3969/cmba.j.issn.1673-713X.2012.05.006 |
| [6] |
江南, 魏巍, 许晓燕, 等. 双向固体发酵技术对附片解毒增效的初步研究[J]. 时珍国医国药, 2015, 26(11): 2677-2679. JIANG N, WEI W, XU X Y, et al. Preliminary study on detoxification and synergism of Radix Aconiti Lateralis Preparata by bidirectional solid fermentation[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(11): 2677-2679. (in Chinese) |
| [7] |
庄毅, 谢小梅. 药用真菌新型(双向性)固体发酵工程对雷公藤解毒持效的初步研究[J]. 中国中药杂志, 2009, 34(16): 2083-2087. ZHUANG Y, XIE X M. Primary studies of toxicity-reducing and efficacy-maintaining action of fungal fermentative products in Tripterygium wilfordii by a novel bi-directional solid state fungal fermentation[J]. China Journal of Chinese Materia Medica, 2009, 34(16): 2083-2087. (in Chinese) DOI:10.3321/j.issn:1001-5302.2009.16.020 |
| [8] |
侯志帆, 梁永红, 何礼标, 等. 灵芝双向固体发酵雷公藤后菌质化学成分变化初步研究[J]. 中草药, 2012, 43(2): 234-237. HOU Z F, LIANG Y H, HE L B, et al. Chemical constituents changes in Tripterygium wilfordii after ganoderma bidirectional solid fermentation[J]. Chinese Traditional and Herbal Drugs, 2012, 43(2): 234-237. (in Chinese) |
| [9] |
张皖东, 吕诚, 赵宏艳, 等. 雷公藤甲素配伍甘草酸对CIA大鼠血清TNF-α, IL-10的影响[J]. 中国中药杂志, 2007, 32(5): 414-417. ZHANG W D, LV C, ZHAO H Y, et al. Effect of combination glycyrrhizin and triptolide on TNF-α and IL-10 in serum of collagen induced arthritis rats[J]. China Journal of Chinese Materia Medica, 2007, 32(5): 414-417. (in Chinese) DOI:10.3321/j.issn:1001-5302.2007.05.015 |
| [10] |
GABAY C. Interleukin-6 and chronic inflammation[J]. Arthritis Research & Therapy, 2006, 8(Suppl 2): S3. |
| [11] |
RAMADORI P, AHMAD G, RAMADORI G. Cellular and molecular mechanisms regulating the hepatic erythropoietin expression during acute-phase response: a role for IL-6[J]. Laboratory Investigation, 2010, 90(9): 1306-1324. DOI:10.1038/labinvest.2010.85 |
| [12] |
QIN D P, ZHOU Y J, ZHANG S Z, et al. Anti-inflammation of Tripterygium wilfordii polycoride on macrophages and its regulation to inflammation via TLR4/NF-κB[J]. Chinese Herbal Medicines, 2015, 7(2): 155-161. DOI:10.1016/S1674-6384(15)60032-6 |
| [13] |
LUO D, ZUO Z Y, ZHAO H Y, et al. Immunoregulatory effects of Tripterygium wilfordii Hook F and its extracts in clinical practice[J]. Frontiers of Medicine, 2019, 13(5): 556-563. DOI:10.1007/s11684-018-0649-5 |
| [14] |
王青竹, 石婧, 刘琴, 等. 小檗碱促进巨噬细胞系RAW264.7由M1促炎表型向M2抗炎表型极化[J]. 基础医学与临床, 2019, 39(5): 646-651. WANG Q Z, SHI J, LIU Q, et al. Berberine promotes M1 proinflammatory phenotype to M2 anti-inflammatory phenotype polarization in macrophage cell line RAW264.7[J]. Basic & Clinical Medicine, 2019, 39(5): 646-651. (in Chinese) DOI:10.3969/j.issn.1001-6325.2019.05.007 |
| [15] |
LEE H H, SHIN J S, LEE W S, et al. Biflorin, isolated from the flower buds of Syzygium aromaticum L., suppresses LPS-induced inflammatory mediators via STAT1 inactivation in macrophages and protects mice from endotoxin shock[J]. Journal of Natural Products, 2016, 79(4): 711-720. DOI:10.1021/acs.jnatprod.5b00609 |
| [16] |
XI C, PENG S J, WU Z P, et al. Toxicity of triptolide and the molecular mechanisms involved[J]. Biomedicine & Pharmacotherapy, 2017, 90: 531-541. |
| [17] |
LV H W, JIANG L P, ZHU M D, et al. The genus Tripterygium: a phytochemistry and pharmacological review[J]. Fitoterapia, 2019, 137: 104190. DOI:10.1016/j.fitote.2019.104190 |
| [18] |
高丽, 白赟, 柴智, 等. 雷公藤毒性反应研究进展[J]. 中国中医药信息杂志, 2012, 19(4): 107-110. GAO L, BAI Y, CHAI Z, et al. Research progress on toxicity of Tripterygium wilfordii[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2012, 19(4): 107-110. (in Chinese) DOI:10.3969/j.issn.1005-5304.2012.04.052 |
| [19] |
赵庆华, 李晓宇, 冯群, 等. 基于剂量的雷公藤抗小鼠免疫性炎症"效-毒"关联性评价[J]. 中国中药杂志, 2015, 40(6): 1139-1143. ZHAO Q H, LI X Y, FENG Q, et al. Evaluation on dosage-based efficacy-toxicity correlation of Tripterygium wilfordii against immune inflammation in mice[J]. China Journal of Chinese Materia Medica, 2015, 40(6): 1139-1143. (in Chinese) |
| [20] |
苏明声, 谢小梅, 罗闳丹, 等. 雷公藤解毒持效双向发酵工艺的建立[J]. 菌物学报, 2010, 29(2): 294-299. SU M S, XIE X M, LUO H D, et al. Optimization of bi-direction solid fermentation for toxicity-reducing and efficacy-maintaining action of fungal fermentative products of Tripterygium wilfordii[J]. Mycosystema, 2010, 29(2): 294-299. (in Chinese) |
| [21] |
庄毅, 池玉梅, 陈慎宝, 等. 药用真菌新型固体发酵工程与槐芪菌质的研制[J]. 中国药学杂志, 2004, 39(3): 175-178. ZHUANG Y, CHI Y M, CHEN S B, et al. Preparation of medicinal fungal new type bi-directional solid fementation engineering and Huai Qi fungal substance[J]. Chinese Pharmaceutical Journal, 2004, 39(3): 175-178. (in Chinese) DOI:10.3321/j.issn:1001-2494.2004.03.006 |
| [22] |
庄毅. 药用真菌双向性固体发酵工程技术在雷公藤解毒持效中的应用: CN 1911262A[P]. 2007-02-14. ZHUANG Y. Application of bidirectional solid fermentation engineering technology of medicinal fungi in detoxification and persistence of Tripterygium wilfordii: CN 1911262A[P]. 2007-02-14. (in Chinese) |
| [23] |
冯群, 栾永福, 孙蓉. 基于功效和物质基础的雷公藤毒性研究进展[J]. 中国药物警戒, 2013, 10(2): 88-92. FENG Q, LUAN Y F, SUN R. Research development on toxicity of Tripterygium wilfordii related to efficacy and chemical material basis[J]. Chinese Journal of Pharmacovigilance, 2013, 10(2): 88-92. (in Chinese) DOI:10.3969/j.issn.1672-8629.2013.02.008 |
| [24] |
胡峻, 刘超, 郭兰萍, 等. 超高效液相色谱串联质谱同时测定雷公藤药材中5个有效成分[J]. 中国中药杂志, 2016, 41(8): 1469-1473. HU J, LIU C, GUO L P, et al. Determination of five effective components in medicinal material of Tripterygium by UPLC-ESI-MS/MS[J]. China Journal of Chinese Materia Medica, 2016, 41(8): 1469-1473. (in Chinese) |
| [25] |
周俊, 徐艳, 臧银善. 雷公藤的抗炎抗免疫作用研究进展[J]. 医学综述, 2019, 25(24): 4855-4859. ZHOU J, XU Y, ZANG Y S. Research progress in anti-inflammatory and anti-immune effects of Tripterygium wilfordii[J]. Medical Recapitulate, 2019, 25(24): 4855-4859. (in Chinese) |
| [26] |
于东防, 朱海涛, 陈麒. 雷公藤中三萜内酯A分子结构的研究[J]. 中草药, 1992, 23(4): 171-174, 222. YU D F, ZHU H T, CHEN Q. Study on the molecular structure of triptotriterpenoidal lactone A in common threewingnut (Tripterygium wilfordii)[J]. Chinese Traditional and Herbal Drugs, 1992, 23(4): 171-174, 222. (in Chinese) |








