四环素(TC)是一种高效、低成本的广谱抗生素,被广泛用于人类医疗和畜牧业生产中,约占抗生素总用药量的29%[1]。TC的亲水性强,挥发性低,在水生环境中具有显著的持久性[2],半衰期最长可达180d[3]。近年来,TC因表现出严重的环境问题而受到了广泛关注。传统的含TC废水的处理方法主要包括膜过滤[4]、活性炭吸附[5]等物理化学方法以及厌氧[6-7]、好氧[8]等生物方法。物理化学方法的主要缺点是它们不会破坏污染物的结构,只是将污染物从一个阶段转移到另一个阶段[9],且需要添加大量的化学药剂,成本高昂。生物方法的降解率及出水水质都不达标,处理效果也不理想。
近年来,高级氧化技术被认为是一种可以有效降解水环境中TC污染物等生物难降解化合物的技术[10]。其中,半导体光催化技术以光为能源降解污染物而达到治理环境的目的,用于处理废水不会产生二次污染物,处理程度也较为彻底,因而受到越来越多的关注。
自从1972年Fujishima等[11]报道了光辐照下TiO2光敏电解氧化反应以来,其在环境处理和能源生产中的应用研究越来越广泛[12-14]。TiO2具有化学稳定性好、安全无毒、成本低、氧化还原能力强等优点,但其禁带宽度大,导致在可见光范围内吸收差,从而影响了其催化性能[15-17]。TiOF2作为一种新型的氟氧化合物[18],较TiO2的禁带宽度小,对太阳光的响应力更强,光催化效果更好[19]。在主要的过渡金属氧化物半导体中,单斜晶WO3具有较高的可见光谱灵敏度、较好的光稳定性以及较高的电子迁移率,作为一种半导体光催化剂被广泛研究[20-22]。迄今为止,关于WO3与TiO2复合材料的制备及应用已有不少报道,但研究多针对染料降解且材料的活性较低,而针对水环境中微量抗生素降解的研究十分有限,且效果也不理想。关于WO3/TiOF2-TiO2三元复合催化剂的制备及应用的文献报道更少见。
本文提出了一种以TiOF2为基础的WO3/TiOF2-TiO2新型三元复合光催化剂的制备方法。在制备过程中,WO3的加入使部分TiOF2在高温下转化为TiO2,构成三元复合光催化剂。在太阳光下以难降解的盐酸四环素(TTCH)作为目标污染物,测试了复合光催化剂的催化效果并初步探讨了其降解机理。
1 实验部分 1.1 实验原料钛酸丁酯、盐酸、NaOH,福晨(天津)化学试剂有限公司;无水乙醇、乙酸,天津市北联精细化学品开发有限公司;纳米TiO2(P25),德国Degussa公司;氢氟酸、甲醇(MT),天津市富宇精细化工有限公司;钨酸钠(Na2WO4),天津市化学试剂四厂;盐酸四环素,Aladdin工业公司;对苯醌(PBQ),上海麦克林生物制药有限公司;1, 4-对苯二甲酸(PTA),天津市光复精细化工研究所。所用原料均为分析纯,实验用水为超纯水。
1.2 催化剂的制备 1.2.1 TiOF2在低速搅拌下将12.5mL氢氟酸逐滴加入到装有34mL钛酸丁酯的烧杯中,逐滴加入60mL冰乙酸,继续搅拌30min。将得到的溶液移至水热反应釜中,在180℃下恒温20h。自然冷却后在4000r/min的转速下离心沉降,移去上清液,将剩余沉淀物用无水乙醇、超纯水洗涤3次,烘干研磨后得到白色粉末,标记为TiOF2。取部分TiOF2加入5mol/L NaOH溶液,搅拌2h,处理方法与TiOF2相同,得到NaOH处理的TiOF2粉末,标记为OH-TiOF2。
1.2.2 WO3取一定量的Na2WO4溶解在20mL超纯水中,低速搅拌,得到Na2WO4前体溶液。向其中逐滴滴加2mol/L盐酸水溶液,使溶液的pH值为2.0,然后加入超纯水至50mL,逐滴滴加乙酸调节pH值至2.3,继续搅拌30min。将得到的溶液移至水热反应釜中,在180℃下恒温4h。自然冷却后在4000r/min的转速下离心沉降,移去上清液,将剩余沉淀物用无水乙醇、超纯水洗涤3次,烘干研磨后得到淡黄色粉末,标记为WO3。
1.2.3 WO3/TiOF2-TiO2复合光催化剂称取1g TiOF2粉末加入到不同Na2WO4含量的前体溶液中(Na2WO4的质量分别为0.325、0.975、1.624、2.287g),低速搅拌30min。重复1.2.2节中的加酸、调pH值、离心及干燥步骤,得到白色粉末,即为WO3/TiOF2-TiO2复合光催化剂。根据复合光催化剂中W与Ti元素的物质的量比的不同,将催化剂标记为W :Ti=X :10(X=0.5、1、3、5),其中X :10为W与Ti元素的物质的量之比。
用OH-TiOF2替换TiOF2,重复上述步骤,得到NaOH处理TiOF2后的WO3/TiOF2-TiO2复合光催化剂。根据复合光催化剂中W与Ti元素的物质的量比的不同,将催化剂标记为W :OH- Ti= X :10(X=0.5、1、3、5),其中X :10为W与Ti元素的物质的量之比。
1.3 催化剂的表征采用北京普析通用仪器有限责任公司的X D- 3型X射线衍射仪(XRD)分析催化剂的晶体特性,测试条件:Cu靶,波长为0.15416nm,扫描范围10°~90°,扫描速度6(°)/min,管电流和电压分别为20.0mA和36.0kV;采用日本电子株式会社的JS M- 7610F型扫描电子显微镜(SEM)观察催化剂的表面形貌,操作电压为5~20kV;采用美国麦克默瑞提克仪器有限公司的ASAP2020型氮气物理吸附分析仪(BET)测定催化剂的比表面积、平均孔体积和孔径,测试前对样品进行预处理:在300℃真空脱气3h;采用德国Bruker公司的TensorⅡ型傅里叶变换红外光谱仪(F T- IR)分析催化剂的表面基团、尤其是表面羟基的特性,测试范围4000~400cm-1;采用北京普析通用仪器有限责任公司的T U- 1810SPC型紫外可见分光光度计测试催化剂的紫外可见漫反射光谱(U V- vis DRS),分析其表面的光吸收特性,测试条件:以BaSO4作为参比,扫描范围200~800nm,扫描速率0.6nm/s;采用日本岛津公司的R F- 6000型荧光分光光度计(PL)测定催化剂的表面电子-空穴复合情况,测试条件:电压250V,波长5nm,扫描速度1500nm/min;采用美国Thermo Scientific公司的EscaLab 250Xi型X射线光电子能谱仪(XPS)分析催化剂的表面元素组成,测试条件:X射线源为Mg Kα射线,辐射源为Al Kα射线,使用表面吸附碳的结合能C 1s(284.6eV)为内标对结合能进行校准。
1.4 催化剂的活性评价使用500W氙灯模拟太阳光,使液面距离光源30cm,向200mL有夹层的石英烧杯内放入TTCH的质量浓度为10mg/L的100mL反应溶液,保证搅拌速度恒定,向夹层内通入恒温冷却水以保证反应体系的温度恒定。分别称取一定量的催化剂粉体加入反应溶液中,在避光条件下磁力搅拌30min,使污染物在催化剂表面达到吸附平衡。打开氙灯,每隔30min抽取4mL悬浮液,以10000r/min离心15~20min,取上清液用Shimadz u- U V- 2600型紫外可见分光光度计(日本岛津株式会社)在357nm下测定吸光度,由式(1)计算TTCH的降解率η。
| $ \eta = \frac{{{A_0} - {A_t}}}{{{A_0}}} \times 100\% $ | (1) |
式中,A0为上清液的初始吸光度,At为反应t时间的上清液的吸光度。
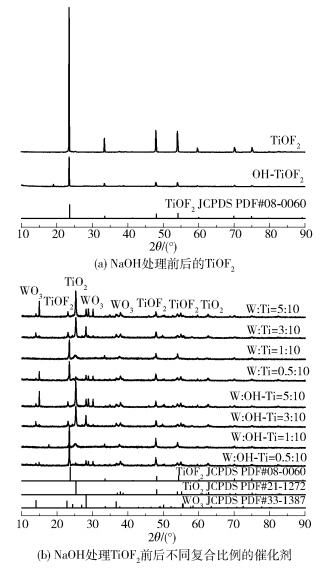
2 结果与讨论 2.1 催化剂的表征结果 2.1.1 晶型结构不同催化剂的XRD图谱如图 1所示。从图 1(a)中可以看出,TiOF2和OH-TiOF2样品在2θ=23.64°、33.54°、48.10°、54.23°、70.00°和74.95°处对应的特征峰均与TiOF2的标准卡片(JCPDS PDF#0 8- 0060)相符合,没有出现其他杂峰,说明制备的样品均为TiOF2。从图 1(b)中可以看出,制备的W :Ti=X :10系列复合光催化剂在2θ=23.64°、33.54°、48.10°、54.23°、70.00°和74.95°处对应的特征峰均与TiOF2的标准卡片(JCPDS PDF#0 8- 0060)相符合,说明制备的样品中含有TiOF2;在2θ=14.09°、37.20°处对应的特征峰均与WO3的标准卡片(JCPDS PDF#3 3- 1387)相符合,说明制备的样品中含有WO3;同时,在2θ=25.28°、62.69°处也出现了比较明显的特征峰,与TiO2的标准卡片(JCPDS PDF#2 1- 1272)相符合,说明制备的样品中也含有TiO2。由此说明所制备的样品为含有3种晶体的WO3/TiOF2-TiO2三元复合物质。
TiOF2经过NaOH处理后制备的W :OH- Ti =X :10系列复合光催化剂在与未经NaOH处理的复合光催化剂相同的位置出现了特征峰,说明NaOH处理后的复合光催化剂也为含有3种晶体的WO3/TiOF2-TiO2三元复合物质。但在W :OH- Ti=1 :10时TiOF2对应的峰都高于W :Ti=X :10系列的复合光催化剂,说明此时TiOF2经NaOH处理后晶型发生了变化。因此,NaOH处理过程会影响催化剂的晶型,从而影响复合光催化剂的性能。
|
图 1 不同催化剂的XRD图谱 Fig.1 XRD patterns of different catalysts |
图 2为不同催化剂的SEM图。从图 2(a)和2(b)中可以清晰地看出TiOF2样品呈立方体结构;从图 2(c)和2(d)中可以看出TiOF2经NaOH处理后表面变得粗糙,更易负载WO3晶体;从图 2(e)和2(f)中可以看到WO3样品呈片状结构;从图 2(g)~2(j)中可以看出较大的正方体为TiOF2晶体,周围的小片状物为负载在上面的WO3。经NaOH处理TiOF2后,复合催化剂样品的晶型由原来的较规则变得不规则,表面也变得较粗糙,且表面出现了很多缝隙,提高了样品的比表面积,使催化剂更易于吸附污染物,从而提升光催化效果。

|
图 2 不同催化剂的SEM图 Fig.2 SEM images of different catalysts |
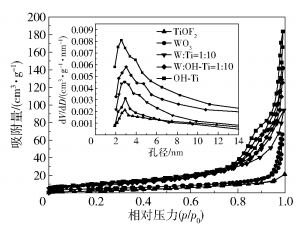
不同催化剂的氮气吸附-脱附曲线及相应的Barrett-Joyner-Halenda(BJH)孔径分布如图 3所示。可以看出,WO3/TiOF2-TiO2复合光催化剂具有类似的Ⅳ型H3滞后环吸附/脱附等温线,表明其具有介孔结构[23-24]。根据图 3中的孔径分布图,可以看出复合光催化剂的孔径主要分布在2~6nm,表明催化剂的粒径分布较窄。根据TTCH分子的尺寸(1.41nm×0.46nm×0.82nm),可以认为WO3/TiOF2-TiO2复合光催化剂具有良好的吸附性能。
|
图 3 不同催化剂的氮气吸附-脱附等温线和孔径分布图 Fig.3 Nitrogen adsorption-desorption isotherms and pore size distributions of different catalysts |
用BJH法计算得到的催化剂的比表面积、平均孔体积和平均孔径见表 1。TiOF2和WO3的比表面积和平均孔体积较小,OH-TiOF2的比表面积和平均孔体积急剧增加,结合SEM测试结果,推测其原因是NaOH处理使TiOF2表面变得粗糙。在复合催化剂中,WO3负载在TiOF2表面,松散的颗粒间形成了更多的空隙,与单一TiOF2相比,增加了催化剂的比表面积。同样可以看出W :OH- Ti=1 :10复合光催化剂的比表面积和平均孔体积比W :Ti=1 :10大得多,可为污染物在催化剂表面的降解提供更多的活性位点。
| 下载CSV 表 1 不同催化剂的比表面积和孔结构参数 Table 1 Specific surface areas and pore structure parameters of different catalysts |
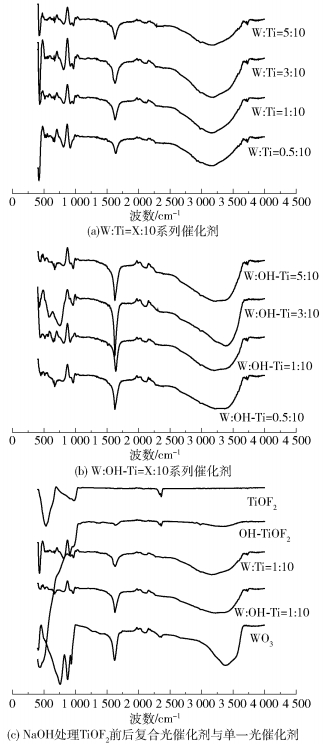
不同催化剂的F T- IR谱图如图 4所示。复合催化剂在1637cm-1处的吸收峰对应催化剂表面水分子的吸附,即为吸附水;在3000~3600cm-1处宽吸收带的吸收峰对应催化剂羟基基团的伸缩和弯曲振动,即羟基水。在800~1000cm-1的吸收峰对应Ti—F键的伸缩振动,说明在复合催化剂的制备过程中F-与Ti4+发生了化学键合。在400~700cm-1的吸收峰对应Ti—O键的伸缩振动,说明在复合催化剂的制备过程中O2-与Ti4+发生了化学键合,结合XRD结果,表明部分F-在TiOF2与WO3的复合过程中脱离TiOF2晶格,生成TiO2,复合催化剂为TiOF2、TiO2及WO3的混晶。从图 4(c)中还可以观察到W :OH- Ti=1 :10在3000~3600cm-1处的峰宽度比W : Ti=1 :10的峰宽,表明NaOH处理TiOF2后复合催化剂中出现了更多的绨合羟基,使催化剂的催化性能变强。
|
图 4 不同催化剂的F T- IR谱图 Fig.4 F T- IR spectra of different catalysts |
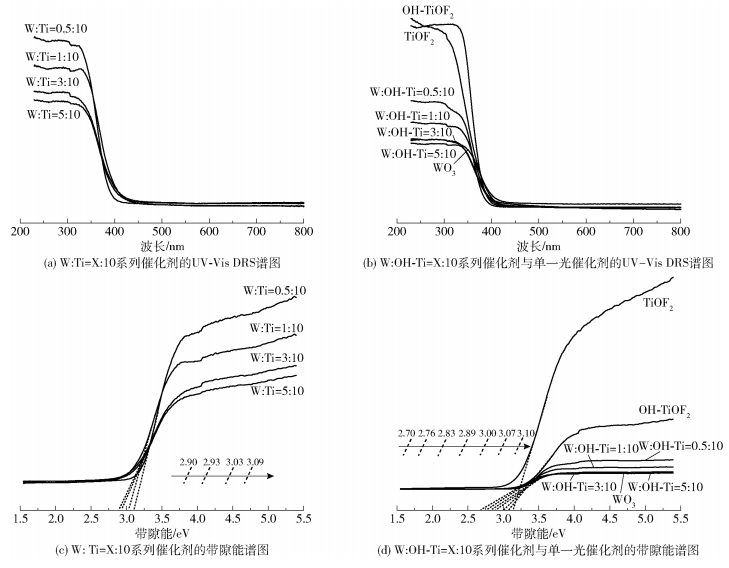
不同催化剂的U V- vis DRS谱图如图 5(a)和5(b)所示。从图中可以看出,不同比例的W与Ti元素在一定程度上影响了催化剂的光吸收特性。使用Tauc-plot法得到不同样品的带隙能(Eg),结果如图 5(c)和5(d)所示。W :Ti=X :10(X=0.5、1、3、5)的带隙能分别为3.09、3.03、2.93、2.90eV,W :OH- Ti=X :10(X=0.5、1、3、5)的带隙能分别为3.00、2.76、2.83、2.89eV,单一的TiOF2、OH-TiOF2、WO3的带隙能分别为3.10、3.07、2.70eV。WO3的加入可以在OH-TiOF2的基础上使W :OH- Ti=X :10系列复合催化剂的带隙能降低,禁带宽度变窄。且NaOH处理TiOF2后的复合光催化剂的带隙能较处理前均有不同程度的降低,禁带宽度变窄。特别地,与其他复合光催化剂相比,W :OH- Ti=1 :10复合光催化剂的带隙能最低,禁带宽度最窄,光催化活性最好。结合图 5(a)和5(b),根据带隙能Eg(eV)与吸收波长阈值λg(nm)的关系式(2)
|
图 5 不同催化剂的U V- Vis DRS及带隙能谱图 Fig.5 U V- Vis DRS and band gap energy spectra of different catalysts |
| $ {E_{\rm{g}}} = \frac{{1240}}{{{\lambda _{\rm{g}}}}} $ | (2) |
得出W :OH- Ti=1 :10响应的λg为449nm,TiOF2响应的λg为400nm,说明W :OH- Ti=1 :10复合光催化剂对可见光的响应性能较TiOF2有所提高。根据式(2)计算可得,W :OH- Ti=X :10系列复合光催化剂对可见光的响应性能较W :Ti=X :10系列复合光催化剂均有所改善,进而对太阳光的利用有所提高。结合SEM分析,在NaOH处理TiOF2后的复合光催化剂的粗糙结构中,光的多次反射和散射有利于加强催化剂与光子的相互作用,增强催化剂的光吸收,进而提升样品的光催化活性。
2.1.6 电子-空穴复合程度图 6为NaOH处理TiOF2前后复合光催化剂与单一光催化剂的荧光光谱图。由图中可以看出,与TiOF2相比,W :OH- Ti=1 :10的荧光强度大大降低,表明该催化剂有更低的载流子复合率及更低的电子-空穴复合率。从图中还可以看出,WO3的加入可以在TiOF2的基础上降低催化剂的电子-空穴复合率。以409.53nm为中心的宽发射带是由靠近缺陷周围的钛酸根基团捕获自由激子而形成的一个激子发射范围。以463.39nm为中心的波长范围的形成原因是有两个俘获电子的氧空位,氧空位促进超氧自由基(·O2-)和羟基自由基(·OH)的形成,有利于提升催化剂性能。
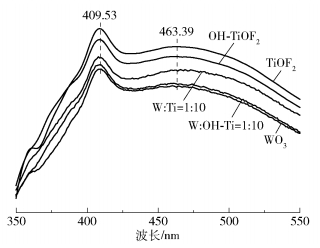
|
图 6 NaOH处理TiOF2前后复合光催化剂与单一光催化剂的荧光光谱图 Fig.6 Photoluminescence spectra of composite photocatalysts and single photocatalysts before and after treatment of TiOF2 with NaOH |
图 7为W :OH- Ti=1 :10复合光催化剂的XPS谱图。从图中可以看出,WO3/TiOF2-TiO2复合催化剂的表面上有W、Ti、O、F和C的元素信号,在284.8eV处存在的C元素峰可归因于表面不定参考碳,这在XPS测量过程中是不可避免的。
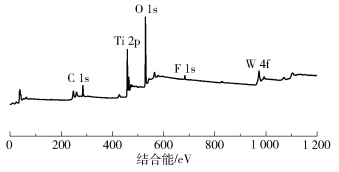
|
图 7 W :OH- Ti=1 :10复合光催化剂的XPS谱图 Fig.7 XPS spectrum of the W :OH- Ti=1 :10 composite photocatalyst |
不同光催化剂的催化活性通过盐酸四环素的光催化降解率来评价,结果如图 8所示。从图 8(a)中可以看出,在未经NaOH处理的复合催化剂中W :Ti=1 :10的光催化效果最好,光照2.5h后其降解率为74.2%。经NaOH处理后,复合光催化剂的光催化效果有所增强,尤其是W与Ti元素物质的量比为1 :10时效果提升较大,其中W :OH- Ti=1 :10的光催化效果最佳,在光照2.5h后其降解率可达85%。在暗反应的0.5h内,不同的复合光催化剂对盐酸四环素的吸附能力不同,经NaOH处理TiOF2后复合光催化剂的吸附能力均高于相应复合比例的未处理的光催化剂,结合SEM结果,分析其原因可能是由于TiOF2经过NaOH处理后表面变得更为粗糙,再与WO3复合,增大了催化剂的比表面积,从而增加了其吸附能力。但过多的WO3负载会使其表面的孔隙被填充,降低了比表面积,导致其吸附能力与光催化能力下降。
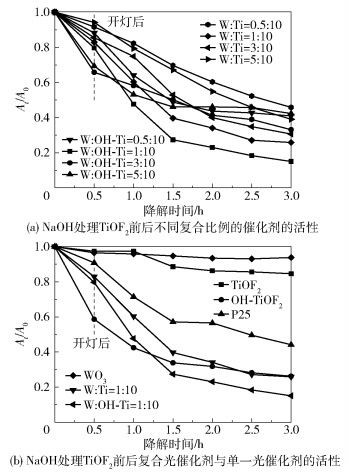
|
图 8 太阳光下不同催化剂对TTCH的降解活性比较 Fig.8 Comparison of the activity of different catalysts for the degradation of TTCH in sunlight |
从图 8(b)中可以看出,光照2.5h后,单一和复合光催化剂的降解效果从大到小依次为:W :OH- Ti= 1 :10、W :Ti=1 :10、OH-TiOF2、P25、TiOF2、WO3,说明复合光催化剂的降解效果大于单一光催化剂的降解效果,光催化剂经NaOH处理后的效果大于未处理的光催化剂。张黎明等[25]探究了Cu-g-C3N4/WO3在可见光下对四环素的降解,当TTCH的初始质量浓度为20mg/L、投加量为0.3g/L时,降解率仅为21%。Shi等[26]研究了坡缕石负载的Cu2 O- TiO2异质结复合材料(Cu2 O- TiO 2- Pal)对盐酸四环素的吸附和光催化降解,当TTCH的初始质量浓度为30mg/L、投加量为1g/L时,5h内去除率为88.81%。Wang等[27]使用Pt纳米粒子改性WO3@TiO2降解四环素废水,与改性前相比,对四环素的降解率提高到86.7%。陈宇溪等[28]制备了Ag掺杂型TiO2粉末光催化剂用于降解四环素类抗生素废水,相比于纯TiO2,Ag+的掺杂使TiO2对盐酸四环素的降解率提高到90.82%。贵金属掺杂虽然提升了降解率,却增加了成本。相比较而言,本文提出的WO3/TiOF2-TiO2不仅具有良好的可见光降解性能, 而且成本低廉、制备简单,是未来可见光催化降解抗生素废水具有前景的催化剂之一。
2.2.2 投加量对W :OH- Ti=1 :10催化效果的影响由2.2.1节可知,催化剂W :OH- Ti=1 :10的降解效果最好,为考察不同投加量对该催化剂催化效果的影响,分别设置投加量为1.0、0.5、0.3、0.1g/L进行降解试验,结果如图 9所示。在投加量为1.0、0.5、0.3g/L时,持续降解3h,三者的降解率均在85%左右。而在投加量为1.0g/L和0.5g/L的反应中,暗反应阶段的吸附量远大于投加量为0.3g/L的反应,即在相同的降解率下,投加量为0.3g/L的反应以光催化反应为主,此时复合催化剂的光催化效率较高,且节约成本。当投加量低于0.3g/L时,降解效果有所降低。
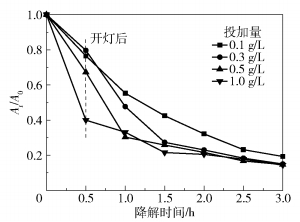
|
图 9 投加量对W :OH- Ti=1 :10催化效果的影响 Fig.9 Influence of dosage on the catalytic effect of W :OH- Ti=1 :10 |
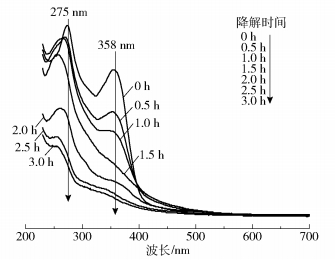
采用紫外可见分光光度法分析了TTCH在降解过程中的结构变化,结果如图 10所示。从图中可以看出,TTCH在275nm和358nm处有两个主要吸收峰,其中,在275nm处的吸收峰可能是由于在还原过程中产生了羟基和酰基氨基[29-30],在358nm处的吸收峰是由芳香环B- D引起的,该吸收带随辐照时间的延长而逐渐减小,这可能是由附着于芳香环上的酚环断裂所致[31-32]。随着光照时间的延长,两处吸收峰均快速下降,说明TTCH上的环结构及降解过程中产生的羟基、酰基氨基均被破坏[33]。根据其他研究结果,TTCH降解过程为:在·OH等活性物质的作用下,首先从TTCH分子中分离出氨基、羟基和甲基等官能团;进一步氧化后,碳链断裂,形成不稳定的开环产物;在自由基作用下,羰基与开环分离;中间体进一步氧化生成短链羧酸;最终TTCH分子的稳定环结构被破坏,从而被催化剂降解[34]。
|
图 10 W :OH- Ti=1 :10复合光催化剂去除TTCH的U V- vis谱图 Fig.10 U V- vis spectra of the W :OH- Ti=1 :10 composite photocatalyst during TTCH removal |
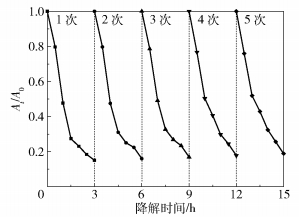
在同等试验条件下,投加0.3g/L W :OH- Ti=1 :10催化剂于TTCH溶液中进行降解试验。将催化剂回收,用无水乙醇、超纯水洗涤3次,烘干研磨,重复5次,降解试验结果如图 11所示。催化剂在第5次重复试验结束时降解率仍能达到81.2%,说明催化剂的循环稳定性较好,降解率降低的原因可能是在洗涤过程中光催化剂的损失。
|
图 11 W :OH- Ti=1 :10的重复性 Fig.11 Reuse of the W :OH- Ti=1 :10 catalyst |
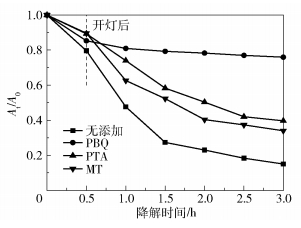
为了确定盐酸四环素在降解过程中的活性物质,用对苯醌作为超氧自由基(·O2-)的清除剂[35],用1, 4-对苯二甲酸作为羟基自由基(·OH)的清除剂[36],用甲醇作为空穴(h+)的清除剂[37]。投加0.3g/L W :OH- Ti=1 :10催化剂于TTCH溶液中进行自由基捕获试验,试验条件与光催化试验条件相同,结果如图 12所示。在暗反应阶段,清除剂对体系的吸附有轻微的影响,原因可能是催化剂对不同清除剂也存在少量的吸附,清除剂和TTCH形成了竞争关系,不同清除剂和催化剂表面的结合能力可能也不同。向系统中分别加入PBQ、PTA和MT,光照2.5h后,与未添加清除剂相比,其降解率分别降低了61%、24.7%和20%,说明·O2-、·OH和h+在不同程度上决定了催化剂对TTCH的降解活性,其中·O2-起主要作用。
|
图 12 W :OH- Ti=1 :10捕获试验 Fig.12 Capture test of the W :OH- Ti=1 :10 catalyst |
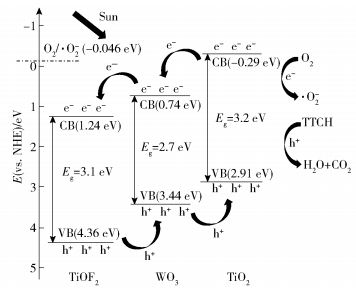
基于以上试验,相比于单一TiOF2和WO3催化剂,WO3与TiOF2按一定比例复合后对TTCH的降解效果有较大提升,其中W :OH- Ti=1 :10对TTCH的降解效果最好。基于上述降解效果及表征结果,本文提出了一种在模拟太阳光下TTCH降解的可能机理,如图 13所示。带隙的位置对光激发电子和空穴的流动方向有着重要影响,这对活性物种的产生和光催化的性能有着至关重要的作用。由以下经验公式(3)和(4)计算出TiO2、WO3和TiOF2的导带(CB)和价带(VB)的位置。
|
NHE为标准氢电极(参比电极电势)。 图 13 光催化反应机理图 Fig.13 Diagram of the photocatalytic reaction mechanism |
| $ {E_{\rm{e}}} = \chi - {E_0} - 0.5{E_{\rm{g}}} $ | (3) |
| $ {E_{\rm{v}}} = {E_{\rm{e}}} + {E_{\rm{g}}} $ | (4) |
式中,Ec为导带的能量;Ev为价带的能量;χ表示半导体的绝对电负性,TiO2、WO3、TiOF2的χ分别为5.8、8.55、7.3[38-39];E0表示氢标度上自由电子的能量,为4.5eV;Eg为半导体的带隙能量,TiOF2、WO3、TiO2的Eg分别为3.1、2.7、3.2eV。通过计算,确定TiO2、WO3、TiOF2的CB/VB位置分别为-0.29/2.91、0.74/3.44、1.24/4.36eV。
在模拟太阳光照射下,电子跃迁到TiO2、WO3和TiOF2的导带上,形成电子-空穴对。因此,TiO2的导带上一部分电子可以迁移到WO3的导带上,另一部分与溶解的O2反应,生成具有强氧化性的·O2-, 而产生的空穴氧化溶液中电离出来的OH-生成·OH[40]。类似地,WO3的导带上的电子迁移到TiOF2的导带上。另一方面,空穴逐步积累到TiO2的价带上,TiO2的价带电位有利于空穴的转移,从而明显降低了电子和空穴的复合速率。这些空穴可以直接与吸附在催化剂表面的TTCH发生反应[41-42],因此,复合催化剂的电子-空穴复合率降低,这与荧光测试和F T- IR测试的结果相吻合。进而,电子-空穴复合率的降低,使得复合催化剂的催化性能提升,图 8的催化活性研究结果也证实了这一点。
3 结论本文以一种TiOF2的新型制备方法制备了形貌为立方体的TiOF2晶体,通过与WO3复合,制备了一种WO3/TiOF2-TiO2三元复合光催化剂。通过用NaOH溶液对TiOF2改性,制备了改进的WO3/TiOF2-TiO2复合光催化剂。同时对所制备的光催化剂的晶型特性、表面形貌以及光吸收特性等进行了表征,对其光催化性能进行了测定。结果表明,模拟太阳光照射2.5h后,投加量为0.3g/L的W :OH- Ti=1 :10催化剂对TTCH的降解率可达85%。结合表征结果,分析其原因是WO3的加入改变了TiOF2本身的结构,使部分TiOF2在高温下转变为TiO2。在复合的过程中,W :OH- Ti=1 :10复合光催化剂与TiOF2相比,其禁带宽度降低,对可见光响应增强,电子-空穴的复合受到了抑制, 并且TiOF2经NaOH处理后,复合光催化剂增加了更多的羟基,从而提高了光催化性能。
| [1] |
SAFARI G H, HOSEINI M, SEYEDSALEHI M, et al. Photocatalytic degradation of tetracycline using nanosized titanium dioxide in aqueous solution[J]. International Journal of Environmental Science and Technology, 2015, 12(2): 603-616. DOI:10.1007/s13762-014-0706-9 |
| [2] |
DAGHRIR R, DROGUI P. Tetracycline antibiotics in the environment: a review[J]. Environmental Chemistry Letters, 2013, 11(3): 209-227. DOI:10.1007/s10311-013-0404-8 |
| [3] |
刘阳, 高生旺, 王丽君, 等. 多孔MoS2/g-C3N4材料对水环境中四环素的降解[J]. 环境工程学报, 2019, 13(4): 818-825. LIU Y, GAO S W, WANG L J, et al. Tetracycline degradation in aqueous solution by porous MoS2/g-C3N4[J]. Chinese Journal of Environmental Engineering, 2019, 13(4): 818-825. (in Chinese) |
| [4] |
邓玉, 倪福全. 水环境中抗生素残留及其危害[J]. 南水北调与水利科技, 2011, 9(3): 96-100. DENG Y, NI F Q. Research on antibiotics residues and hazardous in aquatic environment: a review[J]. South-to-North Water Transfers and Water Science & Technology, 2011, 9(3): 96-100. (in Chinese) |
| [5] |
LI S Z, LI X Y, WANG D Z. Membrane (RO-UF) filtration for antibiotic waste-water treatment and recovery of antibiotics[J]. Separation and Purification Technology, 2004, 34(1-3): 109-114. DOI:10.1016/S1383-5866(03)00184-9 |
| [6] |
CHOI K J, KIM S G, KIM S H. Removal of antibiotics by coagulation and granular activated carbon filtration[J]. Journal of Hazardous Materials, 2008, 151(1): 38-43. DOI:10.1016/j.jhazmat.2007.05.059 |
| [7] |
斯皮思.工业废水的厌氧生物技术[M].李亚新, 译.北京: 中国建筑工业出版社, 2001. SPEECE R E. Anaerobic biotechnology for industrial wastewaters[M]. LI Y X, trans. Beijing: China Architecture & Building Press, 2001. (in Chinese) |
| [8] |
COSKUN T, KABUK H A, VARINCA K B, et al. Antibiotic fermentation broth treatment by a pilot upflow anaerobic sludge bed reactor and kinetic modeling[J]. Bioresource Technology, 2012, 121: 31-35. DOI:10.1016/j.biortech.2012.06.102 |
| [9] |
胡晓东, 张刚, 石云峰, 等. 好氧法处理抗生素废水对比试验研究[J]. 广州大学学报(自然科学版), 2010, 9(1): 33-36. HU X D, ZHANG G, SHI Y F, et al. Contrast experiment research on aerobic treatment of antibiotic wastewater[J]. Journal of Guangzhou University (Natural Science), 2010, 9(1): 33-36. (in Chinese) DOI:10.3969/j.issn.1671-4229.2010.01.009 |
| [10] |
DAGHRIR R, DROGUI P, DIMBOUKOU-MPIRA A, et al. Photoelectrocatalytic degradation of carbamazepine using Ti/TiO2 nanostructured electrodes deposited by means of a pulsed laser deposition process[J]. Chemosphere, 2013, 93: 2756-2766. DOI:10.1016/j.chemosphere.2013.09.031 |
| [11] |
FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37-38. DOI:10.1038/238037a0 |
| [12] |
WENDERICH K, MUL G. Methods, mechanism, and applications of photodeposition in photocatalysis: a review[J]. Chemical Reviews, 2016, 116(23): 14587-14619. DOI:10.1021/acs.chemrev.6b00327 |
| [13] |
REDDY P A K, REDDY P V L, KWON E, et al. Recent advances in photocatalytic treatment of pollutants in aqueous media[J]. Environment International, 2016, 91: 94-103. DOI:10.1016/j.envint.2016.02.012 |
| [14] |
CHRISTOFORIDIS K C, FORNASIERO P. Photocatalytic hydrogen production: a rift into the future energy supply[J]. ChemCatChem, 2017, 9(9): 1523-1544. DOI:10.1002/cctc.201601659 |
| [15] |
BERANEK R. (Photo) electrochemical methods for the determination of the band edge positions of TiO2-based nanomaterials[J]. Advances in Physical Chemistry, 2011, 2011: 786759. |
| [16] |
PARK H, PARK Y, KIM W, et al. Surface modification of TiO2 photocatalyst for environmental applications[J]. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2013, 15: 1-20. DOI:10.1016/j.jphotochemrev.2012.10.001 |
| [17] |
GE M Z, CAI J S, IOCOZZIA J, et al. A review of TiO2 nano-structured catalysts for sustainable H2 generation[J]. International Journal of Hydrogen Energy, 2017, 42(12): 8418-8449. DOI:10.1016/j.ijhydene.2016.12.052 |
| [18] |
侯晨涛, 宋乔乔. WO3/TiOF2复合催化剂的制备及其光催化性能研究[J]. 北京化工大学学报(自然科学版), 2019, 46(1): 56-62. HOU C T, SONG Q Q. Preparation and photocatalytic activity of TiOF2 and WO3/TiOF2 photocatalyst[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2019, 46(1): 56-62. (in Chinese) |
| [19] |
林萍, 侯晨涛, 柳文莉. TiOF2光催化降解甲基橙的影响因素研究[J]. 北京化工大学学报(自然科学版), 2018, 45(4): 47-53. LIN P, HOU C T, LIU W L. Factors affecting the photocatalytic degradation of methyl orange by TiOF2[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2018, 45(4): 47-53. (in Chinese) |
| [20] |
MI Q X, ZHANAIDAROVA A, BRUNSCHWIG B S, et al. A quantitative assessment of the competition between water and anion oxidation at WO3 photoanodes in acidic aqueous electrolytes[J]. Energy & Environmental Science, 2012, 5(2): 5694-5700. |
| [21] |
FENG J Y, ZHAO X, MA S S K, et al. Fast and simple construction of efficient solar-water-splitting electrodes with micrometer-sized light-absorbing precursor particles[J]. Advanced Materials Technologies, 2016, 1(8): 1600119. DOI:10.1002/admt.201600119 |
| [22] |
CAO D P, WANG J, ZHANG J B, et al. Mechanism investigation of the postnecking treatment to WO3 photoelectrodes[J]. ACS Applied Energy Materials, 2018, 1(9): 4670-4677. DOI:10.1021/acsaem.8b00805 |
| [23] |
CHANG W, YAN L L, LIU B, et al. Photocatalyic activity of double pore structure TiO2/SiO2 monoliths[J]. Ceramics International, 2017, 43(8): 5881-5886. DOI:10.1016/j.ceramint.2017.01.061 |
| [24] |
NGUYEN D C T, CHO K Y, OH W C. Synthesis of mesoporous SiO2/Cu2O graphene nanocomposites and their highly efficient photocatalytic performance for dye pollutants[J]. RSC Advances, 2017, 7: 29284-29294. DOI:10.1039/C7RA03526H |
| [25] |
张黎明, 吴磊, 邵云, 等. Cu-g-C3N4/WO3可见光下降解四环素的性能研究[J]. 人工晶体学报, 2018, 47(6): 1128-1135. ZHANG L M, WU L, SHAO Y, et al. Study on degradation of tetracycline hydrochloride using Cu-g-C3N4/WO3 photocatalyst under visible light[J]. Journal of Synthetic Crystals, 2018, 47(6): 1128-1135. (in Chinese) DOI:10.3969/j.issn.1000-985X.2018.06.007 |
| [26] |
SHI Y Y, YANG Z W, WANG B, et al. Adsorption and photocatalytic degradation of tetracycline hydrochloride using a palygorskite-supported Cu2O-TiO2 composite[J]. Applied Clay Science, 2016, 119: 311-320. DOI:10.1016/j.clay.2015.10.033 |
| [27] |
WANG Y, FU H T, YANG X H, et al. Pt nanoparticles-modified WO3@TiO2 core-shell ternary nanocomposites as stable and efficient photocatalysts in tetracycline degradation[J]. Journal of Materials Science, 2020, 55: 14415-14430. DOI:10.1007/s10853-020-05014-6 |
| [28] |
陈宇溪, 罗力莎, 时峥, 等. Ag掺杂型TiO2粉末光催化降解四环素类抗生素废水[J]. 科技创新与应用, 2018(13): 30-32. CHEN Y X, LUO L S, SHI Z, et al. Photocatalytic degradation of tetracycline antibiotic wastewater by Ag-doped TiO2 powder[J]. Technology Innovation and Application, 2018(13): 30-32. (in Chinese) |
| [29] |
JIN Y, JIANG D L, LI D, et al. Construction of ultrafine TiO2 nanoparticle and SnNb2O6 nanosheet 0D/2D heterojunctions with abundant interfaces and significantly improved photocatalytic activity[J]. Catalysis Science & Technology, 2017, 7: 2308-2317. |
| [30] |
KHODADADI M, EHRAMPOUSH M H, GHANEIAN M T, et al. Synthesis and characterizations of FeNi3@SiO2@TiO2 nanocomposite and its application in photo-catalytic degradation of tetracycline in simulated wastewater[J]. Journal of Molecular Liquids, 2018, 255: 224-232. DOI:10.1016/j.molliq.2017.11.137 |
| [31] |
ZHU X D, WANG Y J, SUN R J, et al. Photocatalytic degradation of tetracycline in aqueous solution by nanosized TiO2[J]. Chemosphere, 2013, 92: 925-932. DOI:10.1016/j.chemosphere.2013.02.066 |
| [32] |
WANG Y, ZHANG H, ZHANG J H, et al. Degradation of tetracycline in aqueous media by ozonation in an internal loop-lift reactor[J]. Journal of Hazardous Materials, 2011, 192(1): 35-43. |
| [33] |
SAFARI G H, HOSEINI M, SEYEDSALEHI M, et al. Photocatalytic degradation of tetracycline using nanosized titanium dioxide in aqueous solution[J]. International Journal of Environmental Science and Technology, 2015, 12(2): 603-616. DOI:10.1007/s13762-014-0706-9 |
| [34] |
WANG Q, LI P J, ZHANG Z, et al. Kinetics and mechanism insights into the photodegradation of tetracycline hydrochloride and ofloxacin mixed antibiotics with the flower-like BiOCl/TiO2 heterojunction[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2019, 378: 114-124. DOI:10.1016/j.jphotochem.2019.04.028 |
| [35] |
WANG D B, JIA F Y, WANG H, et al. Simultaneously efficient adsorption and photocatalytic degradation of tetracycline by Fe-based MOFs[J]. Journal of Colloid and Interface Science, 2018, 519: 273-284. DOI:10.1016/j.jcis.2018.02.067 |
| [36] |
WANG C Y, ZHANG X, QIU H B, et al. Bi24O31Br10 nanosheets with controllable thickness for visible-light-driven catalytic degradation of tetracycline hydrochloride[J]. Applied Catalysis B: Environmental, 2017, 205: 615-623. DOI:10.1016/j.apcatb.2017.01.015 |
| [37] |
KOČÍ K, RELI M, EDELMANNOVÁ M, et al. Photocatalytic hydrogen production from methanol over Nd/TiO2[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2018, 366: 55-64. DOI:10.1016/j.jphotochem.2018.03.007 |
| [38] |
钟娜, 汤莎莎, 余岩, 等. 核壳异质结催化剂BiOCl/F-TiO2可见光催化降解4-氯酚[J]. 环境污染与防治, 2019, 41(8): 876-881. ZHONG N, TANG S S, YU Y, et al. Photocatalytic degradation of p-chlorophenol by core-shell heterojunction catalyst BiOCl/F-TiO2 under visible light[J]. Environmental Pollution & Control, 2019, 41(8): 876-881. (in Chinese) |
| [39] |
JIANG Y H, JING X, ZHU K, et al. Ta3N5 nanoparticles/TiO2 hollow sphere (0D/3D) heterojunction: facile synthesis and enhanced photocatalytic activities of levofloxacin degradation and H2 evolution[J]. Dalton Transactions, 2018, 47(37): 13113-13125. DOI:10.1039/C8DT02343C |
| [40] |
邵淑文, 王楚璇, 张涛, 等. 共沉淀法制备Ag3PO4/MWCNTs复合光催化材料及其表征与降解染料废水[J]. 北京化工大学学报(自然科学版), 2017, 44(4): 69-75. SHAO S W, WANG C X, ZHANG T, et al. Preparation of Ag3PO4/MWCNT composites by a chemical coprecipitation process and their use in the degradation of dye wastewater[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2017, 44(4): 69-75. (in Chinese) |
| [41] |
HOU C T, XIE J Q, YANG H L, et al. Preparation of Cu2O@TiOF2/TiO2 and its photocatalytic degradation of tetracycline hydrochloride wastewater[J]. RSC Advances, 2019, 9: 37911-37918. DOI:10.1039/C9RA07999H |
| [42] |
XU F, XU C Y, CHEN H M, et al. The synthesis of Bi2S3/2D-Bi2WO6 composite materials with enhanced photo-catalytic activities[J]. Journal of Alloys and Compounds, 2019, 780: 634-642. DOI:10.1016/j.jallcom.2018.11.397 |







