吡啶作为化工、医药、农药等行业的原材料,其在生产和使用过程中会产生大量的废水[1]。未经处理的吡啶废水被排放到环境中,会对水环境和土壤造成持久性污染。同时,长时间接触吡啶会对人的肝脏、肾脏、免疫系统和生殖功能产生有害影响。由于吡啶的高毒性和低生物降解性等问题,普通的生物法无法将其有效去除。高级氧化法能将吡啶降解为水、二氧化碳等小分子化合物,可用于生物法的预处理过程。目前,用于降解废水中吡啶的高级氧化法有湿式氧化法[2-3]、电催化氧化法[4]、光催化氧化法[5-6]和催化臭氧氧化法[7-9]等。
臭氧(O3)具有极强的氧化能力(氧化还原电位E0=2.07 eV),已被广泛应用于生活污水的杀菌消毒、除臭和脱色。同时在有机废水的处理中,臭氧也已被证明是一种行之有效的强氧化剂,但单独臭氧氧化存在矿化率和臭氧利用率低以及具有选择性等问题[9-11]。多相催化臭氧氧化技术是利用固体催化剂催化O3分解产生·OH等含氧自由基来降解有机污染物的一种高级氧化技术。·OH(E0=2.80 eV)的氧化能力比臭氧强,无选择性,所以在降解有机污染物方面比单独臭氧具有更高的效率。
多相催化臭氧氧化常用的催化剂主要包括金属氧化物[12-13]、负载型金属氧化物[14-16]等固态材料。水滑石是一种层状双金属氢氧化物材料,由于层间离子的可交换性,因此其具有良好的吸附性能,被广泛用于废水吸附及催化领域。但将水滑石作为多相催化臭氧氧化降解有机污染物的催化剂却鲜有报道。
本文通过尿素水热共沉淀法制备了一种焙烧态锌镁铝类水滑石材料,将其运用到多相催化臭氧氧化降解吡啶废水的工艺中,表现出较好的去除效果,对含吡啶的工业难降解有机废水的处理具有指导意义。
1 实验部分 1.1 实验原料和仪器 1.1.1 实验原料六水合硝酸锌、六水合硝酸镁、九水合硝酸铝、尿素、氢氧化钠、碘化钾、无水乙醇、吡啶和叔丁醇,均为分析纯,北京化工厂;浓硫酸、硫酸银、硫酸汞和重铬酸钾,均为分析纯,北京连华科技发展有限公司;对苯醌,分析纯,天津福晨化学试剂厂。
1.1.2 实验仪器3S-A10型臭氧发生器(北京同林科技股份有限公司),5B-3型化学需氧量(COD)测定仪(北京连华科技发展有限公司),PHS-3E型pH计(上海仪电科学仪器有限公司),DR6000型紫外可见分光光度计(美国哈希公司),FA2004型电子天平(上海舜宇恒平科学仪器公司),SX-G02103型马弗炉(天津中环实验电炉有限公司),1100LC/MSD Trap型液相色谱-质谱联用仪(LC-MS)(美国Agilent公司),D8 Advanced型X射线衍射仪(XRD)(德国Bruker仪器公司),Vertex 703型傅里叶变换红外光谱仪(FT-IR)(德国Bruker仪器公司)。
1.2 催化剂的制备采用尿素水热共沉淀法制备锌镁铝类水滑石材料[17-18]。将2.97 g六水合硝酸锌、1.28 g六水合硝酸镁、1.88 g九水合硝酸铝和2.4 g尿素分别加入到80 mL去离子水中。磁力搅拌使固体完全溶解后,将混合液倒入100 mL内衬聚四氟乙烯的水热釜中,放入烘箱中于120 ℃下水热晶化48 h。水热反应结束后,将固液混合物分别用去离子水和无水乙醇离心洗涤3次,所得白色沉淀物在烘箱中于80 ℃下干燥12 h,得到锌镁铝类水滑石(LDHs)。将LDHs放入马弗炉中于500 ℃下焙烧2 h,可得焙烧态锌镁铝类水滑石(LDOs)。
1.3 催化剂的表征采用X射线衍射仪测试催化剂的XRD谱图。测试条件为:X射线源为CuKα辐射,λ=0.154 06 nm,测试电压和电流分别为40 kV和40 mA,扫描速度为5(°)/min,扫描范围为5°~75°。
采用红外光谱仪测试催化剂的红外光谱。将固体催化剂粉末与溴化钾按照一定比例混合压片后进行扫描,扫描范围为400~4 000 cm-1。
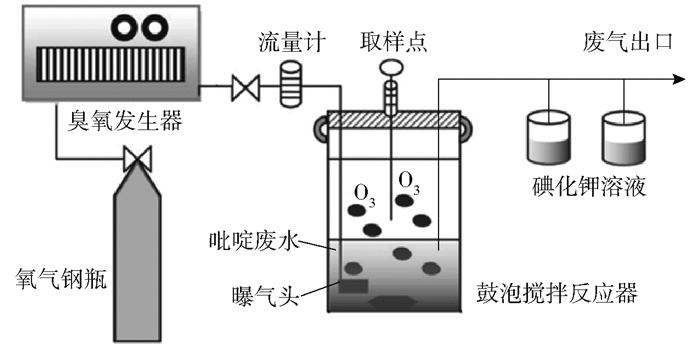
1.4 降解吡啶实验流程图 1为催化臭氧氧化降解吡啶的装置图。工艺条件为:模拟吡啶废水体积为1 L,初始吡啶的质量浓度为100~500 mg/L,废水初始pH为5~11,催化剂用量为0.2~1.0 g/L,反应时间为40 min,臭氧流量为55 mg/min,反应温度为25 ℃。氧气经臭氧发生器产生臭氧,然后通过位于鼓泡搅拌反应器底端的钛合金曝气头进入吡啶废水中,未反应的臭氧废气用碘化钾溶液吸收。反应过程中在规定时间取样测定。
|
图 1 催化臭氧氧化降解吡啶的装置图 Fig.1 Schematic view of the apparatus for pyridine degradation by catalytic ozonation |
采用紫外可见分光光度计在256 nm(吡啶的特征吸收波长)下测定吡啶浓度,按照式(1)计算吡啶降解率η。
| $ \eta = \frac{{{C_0} - {C_t}}}{{{C_0}}} \times 100\% $ | (1) |
式中,C0为初始吡啶的质量浓度,mg/L;Ct为t时刻的吡啶质量浓度,mg/L。
1.6 COD测定COD采用重铬酸钾分光光度法测定。分别向0号试管(空白对照)和1号试管加入2.5 mL的去离子水和待测水样。将0.7 mL重铬酸钾-硫酸汞溶液和4.8 mL硫酸-硫酸银溶液加入两试管中,摇晃均匀。然后放入COD测定仪中加热10 min,加热完成后取出,于空气中冷却2 min。然后再各加入2.5 mL去离子水,摇晃均匀,放入冷水中冷却2 min后倒入比色皿中,于610 nm波长下测定COD。
1.7 吡啶降解产物的测定吡啶的降解有机产物采用LC-MS进行分析。测试条件为:流动相为甲醇(10%,体积分数,下同)、乙腈(20%)和水(30%),柱温40 ℃,进样体积1.00 μL,流速0.8 mL/min,质荷比(m/z)范围为25~400,运行时间22.5 min。硝酸根离子采用GB/T 7480—1987[17]检测。
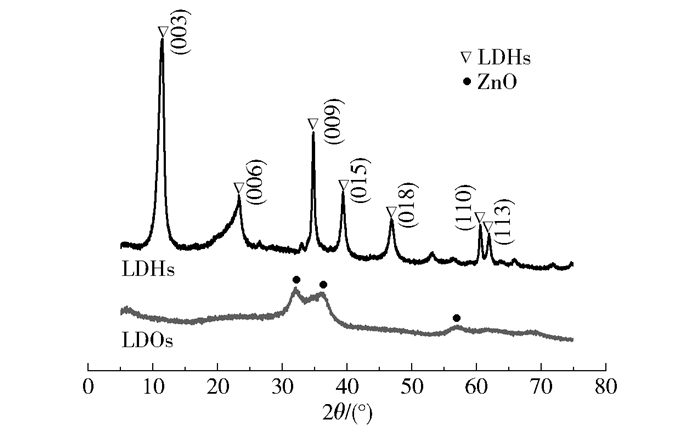
2 结果与讨论 2.1 催化剂的表征结果图 2为LDHs和LDOs的XRD谱图。从图 2中可以看出,在2θ为11.48°、23.34°、34.82°、39.38°、46.88°、60.64°和61.94°附近的(003)、(006)、(009)、(015)、(018)、(110)和(113)晶面对应于LDHs的特征衍射峰,峰型窄且尖锐,对称性良好,表明所制备的LDHs结晶度高、规整性好且晶相单一[18]。另外,低角度特征衍射峰较强,而高角度特征衍射峰相对较弱,这是水滑石层状结构的共同特征之一。(003)、(006)和(009)晶面的层间距d之间具有良好的倍数关系(d(003)=0.770 nm,d(006)=0.382 nm,d(009)=0.257 nm),表明LDHs具有较好的层状结构。LDHs经500 ℃焙烧后,所得产物LDOs的结构发生了显著变化。LDHs在(003)、(006)、(009)等晶面的特征衍射峰消失,出现了ZnO的特征衍射峰,表明LDHs在焙烧过程中其层状结构遭到了破坏,层间结晶水及阴离子脱除。
|
图 2 LDHs和LDOs的XRD谱图 Fig.2 XRD patterns of LDHs and LDOs |
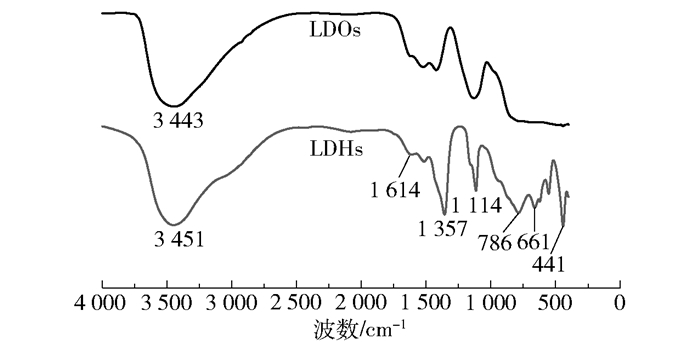
图 3为LDHs和LDOs的FT-IR谱图。从图 3中可以看出,LDHs在3 451、1 614、1 357、1 114、786、661 cm-1和441 cm-1等处出现了特征吸收峰。其中,3 451 cm-1附近的强吸收峰归属于羟基和层间结晶水的O—H键伸缩振动峰,1 614 cm-1附近的吸收峰对应于层间结晶水的弯曲振动。1 357 cm-1和661 cm-1附近的吸收峰分别归属于碳酸根的反对称伸缩振动峰(v3)和反对称弯曲振动峰(v4),表明层间碳酸根排列的有序性[19]。3 100 cm-1附近出现的肩峰表明层间碳酸根与层间结晶水之间存在强氢键作用。在400~600 cm-1内的吸收峰对应于M—OH和M—O的晶格振动(M=Zn、Mg和Al)[6]。与LDHs相比,LDOs层间结晶水的弯曲振动以及碳酸根的反对称伸缩振动峰(v3)和反对称弯曲振动峰(v4)减弱或消失,表明层间结晶水的脱除以及碳酸根离子的分解,这与XRD的分析结果相一致。
|
图 3 LDHs和LDOs的FT-IR谱图 Fig.3 FT-IR spectra of LDHs and LDOs |
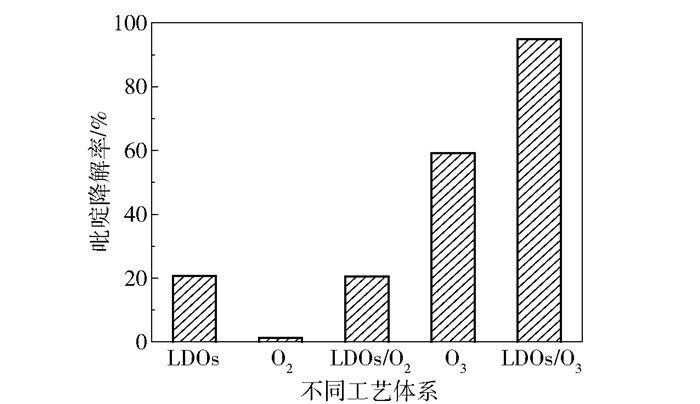
图 4为LDOs、单独O2、单独O3、LDOs/O2和LDOs/O3 5种工艺体系对吡啶降解效果的影响。从图中可以看出,单独O3经40 min反应后对吡啶的降解率为59.1%,而LDOs/O3对吡啶的降解率提高到94.9%,这说明LDOs的引入可明显提升臭氧对吡啶的降解效果。经过40 min的吸附,LDOs对吡啶的去除率为20.6%。单独O2和LDOs/O2对吡啶的去除率分别为1.3%和20.5%,这说明氧气几乎不与吡啶发生化学反应,LDOs的引入仅起到吸附作用,排除了催化臭氧过程中氧气对吡啶降解效果的干扰作用。
|
反应时间为40 min;反应温度为25 ℃;初始pH为7.0;初始吡啶的质量浓度为300 mg/L;气体流量为55 mg/min;废水体积为1 L。 图 4 不同工艺体系对吡啶降解率的影响 Fig.4 Effect of different process systems on pyridine degradation efficiency |
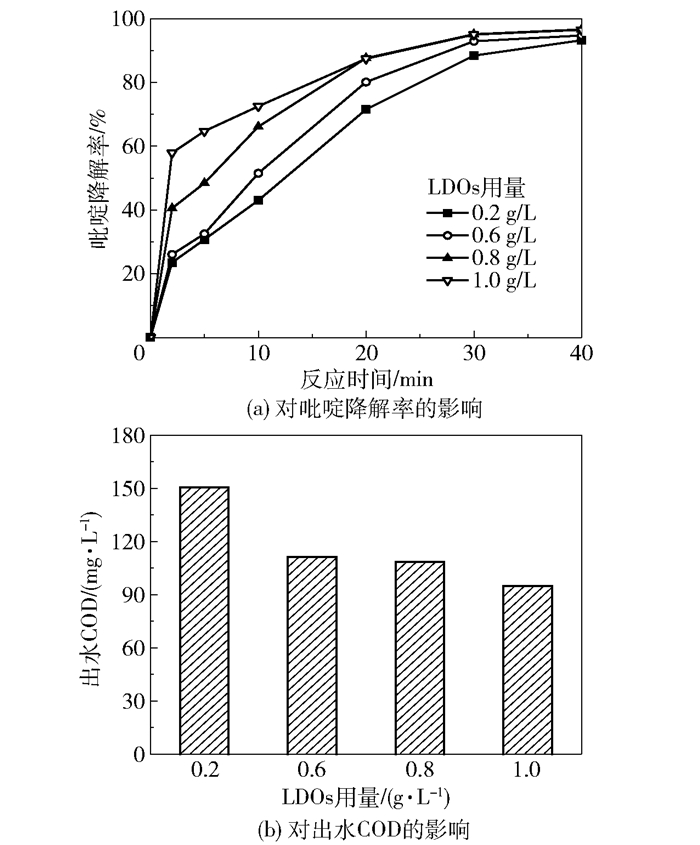
图 5为催化剂LDOs的用量对吡啶降解率和出水COD的影响。从图 5(a)中可以看出,0~20 min反应过程中,吡啶降解率随催化剂用量的增加而增大,20~40 min反应过程中,随催化剂用量的增加,吡啶降解率先增大后趋于平缓,反应40 min时吡啶降解率均可达到93.2%以上。从图 5(b)中可以看出,出水COD随催化剂用量的增加,由150.5 mg/L逐渐减小至94.8 mg/L,但催化剂用量达到0.6 g/L以上时,出水COD的减小开始变得缓慢。增加催化剂用量可提供更多与臭氧反应的表面,使吡啶的降解速率增大,而催化剂用量增加到一定程度对吡啶的降解效果并没有明显提升,这可能是因为溶解在废水中的臭氧是有限的,随着催化剂用量的增加,单位质量催化剂吸附臭氧的比例越来越小。从经济角度考虑,LDOs催化剂适宜的投加量为0.6 g/L。
|
反应时间为40 min;反应温度为25 ℃;初始pH为7.0;初始吡啶的质量浓度为300 mg/L;臭氧流量为55 mg/min;废水体积为1 L。 图 5 LDOs用量对吡啶降解率和出水COD的影响 Fig.5 Effects of LDOs dosage on pyridine degradation efficiency and effluent COD |
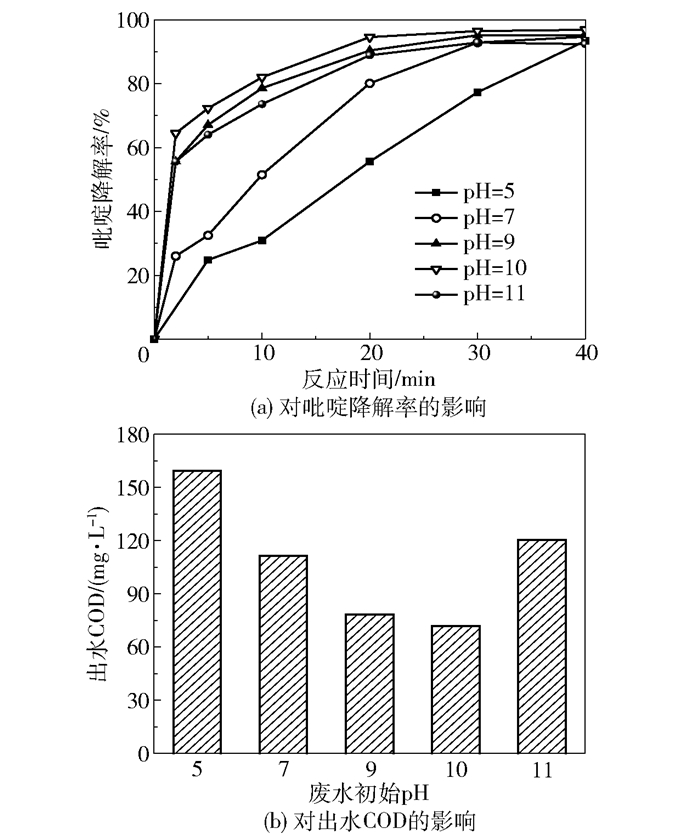
图 6为废水初始pH对吡啶降解率和出水COD的影响。从图 6(a)中可以看出,随着废水初始pH从5增至11,在0~40 min反应过程中吡啶降解率在废水初始pH=10时始终处于最大,反应40 min时可达到96.9%。从图 6(b)中可以看出,出水COD先由159.5 mg/L(pH=5)减小至71.7 mg/L(pH=10),随后又增大至120.4 mg/L(pH=11)。酸性条件下,臭氧主要通过直接氧化降解水中的吡啶分子,降解速率较慢。OH-是臭氧分解的链反应的引发剂,能导致强氧化性·OH的形成。随着初始废水pH的升高,溶液中的OH-浓度增大,臭氧分子分解产生·OH的速度逐渐加快,从而提高了吡啶的降解速率。然而,当废水初始pH大于10时,不利于LDOs催化臭氧氧化降解水中的吡啶。原因可能是强碱环境下会中和LDOs表面的Lewis酸位点,影响了表面羟基的生成,不利于臭氧分子的吸附。另外,过量的·OH会相互作用生成H2O2,同时也会与臭氧分子分解过程中产生的HO2·反应,使吡啶废水中·OH的数量大幅减少,导致吡啶降解率降低,出水COD增大。因此,LDOs/O3降解吡啶的适宜废水初始pH为10。
|
反应时间为40 min;反应温度25 ℃;催化剂用量为0.6 g/L;初始吡啶的质量浓度为300 mg/L;臭氧流量为55 mg/min;废水体积为1 L。 图 6 废水初始pH对吡啶降解率和出水COD的影响 Fig.6 Effects of initial pH on pyridine degradation efficiency and effluent COD |
图 7为初始吡啶的质量浓度对吡啶降解率和出水COD的影响。从图 7(a)中可以看出,初始吡啶的质量浓度C0=500 mg/L时,在反应40 min时吡啶降解率为91.1%,而C0=100、200 mg/L和300 mg/L时分别只需8.2、13.8 min和28.6 min即可达91.1%。从图 7(b)中可以看出,出水COD随初始吡啶的质量浓度的增大而增大,由40.6 mg/L增大至299.5 mg/L,值得注意的是,C0=100 mg/L和200 mg/L时出水COD维持在50 mg/L以下。初始吡啶的质量浓度较高时,水中臭氧浓度和催化剂用量相对不足。同时由于吡啶降解中间体的不断累积,与吡啶分子共同竞争·OH,导致吡啶降解速率减慢和出水COD升高。

|
反应时间为40 min;反应温度为25 ℃;初始pH为7.0;催化剂用量为0.6 g/L;臭氧流量为55 mg/min;废水体积为1 L。 图 7 初始吡啶的质量浓度对吡啶降解率和出水COD的影响 Fig.7 Effects of initial pyridine mass concentration on pyridine degradation efficiency and effluent COD |
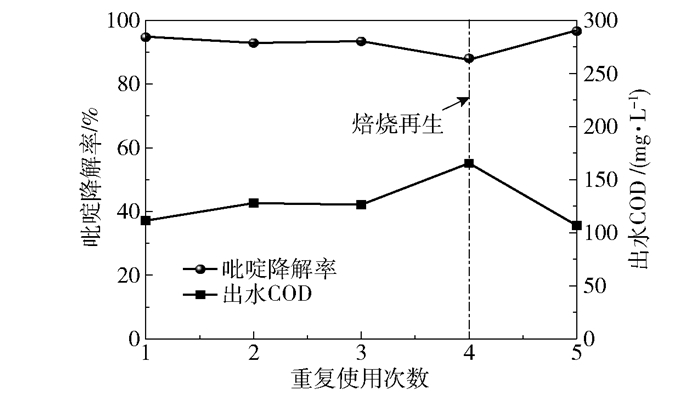
从图 8中可以看出,LDOs经重复使用3次后,吡啶降解率由首次的94.7%下降到93.4%,下降率仅为1.4%,出水COD由首次的114.1 mg/L上升到126.4 mg/L,上升率为10.8%,这表明LDOs在前3次使用过程中循环稳定性良好。而在第4次重复使用时,吡啶降解率和出水COD分别达到了88.1%和165.5 mg/L,LDOs的催化活性开始明显下降。这可能是因为吡啶降解产物中含有硝酸根离子,由于水滑石的“记忆效应”,LDOs在含有阴离子的溶液中会部分恢复LDHs结构,使LDOs的比表面积降低。同时,LDOs在循环使用过程中,吡啶降解生成的有机物会覆盖在催化剂表面的活性位点上,这也是可能导致LDOs催化活性下降的原因之一[20]。值得注意的是,将重复使用4次后的LDOs重新于500 ℃焙烧2 h,进行第5次循环使用实验,结果发现LDOs的催化活性和首次使用时基本相当。以上结果及分析表明,所制备的LDOs材料在催化臭氧氧化降解吡啶的工艺过程中表现出良好且长期的催化能力。
|
反应时间为40 min;反应温度为25 ℃;初始pH为7.0;催化剂用量为0.4 g/L;初始吡啶的质量浓度为300 mg/L;臭氧流量为55 mg/min;废水体积为1 L。 图 8 LDOs使用次数对吡啶降解率和出水COD的影响 Fig.8 Effects of LDOs usage time on pyridine degradation efficiency and effluent COD |
在催化臭氧氧化降解有机污染物的过程中,臭氧一般通过两种机制氧化溶解在水中的有机污染物:臭氧直接氧化和臭氧分解为·OH的间接氧化。对于单独臭氧氧化和催化臭氧氧化降解吡啶的过程,表观反应速率方程可用式(2)表示。
| $ - \frac{{{\rm{d}}{C_t}}}{{{\rm{d}}t}} = {k_{\rm{a}}}C_t^mC_{{{\rm{O}}_3}}^n + {k_{\rm{b}}}C_t^mC_{.{\rm{OH}}}^p $ | (2) |
式中,Ct为t时刻吡啶的质量浓度,CO3为水中臭氧的质量浓度,C·OH为水中·OH的质量浓度,ka为臭氧与吡啶之间的反应速率常数,kb为·OH与吡啶之间的反应速率常数,m、n和p为反应级数。
由于通入的臭氧是连续且过量的,CO3和C·OH一般可近似看作常数。于是,可将式(2)改为表观反应速率常数方程,如式(3)所示。
| $ { - \frac{{{\rm{d}}{C_t}}}{{{\rm{d}}t}} = kC_t^m} $ | (3) |
| $ {k = {k_{\rm{a}}}C_{{{\rm{O}}_3}}^n + {k_{\rm{b}}}C_{ \cdot {\rm{OH}}}^p} $ | (4) |
式中,k为表观反应速率常数。当m为1和2时,将式(3)分别积分可得伪一级和伪二级表观反应速率方程,分别如式(5)和(6)所示。
| $ {\ln \left( {\frac{{{C_0}}}{{{C_t}}}} \right) = {k_1}t} $ | (5) |
| $ {\frac{1}{{{C_t}}} - \frac{1}{{{C_0}}} = {k_2}t} $ | (6) |
式中,k1为伪一级表观反应速率常数,min-1;k2为伪二级表观反应速率常数,L/(mg·min);C0为初始吡啶的质量浓度,mg/L;Ct为t时刻吡啶的质量浓度,mg/L。
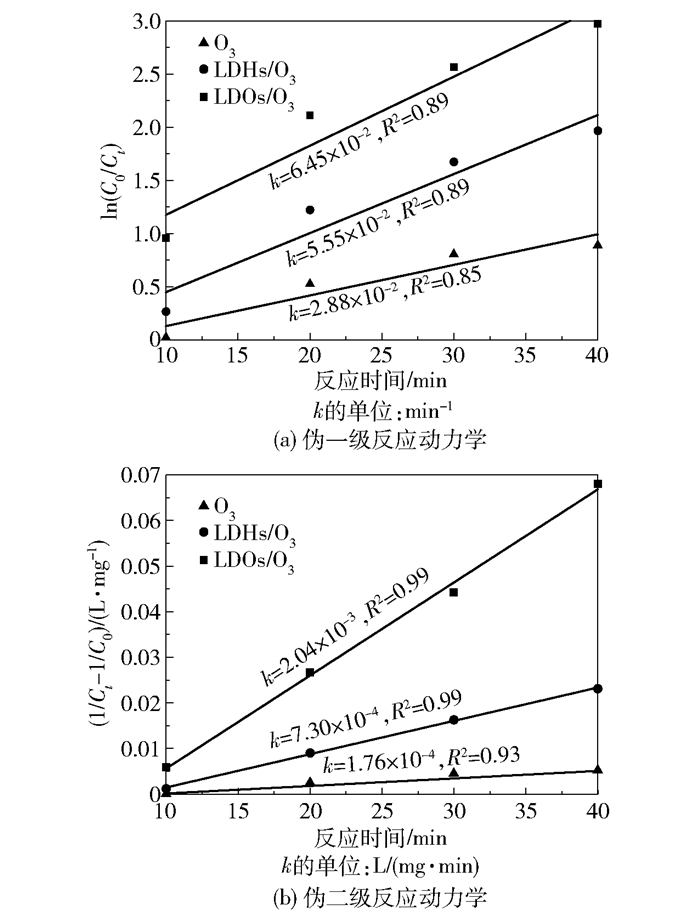
根据以上推论,对于单独O3、LDHs/O3和LDOs/O3 3种工艺体系降解吡啶废水的过程,将吡啶的质量浓度Ct随反应时间t的变化分别进行伪一级和伪二级反应动力学拟合,拟合曲线如图 9所示。根据拟合优度R2可以得出单独臭氧和催化臭氧氧化降解吡啶的过程均近似符合伪二级反应动力学模型。单独O3、LDHs/O3和LDOs/O3 3种体系的表观反应速率常数k分别为1.76×10-4、7.30× 10-4 L/(mg·min)和2.04×10-3 L/(mg·min),其中,LDOs/O3的表观反应速率常数分别是单独O3的11.59倍和LDHs/O3的2.79倍。由此可见,LDOs/O3体系可明显加快吡啶的降解速率,从反应动力学方面证实了LDOs比LDHs具有更好的催化性能。
|
图 9 伪一级和伪二级反应动力学拟合曲线 Fig.9 Pseudo first order and pseudo second order kinetics fitting curves |
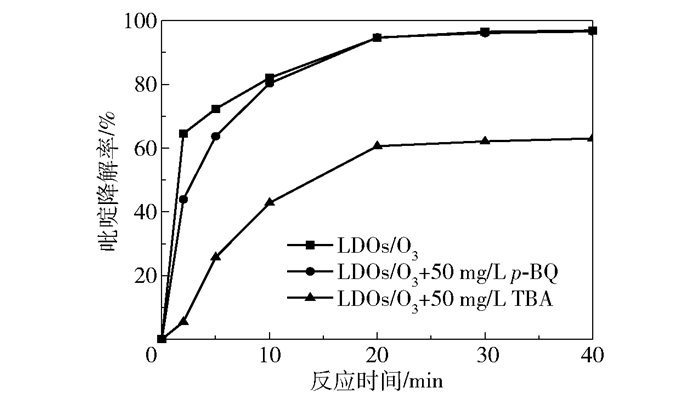
在催化臭氧氧化降解吡啶的过程中,臭氧在引发剂OH-的作用下分解产生了·OH和·O2-两种含氧自由基。为了确定哪种自由基参与了吡啶的降解,选用叔丁醇(TBA)和对苯醌(p-BQ)分别作为·OH和·O2-的有机猝灭剂,屏蔽·OH和·O2-对吡啶降解的贡献。图 10为TBA和p-BQ对LDOs/O3体系降解吡啶的影响。从图中可以看出,将50 mg/L TBA加入到反应体系中显著降低了吡啶降解率,反应40 min时吡啶降解率由96.9%(LDOs/O3)降为63%。而50 mg/L p-BQ的加入几乎没有影响吡啶的降解效果。由此可以推断,·OH是LDOs/O3体系降解吡啶的主要自由基。
|
反应温度为25 ℃;初始pH为10.0;催化剂用量为0.6 g/L;臭氧流量为55 mg/min;初始吡啶的质量浓度为300 mg/L;废水体积为1 L。 图 10 TBA和p-BQ对吡啶降解率的影响 Fig.10 Effects of TBA and p-BQ on pyridine degradation efficiency |
在反应时间为40 min,反应温度为25 ℃,初始pH为7.0,催化剂用量为0.6 g/L,臭氧流量为55 mg/min,初始吡啶的质量浓度为300 mg/L,废水体积为1 L的工艺条件下,通过LC-MS分析了氧化反应后吡啶的降解产物。在保留时间为4.59 min处检测到相对分子质量为73的降解产物,其分子式为C3H7NO且可能存在2种结构式,分别为N-甲基乙酰胺和N, N-二甲基甲酰胺。同时,从吡啶的降解产物中检测出了硝酸根离子。因此,吡啶的主要降解产物可能为N-甲基乙酰胺或N, N-二甲基甲酰胺有机化合物以及硝酸根离子、二氧化碳和水等小分子无机化合物。
3 结论(1) XRD和FT-IR结果表明所制备的锌镁铝类水滑石具有良好的层状结构。而经过500 ℃焙烧以后,其层状结构遭到了破坏,层间结晶水及阴离子发生了脱除。
(2) 对于初始质量浓度为300 mg/L的吡啶废水,在催化剂用量为0.6 g/L、初始pH为10和反应时间为40 min的条件下,吡啶降解率和出水COD可分别达到96.9%和71.7 mg/L,并且初始吡啶的质量浓度越低,降解速率越快。同时,LDOs在臭氧氧化降解吡啶的工艺中具有良好的催化稳定性。
(3) 单独臭氧和催化臭氧氧化降解吡啶的过程均近似符合伪二级反应动力学模型,且LDOs的引入对臭氧氧化降解吡啶具有明显的促进作用,LDOs/O3催化氧化降解吡啶废水的表观反应速率常数分别是单独O3的11.59倍和LDHs/O3的2.79倍。同时,实验证明了·OH是LDOs催化臭氧降解吡啶的主要自由基。吡啶的主要降解产物可能为N-甲基乙酰胺或N, N-二甲基甲酰胺有机物以及硝酸根离子、二氧化碳和水等小分子无机化合物。
| [1] |
SUBBARAMAIAH V, SRIVASTAVA V C, MALL I D. Catalytic activity of Cu/SBA-15 for peroxidation of pyridine bearing wastewater at atmospheric condition[J]. AIChE Journal, 2013, 59(7): 2577-2586. DOI:10.1002/aic.14017 |
| [2] |
ZHU J Y, ZHU Z L, ZHANG H, et al. Efficient degradation of organic pollutants by peroxymonosulfate activated with MgCuFe-layered double hydroxide[J]. RSC Advances, 2019, 9(4): 2284-2291. DOI:10.1039/C8RA09841G |
| [3] |
LU H T, ZHU Z L, ZHANG H, et al. Fenton-like catalysis and oxidation/adsorption performances of acetaminophen and arsenic pollutants in water on a multi-metal Cu-Zn-Fe-LDH[J]. ACS Applied Materials & Interfaces, 2016, 8(38): 25343-25352. |
| [4] |
杨龙, 董海山, 曾祥贵, 等. 超声-电絮凝法处理吡啶类农药废水[J]. 四川环境, 2018, 37(3): 11-16. YANG L, DONG H S, ZENG X G, et al. Treatment of pyridine pesticide wastewater by ultrasonic electrofloccuiation[J]. Sichuan Environment, 2018, 37(3): 11-16. (in Chinese) DOI:10.3969/j.issn.1001-3644.2018.03.003 |
| [5] |
MANCIPE S, TZOMPANTZI F, ROJAS H, et al. Photocatalytic degradation of phenol using MgAlSn hydrotalcite-like compounds[J]. Applied Clay Science, 2016, 129: 71-78. DOI:10.1016/j.clay.2016.05.005 |
| [6] |
ZHU J Y, ZHU Z L, ZHANG H, et al. Calcined layered double hydroxides/reduced graphene oxide composites with improved photocatalytic degradation of paracetamol and efficient oxidation-adsorption of As(Ⅲ)[J]. Applied Catalysis B: Environmental, 2018, 225: 550-562. DOI:10.1016/j.apcatb.2017.12.003 |
| [7] |
ZHU S M, DONG B Z, YU Y H, et al. Heterogeneous catalysis of ozone using ordered mesoporous Fe3O4 for degradation of atrazine[J]. Chemical Engineering Journal, 2017, 328: 527-535. DOI:10.1016/j.cej.2017.07.083 |
| [8] |
MARTINS R C, QUINTA-FERREIRA R M. Catalytic ozonation of phenolic acids over a Mn-Ce-O catalyst[J]. Applied Catalysis B: Environmental, 2009, 90: 268-277. DOI:10.1016/j.apcatb.2009.03.023 |
| [9] |
HU E L, WU X B, SHANG S M, et al. Catalytic ozonation of simulated textile dyeing wastewater using mesoporous carbon aerogel supported copper oxide catalyst[J]. Journal of Cleaner Production, 2016, 112: 4710-4718. DOI:10.1016/j.jclepro.2015.06.127 |
| [10] |
YANG L, HU C, NIE Y L, et al. Catalytic ozonation of selected pharmaceuticals over mesoporous alumina supported manganese oxide[J]. Environmental Science & Technology, 2009, 43(7): 2525-2529. |
| [11] |
FARIA P C C, MONTEIRO D C M, ÓRFÃO J J M, et al. Cerium, manganese and cobalt oxides as catalysts for the ozonation of selected organic compounds[J]. Chemosphere, 2009, 74(6): 818-824. DOI:10.1016/j.chemosphere.2008.10.016 |
| [12] |
WANG B, XIONG X G Y, REN H Y, et al. Preparation of MgO nanocrystals and catalytic mechanism on phenol ozonation[J]. RSC Advances, 2017, 7(69): 43464-43473. DOI:10.1039/C7RA07553G |
| [13] |
MOUSSAVI G, MAHMOUDI M. Degradation and biodegradability improvement of the reactive red 198 azo dye using catalytic ozonation with MgO nanocrystals[J]. Chemical Engineering Journal, 2009, 152(1): 1-7. DOI:10.1016/j.cej.2009.03.014 |
| [14] |
MA J, SUI M H, ZHANG T, et al. Effect of pH on MnOx/GAC catalyzed ozonation for degradation of nitrobenzene[J]. Water Research, 2005, 39(5): 779-786. DOI:10.1016/j.watres.2004.11.020 |
| [15] |
PETRE A L, CARBAJO J B, ROSAL R, et al. CuO/SBA-15 catalyst for the catalytic ozonation of mesoxalic and oxalic acids. water matrix effects[J]. Chemical Engineering Journal, 2013, 225: 164-173. DOI:10.1016/j.cej.2013.03.071 |
| [16] |
LI C H, JIANG F, SUN D Z, et al. Catalytic ozonation for advanced treatment of incineration leachate using (MnO2-Co3O4)/AC as a catalyst[J]. Chemical Engineering Journal, 2017, 325: 624-631. DOI:10.1016/j.cej.2017.05.124 |
| [17] |
中华人民共和国国家环境保护局. 水质硝酸盐氮的测定酚二磺酸分光光度法: GB/T 7480-1987[S]. 北京: 中国环境科学出版社, 1987. National Environmental Protection Agency of the People's Republic of China. Water quality-Determination of nitrate-Spectrophotometric method with phenol disulfonic acid: GB/T 7480-1987[S]. Beijing: China Environmental Science Press, 1987. (in Chinese) |
| [18] |
朱建, 张秀芹, 金吉, 等. 尿素水热法制备锌镁铝多元水滑石及形成机理[J]. 无机盐工业, 2016, 48(3): 39-42. ZHU J, ZHANG X Q, JIN J, et al. Synthesis of Zn-Mg-Al-CO3 LDHs with urea hydrothermal method and its formation mechanism[J]. Inorganic Chemicals Industry, 2016, 48(3): 39-42. (in Chinese) |
| [19] |
高昆, 汪朝晖, 汪效祖. 水热法制备Zn-Mg-Al花状水滑石[J]. 精细化工, 2013, 30(2): 126-129, 143. GAO K, WANG C H, WANG X Z. Hydrothermal synthesis and characterization of Zn-Mg-Al hydrotalcite[J]. Fine Chemicals, 2013, 30(2): 126-129, 143. (in Chinese) |
| [20] |
李钰. 活性氧化铝及载铈活性氧化铝催化臭氧氧化处理废水[D]. 杭州: 浙江大学, 2016. LI Y. Catalytic ozonation of wastewater by activated alumina or cerium supported activated alumina[D]. Hangzhou: Zhejiang University, 2016. (in Chinese) |








