自1982年礼来公司推出重组人胰岛素以来,生物制药在市场扩展和技术方面取得了很大进展[1]。随着人们对治疗性蛋白市场需求的不断增加,对重组蛋白生产宿主生产能力的要求也越来越高。中国仓鼠卵巢(Chinese hamster ovary, CHO)细胞作为最常用的哺乳动物细胞生产宿主,相比于其他细胞类型具有以下几个关键优势:1)能够在化学成分清晰的无血清培养基中高密度生长;2)不易传播人类病毒;3)能够对表达的重组蛋白进行与人类相似的翻译后修饰;4)容易产生工程化细胞克隆,该细胞克隆可对目的基因进行高效且稳定的表达[2]。虽然具有上述优势,但是CHO细胞在生长能力和蛋白表达能力方面仍有待提高。
大部分治疗性蛋白为分泌型蛋白,如单克隆抗体、干扰素γ、促红细胞生成素等[3]。由于内质网在分泌途径中起着至关重要的作用,因此,不少学者研究了内质网蛋白和重组蛋白产生之间的相互关系。例如,Ku等[3]分别在CHO细胞和小鼠骨髓瘤细胞NS0中过表达X盒结合蛋白1的剪切形式(spliced form of X-box binding protein 1, XBP1s),研究该蛋白对这2种细胞分泌单克隆抗体、干扰素γ和促红细胞生成素的影响,结果表明,当合成重组蛋白的量超过了宿主细胞的分泌能力时,XBP1s能够显著提高重组蛋白的产量。除了XBP1s外,免疫球蛋白重链结合蛋白质(immunoglobulin heavy chain binding protein, BiP)、转录激活因子6(activating transcription factor 6, ATF6)[4]、真核起始因子2α(eukaryotic initiation factor 2α, eIF2α)[5]、转录激活因子4(activating transcription factor 4, ATF4)[6]、生长停滞和DNA损伤诱导蛋白34(growth arrest and DNA damage inducible protein 34, GADD34)[7]等也都在内质网的未折叠蛋白反应(UPR)中发挥重要作用。除了上述蛋白,其他一些蛋白质,如钙连蛋白(calnexin, CNX)[8]、钙网蛋白(calreticulin, CRT)[8]、蛋白质二硫键异构酶(protein disulfide isomerase, PDI)[9]、信号识别颗粒14(signal recognition particle 14, SRP14)[10]等也都被报道能够促进细胞的重组蛋白合成或分泌。
瞬时表达系统相对于稳定表达系统具有快速高效的优点,尤其适用于候选重组蛋白的初期研发。ExpiCHO-S细胞是一株能够适应高密度培养的悬浮细胞,被广泛用于重组蛋白的瞬时表达。LAG3(lymphocyte activation gene 3)为淋巴细胞激活基因,是一个潜在的肿瘤免疫治疗靶点。但目前用ExpiCHO-S细胞瞬时表达anti-hLAG3的水平较低,为了提高该抗体的表达水平,研究了过表达蛋白合成与分泌相关蛋白对ExpiCHO-S细胞生长和anti-hLAG3生产的影响,为该细胞的工程化改造提供依据,同时也为其他重组蛋白生产细胞的工程化改造提供借鉴。
1 实验部分 1.1 实验材料与仪器ExpiCHO-S细胞购于Thermo Fisher Scientific公司;LAG3-Relatlimab-IgG4由本实验室合成;pCAG-Hygro载体、pCAG-Hygro-IRES2-EGFP载体、大肠埃希菌(Escherichia coli)DH5α由本实验室保存;ExpiCHO-S细胞培养及表达所用培养基为ExpiCHO Expression Medium,络合培养基为Gibco OptiPRO SFM,细胞转染所用试剂为ExpiFectamine CHO试剂,均购于Thermo Fisher Scientific公司;台盼蓝购于美国Amresco公司。
恒温震荡培养箱(ISF1-X型,瑞士Adolf Kuhner公司),流式细胞仪(BD LSRFortessa型,美国BD公司),实时荧光定量PCR仪(qRT-PCR)(ABI PRISM 7000型,美国ABI公司),细胞计数仪(Countstar型,上海睿钰生物科技有限公司)。
1.2 实验方法 1.2.1 重组表达质粒构建human XBP1s、human ATF6c、CHO ATF4、human E2F1、Bovine eIF2α、CHO GADD34、CHO NFKBIz、human C/EBPα、human BiP、CHO CRT、CHO CNX、CHO PDI、CHO ERP57、human SLY1、human vAMP8、human SRP14、human Munc18c、human SNAP-23、human CERT和human mTOR共20种蛋白的基因序列由其氨基酸序列(www.uniprot.org/)经密码子优化后由北京擎科生物科技有限公司合成,随后由本实验室构建表达载体,连接载体时所用的酶切位点为Nhe Ⅰ和BamH Ⅰ,引物信息如表 1所示。表达载体构建完成后通过基因测序验证其是否连接正确。
| 下载CSV 表 1 实验所用引物 Table 1 Primers used in this study |
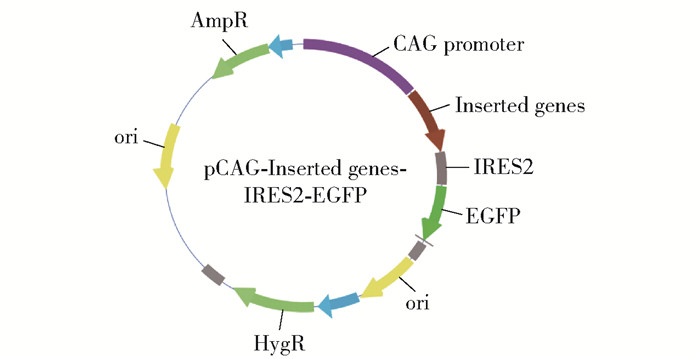
为检测上述蛋白的表达载体在细胞中的转染效率,在这些蛋白的基因后连接增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因作为报告基因,之间用IRES2连接,重组表达质粒图谱见图 1。
|
图 1 重组表达质粒图谱 Fig.1 Recombinant expression plasmid map |
于24孔深孔板中每孔接种6×106个/mL的ExpiCHO-S细胞2.5 mL。取1.5 mL无菌离心管,加入192 μL Gibco OptiPRO SFM,然后加入2 μg质粒DNA,轻柔混匀后加入8 μL ExpiFectamine CHO试剂,再次轻柔混匀,立即加入准备好的细胞悬液中。在2 μg质粒DNA中,LAG3-Relatlimab-IgG4质粒轻重链(1∶1,质量比)共1.6 μg,蛋白合成与分泌相关蛋白的质粒为0.4 μg。将细胞置于37 ℃、8% CO2、200 r/min的恒温震荡培养箱中培养。在转染后18~22 h内加入15 μL Enhancer和600 μL Feed。
1.2.3 转染效率测定取30 μL转染后培养72 h的细胞悬液,1 200 r/min离心5 min,弃上清,用无菌的磷酸盐缓冲液(PBS)洗涤2次,再用50 μL PBS重悬细胞,用流式细胞仪检测EGFP的表达情况。阴性对照细胞为转染了pCAG-Hygro载体和anti-hLAG3轻重链的ExpiCHO-S细胞,以及转染了pCAG-Hygro-IRES2-EGFP载体和anti-hLAG3轻重链的ExpiCHO-S细胞,并分别记为Null和EGFP。各基因的表达载体在细胞中的转染效率采用FlowJo 7.6分析,根据阴性对照细胞画门,再应用到所有处理细胞上,即可得到各基因的转染效率。
1.2.4 qRT-PCR测定XBP1s转录水平从瞬时转染后培养48 h的ExpiCHO-S细胞中提取总RNA,随后反转录得到cDNA。以甘油醛-3-磷酸脱氢酶基因(GAPDH)作为内参进行qRT-PCR分析。所用试剂盒为Power SYBRⓇ Green PCR Master Mix Kit(美国ABI公司)。采用2-ΔΔCt法计算XBP1s的mRNA相对含量。引物序列如表 2所示。
| 下载CSV 表 2 qRT-PCR所用引物 Table 2 Primers used in qRT-PCR |
吸取20 μL细胞悬液,加入20 μL 1 g/L台盼蓝,混匀,用细胞计数仪测定活细胞密度和细胞活率。
1.2.6 抗体产量及亲和力检测用Biacore 8K生物分子相互作用分析系统(美国GE公司)分析细胞上清中anti-hLAG3抗体的产量,检测芯片为Protein-A,缓冲液为pH 7.4的HBS- EP溶液,再生液为pH 2.0的Glycine溶液。
Anti-hLAG3与hLAG3间的亲和力测定同样采用Biacore 8K分析系统。使用Protein- A芯片在流速为10 μL/min的条件下,捕获上清中的anti-hLAG3,并对anti-hLAG3与25.00、12.50、6.25、3.12、1.56、0.78 nmol/L和0 nmol/L浓度的hLAG3蛋白进行动力学检测,流速为30 μL/min,结合和解离时间分别为180 s和600 s。使用Biacore 8K Insight Evaluation Software软件进行数据的拟合分析,得到结合常数Ka和解离常数Kd。
通过式(1)计算平衡解离常数KD。
| $ {K_{\rm{D}}} = {K_{\rm{d}}}/{K_{\rm{a}}} $ | (1) |
所有数据的测量均不少于3个平行,结果以平均值±标准差表示。
2 结果与讨论 2.1 过表达蛋白合成与分泌相关蛋白对ExpiCHO-S细胞的抗体产量和转染效率的影响哺乳动物细胞的蛋白合成和分泌能力能够直接影响重组蛋白的产量。因此,通过过表达蛋白合成与分泌途径中的关键蛋白有望提高细胞的重组蛋白产量。将参与蛋白合成与分泌的20种蛋白的基因与anti-hLAG3的抗体质粒共转染入ExpiCHO-S细胞中,检测转染后72 h培养物上清中抗体产量的变化。仅转染了pCAG-Hygro-IRES2-EGFP载体和anti-hLAG3轻重链的细胞上清中抗体的产量为24.21 μg/mL。为了更直观地体现各蛋白对ExpiCHO-S细胞生产anti-hLAG3的影响,将转染了各蛋白表达载体的细胞上清的抗体产量用相对产量(Cr)表示(式(2))。
| $ {C_{\rm{r}}} = {C_{\rm{m}}}/24.21 \times 100\% $ | (2) |
式中,Cm为实测产量(μg/mL)。
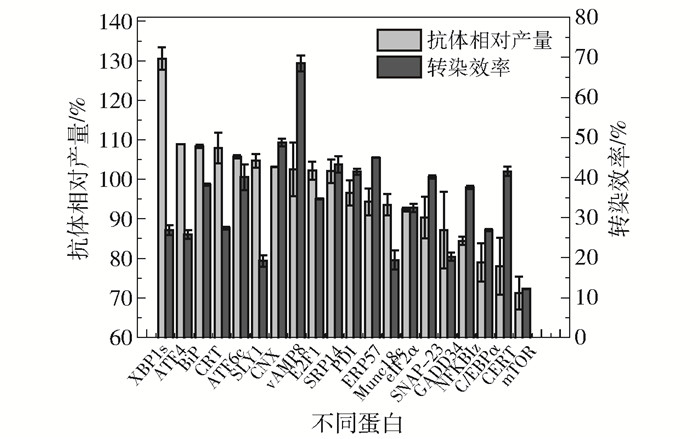
如图 2所示,相比于EGFP组,过表达XBP1s后能够使细胞的抗体产量提高30.56%。而过表达GADD34、NFKBIz、CERT、C/EBPɑ和mTOR后能够使抗体产量降低到87.18%~71.21%。其他14种蛋白对ExpiCHO-S细胞的抗体产量的影响则较小(抗体产量的变化率 < 10%)。分析这些蛋白的表达载体在ExpiCHO-S细胞中的转染效率发现,不同基因在细胞中的转染效率差异较大,并且不同基因的转染效率的差异与这些基因对细胞抗体产量影响的差异没有明显相关性。
|
图 2 过表达蛋白合成与分泌相关蛋白对ExpiCHO-S细胞的抗体相对产量和转染效率的影响 Fig.2 Effect of overexpression of proteins related to protein biosynthesis and secretion on relative antibody production and transfection efficiency of ExpiCHO-S cells |
为了进一步研究蛋白合成与分泌相关蛋白对ExpiCHO-S细胞生长的影响,选取对细胞抗体产量促进作用较明显的3种蛋白,即XBP1s、ATF4和BiP,研究其对ExpiCHO-S细胞的细胞活率和活细胞密度的影响。
如图 3(a)所示,在对照组(Null和EGFP组)中,转染后24 h细胞活率有轻微降低,48 h左右时细胞活率恢复,随后又开始降低,但在稳定期后期细胞活率仍然维持在较高水平(>90%)。与对照组相比,过表达XBP1s和BiP对细胞活率的影响均较小,细胞培养至216 h时细胞活率仍大于90%;过表达ATF4在转染后前192 h对细胞活率的影响也较小,但当继续培养到192 h时,细胞活率急剧降低至30.8%,比其他组细胞提前进入衰亡期。

|
图 3 过表达XBP1s、ATF4和BiP对细胞活率和活细胞密度的影响 Fig.3 Effects of XBP1s, ATF4 and BiP overexpression on cell viability and viable cell density |
同样考察了过表达上述蛋白后对ExpiCHO-S活细胞密度的影响,如图 3(b)所示,细胞转染后前48 h活细胞密度增长迅速,随后细胞生长逐渐进入稳定期,168 h后由于营养物质的缺乏细胞逐渐进入衰亡期。与对照组相比,过表达XBP1s和BiP对活细胞密度的影响较小。而过表达ATF4虽然能够轻微提高ExpiCHO-S细胞在指数期的活细胞密度(转染48 h后的细胞密度由EGFP组的1.20×107个/mL提高到1.37×107个/mL),但可能由于营养消耗较快,转染后192 h时活细胞密度即急剧降低,比对照组提前进入衰亡期。Gulis等[11]在CHO细胞中过表达XBP1s,发现其在提高IgG产量的同时,会降低活细胞密度。Pybus等[12]在研究过表达BiP对4种难表达单克隆抗体的影响时也发现10% BiP在提高抗体表达量的同时,会轻微降低活细胞密度。而在本研究中,过表达XBP1s和BiP对ExpiCHO-S细胞的活细胞密度和细胞活率的影响均较小;过表达ATF4虽然在细胞培养前期能够轻微提高活细胞密度,但会使细胞提前进入衰亡期。表明ExpiCHO-S细胞受蛋白的影响会随过表达蛋白种类的变化而不同。
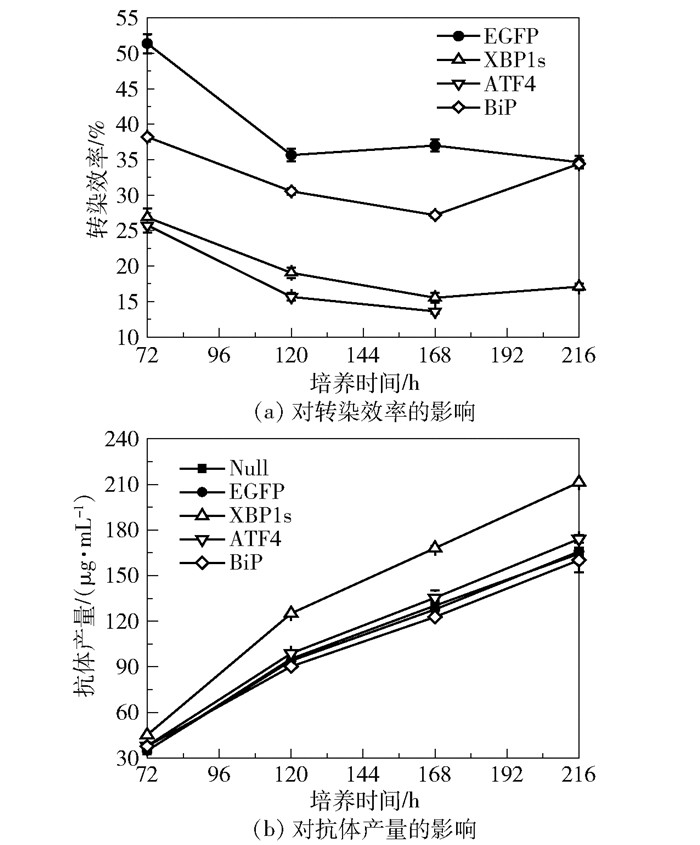
2.3 过表达XBP1s、ATF4和BiP对转染效率和抗体产量的影响如图 4(a)所示,转染后72 h,XBP1s、ATF4和BiP的表达载体在ExpiCHO-S细胞中的转染效率分别为26.9%、25.8%和38.2%。在168 h之前,随着培养时间的延长,转染效率逐渐降低。分析3种蛋白的过表达对抗体产量的影响发现(图 4(b)),XBP1s能够明显提高ExpiCHO-S细胞的抗体产量,相比于对照组(EGFP组),使216 h时的抗体产量提高了27.4%。而在抗体生产的整个过程中,过表达ATF4和BiP对anti-hLAG3产量的影响均较小。
|
图 4 过表达XBP1s、ATF4和BiP对转染效率和抗体产量的影响 Fig.4 Effects of XBP1s, ATF4 and BiP overexpression on transfection efficiency and antibody production |
XBP1s是内质网UPR中肌醇需求酶1(IRE1)/XBP1信号通路的关键因子,能够诱导分子伴侣和内质网蛋白降解途径中相关蛋白的表达。因此,XBP1s能够通过协助未折叠蛋白进行折叠并使未折叠蛋白降解而缓解内质网压力[6]。在现有文献中,XBP1s对哺乳动物细胞分泌重组蛋白的影响的争议较大。例如,Tigges等[13]研究了过表达人源XBP1s对CHO-K1细胞产分泌型碱性磷酸酶(SEAP)和分泌型α淀粉酶(SAMY)的影响。结果发现,XBP1s能够使SEAP和SAMY的产量分别提高到6倍和4倍,其介导的产量增加与产物的转录水平无关,而是通过克服分泌系统的分泌瓶颈实现产量的增加。此外,该研究还发现XBP1s对人源细胞系,包括HEK-293、HeLa和HT-1080细胞的异源蛋白生产无影响,并且其只能增加分泌型蛋白的产量。而Ku等[3]研究发现,过表达鼠源XBP1s对稳定表达单克隆抗体、干扰素γ和促红细胞生成素的CHO细胞的重组蛋白表达均没有显著影响,进一步研究发现只有当重组蛋白的产量达到细胞分泌上限时,过表达XBP1s才能够通过提高细胞分泌能力而提高蛋白产量;反之,蛋白产量则主要受转录及翻译水平调控。而在本研究中,XBP1s能够明显提高ExpiCHO-S细胞瞬时表达anti-hLAG3的产量,表明XBP1s对重组蛋白产量的提高可能不受蛋白来源和分泌瓶颈的限制。
ATF4属于转录激活因子/环状AMP响应元件结合蛋白(ATF/CREB)家族的碱性亮氨酸拉链转录因子,具有共有结合位点cAMP响应元件[14]。ATF4由包括缺氧/低氧、内质网应激、氨基酸剥夺和氧化应激在内的应激信号诱导。ATF4可增强UPR靶基因子集,包括GADD34和C/EBP同源蛋白(CHOP)的表达。ATF4也被UPR翻译上调。Ohya等[6]发现,在CHO细胞中过表达ATF4能够使培养液中抗凝血酶Ⅲ的产量提高66.7%。而在本研究中,ATF4对anti-hLAG3产量的影响较小,其原因还有待进一步研究。
BiP,也称为GRP78,是一种内质网驻留蛋白,能够与许多不完全折叠和未组装的蛋白结合。对于许多分泌或膜结合蛋白,其与BiP的结合是瞬时的;而对于折叠错误、糖基化不当或其他分泌不足的蛋白质,其与BiP的结合可以更稳定。Pybus等[12]发现,在CHO细胞中过表达BiP能够提高难表达mAb的比生产速率,但同时也会降低细胞生长速率。Dorner等[15]则发现降低内源性BiP的表达量能够提高异源蛋白的分泌。在本研究中,BiP对ExpiCHO-S细胞抗体生产的影响则较小。
2.4 XBP1s共转染比例对转染效率、XBP1s转录水平和抗体产量的影响通过调整瞬时转染过程中XBP1s表达质粒和anti-hLAG3表达质粒的转染比例,研究不同XBP1s共转染比例(以XBP1s表达质粒占总转染质粒的质量分数表示,下同)对ExpiCHO-S细胞表达重组抗体的影响,结果见图 5。
|
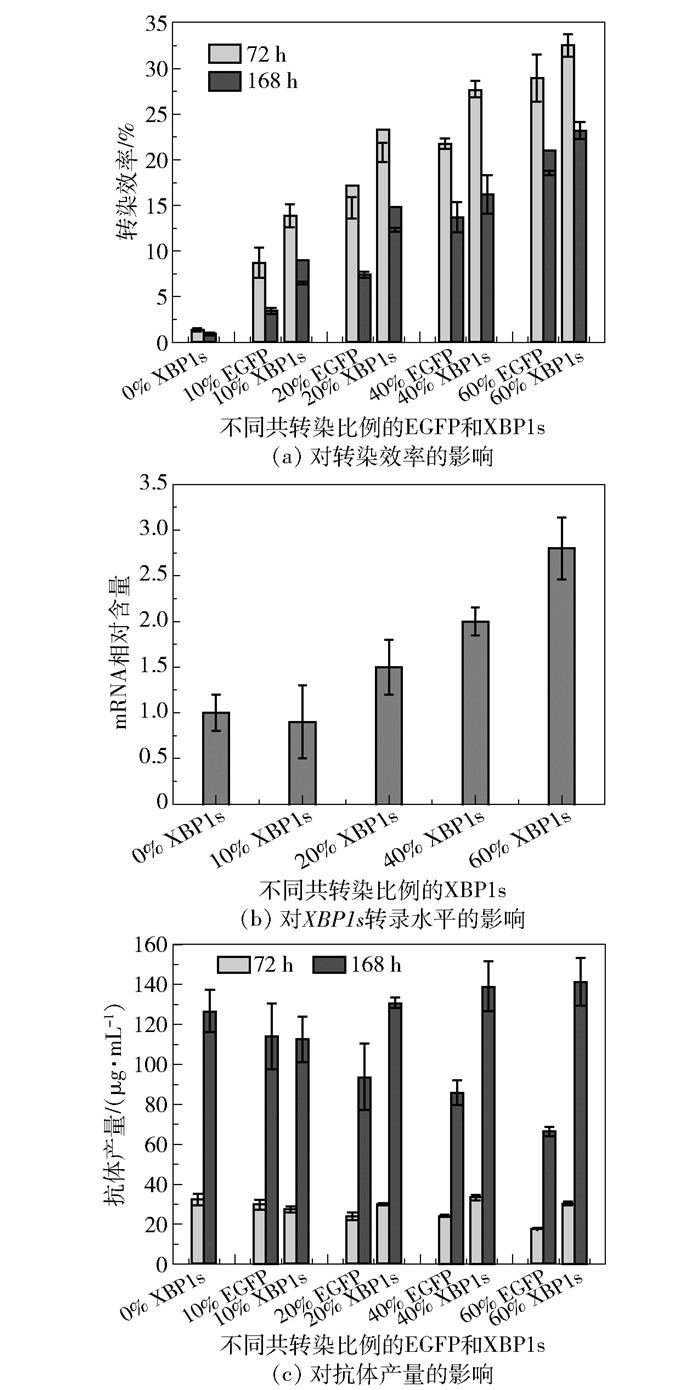
图 5 XBP1s共转染比例对转染效率、XBP1s转录水平和抗体产量的影响 Fig.5 Effect of XBP1s co-transfection ratio on transfection efficiency, XBP1s transcription level and antibody production |
如图 5(a)所示,随着转染过程中XBP1s表达质粒比例的增加,其在ExpiCHO-S细胞中的转染效率逐渐增加。并且在同一比例下,随着培养时间延长,XBP1s的转染效率降低。具体地,当XBP1s的共转染比例由10%提高到60%时,转染后72 h时的转染效率由13.85%提高到32.6%。通过qRT-PCR分析不同共转染比例的XBP1s在细胞中的转录水平发现(图 5(b)),当XBP1s共转染比例≥20%时,随着共转染比例的增加,其在细胞中的转录水平也增加,并且相对于XBP1s共转染比例为0%时,能够使XBP1s转录水平提高到1.5~2.8倍。
测定不同共转染比例的XBP1s对抗体产量的影响发现(图 5(c)),随着XBP1s转染比例的提高,相对于相同共转染比例的EGFP,XBP1s对细胞抗体生产的促进作用也逐渐增强。除10% XBP1s会轻微降低anti-hLAG3的抗体产量外,20%的XBP1s能够使anti-hLAG3在168 h时的抗体产量提高39.6%,当XBP1s的共转染比例提高到60%时,在168 h时的抗体产量提高到2.1倍,由共转染60%EGFP时的66.7 μg/mL提高到141.5 μg/mL。上述结果表明XBP1s在促进CHO细胞重组抗体生产方面有很大潜力。
2.5 过表达XBP1s对anti-hLAG3亲和力的影响为进一步研究过表达XBP1s对anti-hLAG3抗体质量的影响,测定了XBP1s共转染比例为60%时,anti-hLAG3对hLAG3的亲和力变化。如表 3所示,相比于对照药Relatlimab,过表达XBP1s后anti-hLAG3对hLAG3的KD值变化较小(8.40×10-11 vs. 9.99×10-11 mol/L),表明过表达XBP1s对anti-hLAG3的亲和力基本无影响。
| 下载CSV 表 3 过表达XBP1s对anti-hLAG3与hLAG3的亲和力的影响 Table 3 Effect of XBP1s overexpression on the affinity of anti-hLAG3 to hLAG3 |
(1) 对比研究了过表达20种参与调控蛋白合成与分泌途径的蛋白对ExpiCHO-S细胞表达抗体anti-hLAG3产量的影响,发现过表达XBP1s能够明显提高抗体产量。
(2) 提高XBP1s的共转染比例能够增强其对anti-hLAG3表达的促进作用,当XBP1s的共转染比例提高到60%时,相对于相同共转染比例的EGFP,168 h时的抗体产量可以提高到2.1倍。
(3) XBP1s的过表达对细胞生长及抗体的亲和力影响均较小。通过构建稳定过表达XBP1s的细胞株有望进一步提高该蛋白对抗体产量的促进作用。总的来说,XBP1s有望用于提高CHO细胞的重组蛋白生产力。
| [1] |
WALSH G. Biopharmaceutical benchmarks[J]. Nature Biotechnology, 2014, 32(10): 992-1000. DOI:10.1038/nbt.3040 |
| [2] |
TRILL J J, SHATZMAN A R, GANGULY S. Production of monoclonal antibodies in COS and CHO cells[J]. Current Opinion in Biotechnology, 1995, 6(5): 553-560. DOI:10.1016/0958-1669(95)80092-1 |
| [3] |
KU S C Y, NG D T W, YAP M G S, et al. Effects of overexpression of X-Box binding protein 1 on recombinant protein production in Chinese hamster ovary and NS0 myeloma cells[J]. Biotechnology and Bioengineering, 2007, 99(1): 155-164. |
| [4] |
LEE K, TIRASOPHON W, SHEN X H, et al. IRE1-mediated unconventional mRNA splicing and S2P-mediated ATF6 cleavage merge to regulate XBP1 in signaling the unfolded protein response[J]. Genes & Development, 2002, 16(4): 452-466. |
| [5] |
UNDERHILL M F, COLEY C, BIRCH J R, et al. Engineering mRNA translation initiation to enhance transient gene expression in Chinese hamster ovary cells[J]. Biotechnology Progress, 2003, 19(1): 121-129. DOI:10.1021/bp025560b |
| [6] |
OHYA T, HAYASHI T, KIYAMA E, et al. Improved production of recombinant human antithrombin Ⅲ in Chinese hamster ovary cells by ATF4 overexpression[J]. Biotechnology and Bioengineering, 2007, 100(2): 317-324. |
| [7] |
OMASA T, TAKAMI T, OHYA T, et al. Overexpression of GADD34 enhances production of recombinant human antithrombin Ⅲ in Chinese hamster ovary cells[J]. Journal of Bioscience and Bioengineering, 2008, 106(6): 568-573. DOI:10.1263/jbb.106.568 |
| [8] |
CHUNG J Y, LIM S W, HONG Y J, et al. Effect of doxycycline-regulated calnexin and calreticulin expression on specific thrombopoietin productivity of recombinant Chinese hamster ovary cells[J]. Biotechnology and Bioengineering, 2004, 85(5): 539-546. DOI:10.1002/bit.10919 |
| [9] |
MOHAN C, PARK S H, CHUNG J Y, et al. Effect of doxycycline-regulated protein disulfide isomerase expression on the specific productivity of recombinant CHO cells: thrombopoietin and antibody[J]. Biotechnology and Bioengineering, 2007, 98(3): 611-615. DOI:10.1002/bit.21453 |
| [10] |
LE FOURN V, GIROD P A, BUCETA M, et al. CHO cell engineering to prevent polypeptide aggregation and improve therapeutic protein secretion[J]. Metabolic Engineering, 2014, 21: 91-102. DOI:10.1016/j.ymben.2012.12.003 |
| [11] |
GULIS G, SIMI K C R, DE TOLEDO R R, et al. Optimization of heterologous protein production in Chinese hamster ovary cells under overexpression of spliced form of human X-box binding protein[J]. BMC Biotechnology, 2014, 14(1): 26. DOI:10.1186/1472-6750-14-26 |
| [12] |
PYBUS L P, DEAN G, WEST N R, et al. Model-directed engineering of "difficult-to-express" monoclonal antibody production by Chinese hamster ovary cells[J]. Biotechnology and Bioengineering, 2014, 111(2): 372-385. DOI:10.1002/bit.25116 |
| [13] |
TIGGES M, FUSSENEGGER M. Xbp1-based engineering of secretory capacity enhances the productivity of Chinese hamster ovary cells[J]. Metabolic Engineering, 2006, 8: 264-272. DOI:10.1016/j.ymben.2006.01.006 |
| [14] |
AMERI K, HARRIS A L. Activating transcription factor 4[J]. International Journal of Biochemistry & Cell Biology, 2008, 40: 14-21. |
| [15] |
DORNER A J, KRANE M G, KAUFMAN R J. Reduction of endogenous GRP78 levels improves secretion of a heterologous protein in CHO cells[J]. Molecular and Cellular Biology, 1988, 8(10): 4063-4070. DOI:10.1128/MCB.8.10.4063 |








