2. 北京化工大学 化学工程学院, 北京 100029;
3. 生态环境部 环境工程评估中心, 北京 100012
2. College of Chemical Engineering, Beijing University of Chemical Technology, Beijing 100029;
3. Environmental Engineering Assessment Center, Ministry of Ecology and Environment, Beijing 100012, China
疏水纳米颗粒因表面能较高而易于富集在气-液、液-液相界面处,其富集与分布行为对复合材料制备、润滑油清净剂合成等过程影响显著,日益受到人们的关注[1-4]。利用该富集现象可以形成Pickering乳液、泡沫等稳定的分散相液滴或气泡,进而通过固化颗粒层等方式实现复合结构微球、自组装材料或复合膜等诸多功能材料的制备[5-8]。
然而,界面处疏水颗粒层带来的稳定气泡、液滴的作用并不利于相间传质的进行[9-11],尤其是在无机粉体工业中,制备疏水性纳米颗粒通常需要进行颗粒表面改性操作,即加入具有表面活性剂性质的改性剂以提高纳米颗粒的疏水程度。随着改性过程的进行,颗粒疏水化程度逐渐增加,从而更加易于富集在相界面处并阻碍传质[12-13]。以疏水CaCO3纳米颗粒的改性过程为例,其高品质产品通常以Ca(OH)2溶液或悬浊液、CO2气体为原料,在合成过程中原位加入硬脂酸钠等改性剂进行疏水化改性[14]。颗粒在气-液界面的吸附能Wr,与气-液界面的张力γo、颗粒与界面的接触角θ和颗粒半径R存在如下定量关系[15]。
| $ {W_{\rm{r}}} = {\gamma _{\rm{o}}}{R^2}{\rm{ \mathsf{ π} }}{(1 \pm \cos \theta )^2} $ | (1) |
与表面活性剂小分子不同,R更大的纳米颗粒通常会在气-液界面处发生难以逆转的吸附行为,吸附能可达几千kBT(kB为玻尔兹曼常数,T为开尔文温度)[16]。从吸附能的角度而言,需要很强的外界功作用才能使吸附的颗粒离开气-液相界面。因此,对于含有疏水化纳米颗粒的气-液体系,需要精确量化纳米颗粒在相界面上的分布状态,将气-液传质过程控制在颗粒达到临界吸附状态对应的操作范围内,避免在疏水颗粒大量富集于相界面、严重阻碍传质的条件下进行传质操作。
在物理作用方面,富集在气-液界面处的疏水颗粒间不同程度的相互作用导致了颗粒层和界面性质的差异[17],量化颗粒间的相互作用也成为了研究的关键。然而纳米颗粒在界面处的相互作用行为非常复杂,实验研究较为困难。对此,研究者们一般通过界面颗粒层的整体行为进行预测和定量计算[18-19]。由于纳米颗粒的界面稳定性与颗粒层的结构和黏弹性特性有关(即颗粒层对压缩和剪切作用的响应),气-液界面颗粒层也能直观反映出纳米颗粒的相互作用。实际上,流变特性不仅可以体现颗粒层的微观结构,还有助于确定操作条件和控制反应进程[20]。特别是对于无机纳米颗粒的原位改性技术而言,研究气-液界面疏水颗粒层的流变特性具有重要意义。
目前,研究者们对气-液界面颗粒层的动力学行为和热力学平衡状态也开展了一些研究。如Comeau等[21]通过在Langmuir-Blodgett(LB)膜分析仪中设置振荡挡板提取颗粒层,精确量化了疏水颗粒层的压缩黏弹性和其他界面性质。Zang等[22]研究了不同疏水性SiO2纳米颗粒在气-液界面形成单颗粒层的行为,证明该层的黏弹性是由颗粒表面的化学性质(润湿性、电荷)所决定,而且颗粒的疏水性对颗粒层的拉伸流变性能、稳定性都有显著影响。然而当前的工作大多局限于对气-液相界面处颗粒层流变特性的研究,尚未揭示流变特性与诸多合成方法所面临的气-液传质过程之间的内在联系。因此,仍需要进一步探究疏水性纳米颗粒在气-液界面分布与相间传质行为的定量关系。例如在CaCO3的改性过程中,CaCO3纳米颗粒疏水性不断增强,在气-液界面持续富集,(RCOO)2Ca产生并吸附在固-液表面形成疏水颗粒,如式(2)、(3)所示。
| $ {{\rm{C}}{{\rm{a}}^{2 + }} + {\rm{RCO}}{{\rm{O}}^ - } \to ({\rm{RCOO}}){\rm{C}}{{\rm{a}}^ + }} $ | (2) |
| $ {({\rm{RCOO}}){\rm{C}}{{\rm{a}}^ + } + {\rm{RCO}}{{\rm{O}}^ - } \to {{({\rm{RCOO}})}_2}{\rm{Ca}}} $ | (3) |
在此过程中,界面处疏水基团越来越多,同时由于纳米颗粒界面能高、稳定作用强,界面颗粒层流变行为和传质过程均发生较大改变,进而造成后续合成过程传质效率低,体系过饱和度逐渐降低,爆炸性成核作用削弱,难以获得较小的纳米颗粒。CaCO3颗粒的改性程度也不断降低,所需合成时间大幅增加。对此,如果进一步将颗粒层流变行为与气-液传质效率建立联系,不仅可以通过界面处颗粒层的流变行为预测合适的传质操作范围,还可以量化颗粒的原位改性程度,针对性地设计后续改性方法。
本课题组前期已成功利用膜分散结构的微反应器实现了CaCO3纳米颗粒的原位改性,而且通过微反应器可以较好地控制气体分散尺度,气-液相界面尺寸易于量化和建立模型计算[14]。因此,本文提出以尺寸均一的微气泡作为研究平台,以原位改性CaCO3纳米颗粒作为研究体系,探索CaCO3纳米颗粒在气-液界面所形成颗粒层的流变特性,并结合相应的传质效率进行综合研究,量化颗粒分布行为与气-液传质过程的关系。
1 实验部分 1.1 实验原料Ca(OH)2,95.0%,硬脂酸钠,99.9%,三氯甲烷,99.0%,天津永大化学试剂有限公司;CO2混合气,体积分数99.999%,北京市华元气体化工有限公司。
1.2 不同改性度CaCO3纳米颗粒的制备以Ca(OH)2、硬脂酸钠和CO2气体为原料,利用微反应器制备了改性度为0~100%的CaCO3纳米颗粒作为体系添加颗粒,用于研究颗粒亲疏水性对气泡流变性和气-液传质过程的影响规律。制备过程简述如下[14]:配制100 mL质量浓度为50 g/L的Ca(OH)2悬浊液,加热至80 ℃并加入与Ca(OH)2质量比范围为0~0.05的硬脂酸钠,保持浆料循环流动并通入CO2气体,直至pH值降低到7时停止通入气体并老化1 h,之后离心分离出沉淀,去离子水清洗沉淀后干燥(100 ℃干燥24 h),最终获得不同改性度的CaCO3纳米颗粒粉体。
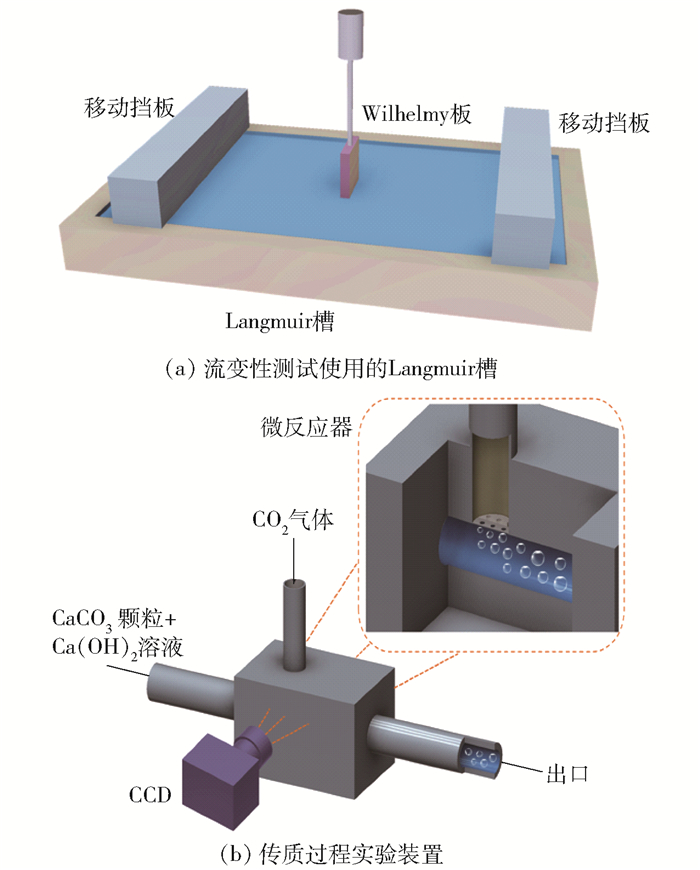
1.3 颗粒层流变性能测试采用如图 1(a)所示的Langmuir槽(JML04C1,上海中晨数字技术设备有限公司)测试颗粒层的流变性能。Langmuir槽配备有一对可移动挡板,中间配备的Wilhelmy板用于测量液层的表面张力γ,槽面几何尺寸为400 mm×160 mm(长×宽)。首先将疏水CaCO3纳米颗粒分散到三氯甲烷中,质量浓度为1 mg/mL,通过注射泵(LSP02-1B,保定兰格恒流泵有限公司)将CaCO3的三氯甲烷悬浮液逐滴滴在槽中水面上,将颗粒铺展于水面表层,形成颗粒层。
|
图 1 流变性测试装置及传质过程实验装置示意图 Fig.1 Sketch of the rheological test and the experimental set-up for the mass transfer process |
在流变性能测试中,Langmuir槽中的两个对向放置的挡板以5 cm2/min的速度同时移动,使界面处颗粒表面浓度Γ发生变化。而液面表面张力γ可以通过Γ和疏水CaCO3纳米颗粒在平板上形成浸润层的周长来计算[21],进而得到表面压力Π为
| $ \varPi = {\gamma _{\rm{w}}} - \gamma $ | (4) |
式中,γw是纯水状态下的表面张力。通过测量某表面浓度下的γ,即可计算出表面压力Π的数值,进而得到Π-Γ曲线,即表面压力等温线。根据这一曲线还可以计算出颗粒层的压缩模量E,如式(5)所示。
| $ E = \varGamma \frac{{\partial \varPi }}{{\partial \varGamma }} $ | (5) |
气-液传质测试的实验装置如图 1(b)所示,采用膜分散结构微反应器进行气-液混合和传质。微反应器内的分散介质为平均孔径1 μm、面积12.5 mm2的不锈钢烧结膜。微反应器内主通道的几何尺寸为20 mm×2 mm×0.5 mm(长×宽×高)。
将Ca(OH)2溶液(0.75 g/L)与不同改性度(0~100%)的CaCO3纳米颗粒(颗粒加入量为0.1~1 g/L)混合,作为连续相,CO2气体(0.3 MPa)作为分散相,在微反应器中与连续相流体混合。分散介质两侧的压差促使气体透过烧结膜,并以微气泡的形式将气相分散于连续相中。连续相流量为100 mL/min,分散相流量为5 mL/min。在该流量条件下,既可以为CO2提供过量的OH-,还可以提供较高的液-气比(即体积比为20:1),避免气泡之间距离过近而发生聚并,确保单一气泡体积测量准确。在不同停留时间下对悬浮液取样并滴定未反应的Ca(OH)2,确定单位时间内的传质量。
1.5 表征与测试采用PL-A742型高速电荷耦合器件(CCD)摄像机显微镜(PixeLINK公司)在20~200放大倍数下记录并测量微气泡的直径。采用JEOL 100CX型透射电子显微镜(TEM,日本电子株式会社)拍照并统计颗粒粒径。通过STA 409 PC型热重分析仪(德国耐驰公司)表征颗粒的热失重,确定颗粒表面的活性剂含量。采用XZD-3型接触角测量仪(北京普特佳公司)测量颗粒接触角,确定颗粒疏水程度与活性剂含量的关系。
2 结果与讨论 2.1 气-液界面处颗粒层的流变性能对气-液界面处CaCO3纳米颗粒层的流变行为进行研究,利用表面压力、压缩模量等参数量化界面处颗粒的富集和分布状态,并与颗粒自身尺寸、疏水性建立联系。
首先,通过对颗粒形貌、接触角等进行物理表征初步确定预先采用微反应方法制备的疏水CaCO3纳米颗粒的性质。CaCO3颗粒的TEM图像如图 2(a)~(d)中左图所示,其平均粒径约为36 nm。图 2(a)~(d)中右图所示为疏水CaCO3颗粒的改性度(xM)与接触角之间的关系。可以看出,随着改性剂硬脂酸钠添加量的提高,即随着颗粒改性度从0增加至100%(100%时硬脂酸钠与CaCO3的质量比约为2.6:100),接触角也从8.8°逐渐开始增加,最大达到117.2°。虽然薄片表面的液滴接触角与分散状态下单一纳米颗粒表面的接触角并不相同,但二者的变化规律一致,即随着单一颗粒表面化学吸附改性基团数量增加,压片后薄片表面的有机链增多,导致薄片的疏水性增强。

|
图 2 不同改性度CaCO3颗粒的TEM照片及接触角照片 Fig.2 TEM and contact angle images of hydrophobic CaCO3 nanoparticles with different modification degrees |
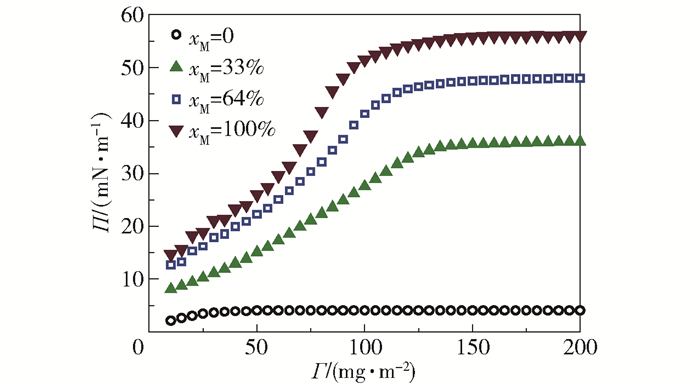
将不同改性度的CaCO3颗粒加入Langmuir槽中进行流变特性测试,可以获得不同疏水性颗粒层对应的平衡表面压力Π,如图 3所示。可以看出,CaCO3颗粒层的表面压力随界面处疏水颗粒表面浓度Γ的变化发生明显改变,并随颗粒疏水性的增加而增大。而亲水颗粒(xM=0,未加入任何改性剂)的表面压力几乎不随挡板压缩界面而改变。由此可以判断亲水颗粒在测量过程中有效迁移到了液相主体相,几乎不影响气-液相界面的流变特性;而当疏水纳米颗粒覆盖到一定程度以后,颗粒间相互作用程度达到最大,所有样品的表面压力不再随颗粒表面浓度的增加而继续增大。
|
图 3 界面处表面压力与不同改性度颗粒表面浓度的关系 Fig.3 Plots of surface pressure vs. surface concentration for different particle hydrophobicities |
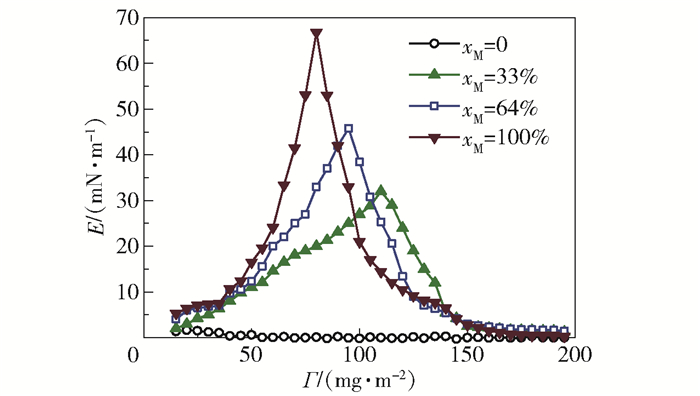
压缩模量E随表面浓度Γ的变化如图 4所示。可以看出,随着颗粒改性度的提高,压缩模量显著增加。而压缩模量的增加,也意味着疏水纳米颗粒间的相互作用不断增强,颗粒层难以形变。换言之,当加入更多疏水性颗粒时,气泡的稳定性也会增强,气-液相界面的更新程度也随之降低,阻碍气-液相间传质。此外,还可以通过压缩模量的最大值来确定达到临界浓度(ΓC)时的坍塌压力。颗粒表面浓度进一步增加时会形成双层或多层颗粒,超过ΓC后虽然压缩模量能有所降低,但界面富集颗粒的空间阻碍作用也更强,同样不利于气-液相间传质。ΓC也代表了相间传质的临界点,可以参照ΓC控制液相中的颗粒浓度。
|
图 4 不同改性度颗粒的表面浓度对颗粒层压缩模量的影响 Fig.4 Effects of surface concentration on tensile modulus for different particle hydrophobicities |
根据疏水CaCO3纳米颗粒原位改性体系的物质浓度范围[14],可以确定疏水CaCO3颗粒加入Ca(OH)2这一传质体系的实验条件,并进一步探索气-液界面处颗粒分布对相间传质的影响。
不同条件下获得的微气泡显微照片如图 5所示。在加入亲水纳米颗粒的情况下,体系中的微气泡尺寸较大,如图 5(a)所示。相比之下,加入疏水CaCO3纳米颗粒后,微气泡尺寸明显降低,如图 5(b)所示。这是因为疏水CaCO3纳米颗粒在气-液界面大量富集,起到了表面活性剂的作用。同时,疏水CaCO3纳米颗粒的存在阻碍了气泡的聚并,增强了微气泡的稳定性。

|
图 5 加入不同改性度颗粒时所获得微气泡的显微照片(颗粒浓度为0.5 g/L) Fig.5 Microscope images of microbubbles at different particle hydrophobicities (the concentration of CaCO3 was 0.5 g/L) |
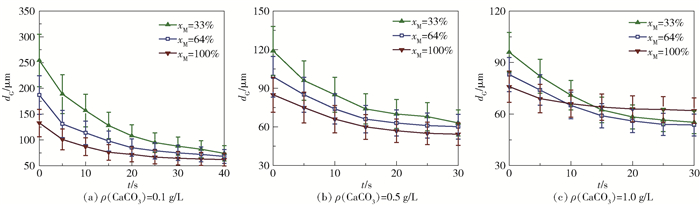
不同条件下的气泡尺寸统计结果如图 6所示。随着颗粒疏水性增加,微气泡尺寸明显减小,气泡直径最小可以降低至50~70 μm。但随着气-液持续流动,气泡尺寸却不再发生明显变化,即CO2不再持续传质和进行反应。特别是对于加入颗粒疏水性最强(xM=100%)、颗粒浓度最高(1 g/L)的体系来说,CO2气泡的平均直径(dG)自始至终只减少了15%,这一变化幅度也说明气-液界面颗粒层难以被压缩,进而导致相间传质效率降低。
|
图 6 不同浓度CaCO3体系中气泡尺寸随时间的变化 Fig.6 Average bubble size as a function of time in dispersions with different CaCO3 concentrations |
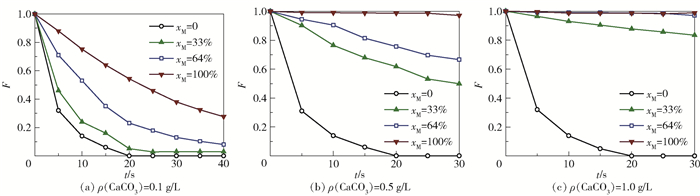
图 7所示为在不同CaCO3浓度和颗粒疏水性条件下,微气泡数量比(F)随时间的变化。这一数量比是根据不同时间下CO2的物质的量和平均气泡大小计算的,计算式为
| $ F = \frac{{\left( {{n_{{\rm{C}}{{\rm{O}}_2}}}{V_{\rm{m}}}} \right)/\left( {\frac{4}{3}{\rm{ \mathsf{ π} }}R_{\rm{G}}^3} \right)}}{{\left( {{n_{{\rm{C}}{{\rm{O}}_2}, 0}}{V_{\rm{m}}}} \right)/\left( {\frac{4}{3}{\rm{ \mathsf{ π} }}R_{{\rm{C}}0}^3} \right)}} = \frac{{{n_{{\rm{C}}{{\rm{O}}_2}}}}}{{{n_{{\rm{C}}{{\rm{O}}_2}, 0}}}}{\left( {\frac{{{d_{{\rm{G}}0}}}}{{{d_{\rm{G}}}}}} \right)^3} $ | (6) |
|
图 7 不同浓度CaCO3体系中微气泡数量比F随时间的变化 Fig.7 Fraction (F) of bubbles remaining as a function of time in dispersions with different CaCO3 concentrations |
式中,n为物质的量,Vm为气体摩尔体积,RG为气泡半径,下标0代表初始位置,即反应器外侧1 cm管路处、刚离开微反应器的新生成气泡群的状态。实际上,F反映的是稳定存在的气泡数量占全部生成气泡数量的比例。如果F值大,说明气泡容易保持稳定,能维持相界面状态,进而阻碍相间传质。从图 7可以看出,亲水颗粒(xM=0)体系中气泡的稳定性几乎不受CaCO3浓度的影响。但对于加入疏水CaCO3颗粒的体系来说,较高的颗粒浓度和较强的颗粒疏水性会显著提升气泡的稳定性。特别是在颗粒疏水性最强(xM=100%)的情况下,较低浓度的颗粒(0.5 g/L)即可为气泡提供足够的稳定性(F > 0.9)。相应地,体系F值的变化也可以用来帮助确定适宜的操作范围,避免气-液传质受阻。此外,若只有表面活性剂加入,因其有机链相较于粒径为30~40 nm的疏水CaCO3颗粒明显更小,对于相界面的覆盖面积也更小,维持气泡稳定、阻碍气-液传质的能力也更弱,F值还会进一步降低。
2.3 疏水CaCO3纳米颗粒在气-液界面的相互作用机制为了预测疏水CaCO3纳米颗粒对气-液相间传质的影响,还进一步研究了疏水颗粒在气-液界面的相互作用机制。
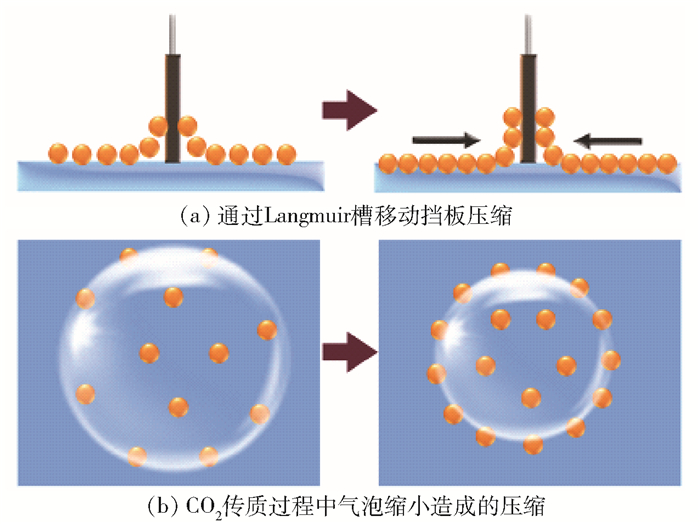
界面处颗粒层的行为在本质上还是颗粒间距离、颗粒间疏水基团相互作用强弱的共同体现。以水平状态的气-液界面为例,图 8(a)所示为Langmuir槽中挡板移动引起颗粒层变形的示意图,可以看出压缩会导致颗粒间距离减小、颗粒层形变加剧。在这种情况下,由于纳米颗粒团聚行为受到颗粒表面有机链促进,单一疏水纳米颗粒强烈倾向于形成团聚体。正如式(1)所示,具有更多有机链的颗粒体现为疏水性更强,颗粒在气-液界面处的吸附能随xM的增大而增大,而范德华引力会加剧这种作用,即强化这些团聚体的互相牵连,进而体现为整体流变特性的显著变化。另外,疏水性强的颗粒构成的颗粒层具有更典型的单层特性,体现为颗粒层很难被压缩。
|
图 8 气-液相界面处压缩疏水纳米颗粒过程示意图 Fig.8 Schematic view of the compression of hydrophobic nanoparticles at the gas-liquid interface |
同样,疏水性强的颗粒也倾向于吸附在球形形态的气-液界面上。特别是随着CO2传质过程的不断进行,气泡中CO2总量不断降低,导致气泡收缩,从而逐渐压缩界面处颗粒层,如图 8(b)所示。在颗粒层达到最大压缩模量之前,传质行为会导致颗粒层持续压缩,即在气-液界面流变特性的测量中和实际传质过程中,颗粒层压缩行为亦非常接近。
为了进一步比较这两种过程,以期通过流变特性预测传质操作范围,还可以将流变测试中的颗粒浓度状态与对应的传质状态进行关联,即在传质实验中计算临界表面浓度ΓC的影响。而对于传质过程来说,可以根据疏水颗粒浓度和气泡的初始加入量通过式(7)计算Γ。
| $ \varGamma = \frac{{{\rho _{{\rm{CaC}}{{\rm{O}}_3}}}{F_{\rm{C}}}\Delta t}}{{4{\rm{ \mathsf{ π} }}R_{\rm{G}}^2{F_{\rm{D}}}\Delta t/\left( {\frac{4}{3}{\rm{ \mathsf{ π} }}R_{\rm{G}}^3} \right)}} = \frac{{{F_{\rm{D}}}}}{{{F_{\rm{C}}}}}6{d_{\rm{G}}}{\rho _{{\rm{CaC}}{{\rm{O}}_3}}} $ | (7) |
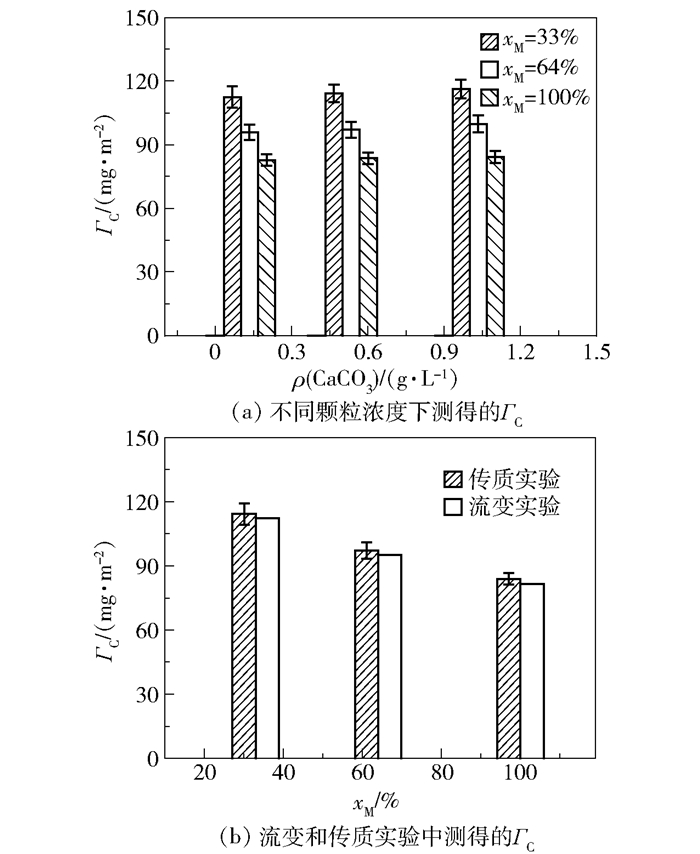
式中,FC为液相流量,mL/min;FD为气相流量,mL/min;ρ表示颗粒的质量浓度,g/L;Δt表示单位时间。临界表面浓度ΓC是根据Γ的最大值确定的,如图 9(a)所示。在不同的CaCO3浓度下,ΓC并没有显著变化,说明疏水颗粒在界面处的吸附行为相似。与图 9(b)所示的流变实验结果相比,可以看出传质性能下降时的颗粒临界浓度与流变测试中对应的临界点ΓC相近。这一结果表明,通过相对简单的流变测试即可初步预测不同改性程度的疏水CaCO3颗粒在气-液界面处的吸附和分布特征,并预测其传质效率。
|
图 9 流变和传质实验中颗粒临界表面浓度ΓC的变化 Fig.9 Changes in the critical surface concentration (ΓC) in the rheological and mass transfer experiments |
若进一步计算CaCO3-Ca(OH)2体系中CO2的传质系数kL,可以通过求解体积传质系数kLa获得。其中,c表示浓度,气-液相的比表面积a(m2/m3)通过气泡平均尺寸与气-液两相的体积比得到,kLa通过式(8)进行计算。
| $ \frac{{{\rm{d}}{c_{{\rm{C}}{{\rm{o}}_2}}}}}{{{\rm{d}}t}} = {k_{\rm{L}}}a\left( {c_{{\rm{C}}{{\rm{O}}_2}}^* - {c_{{\rm{C}}{{\rm{O}}_2}}}} \right) $ | (8) |
根据单位时间Ca(OH)2溶液pH值变化确定等式(8)左侧传质速率,而推动力为相界面处CO2平衡浓度cCO2*与液相主体中CO2浓度cCO2(近似为0,因为主体相中CO2化学吸收极快)之差。cCO2*可通过式(9)计算。
| $ c_{{\rm{C}}{{\rm{O}}_2}}^* = H{p_{{\rm{C}}{{\rm{O}}_2}}} = \frac{\rho }{{{E_{\rm{H}}}{M_{\rm{S}}}}}{p_{{\rm{C}}{{\rm{O}}_2}}} $ | (9) |
式中,亨利系数EH为1.66×105 kPa(25 ℃时);ρ和MS分别为CO2的密度和摩尔质量;pCO2为CO2的入口压力。通过计算得到可压缩颗粒层对应的气-液传质系数约为10-3 m/s,而在不可压缩(即达到临界浓度后)颗粒层存在条件下传质系数仅有10-4 m/s,传质系数降低了约一个数量级。实际上,与亲水颗粒加入时相比,疏水颗粒加入时气泡更小,气-液相界面的面积增加也有利于强化传质和反应,初期传质速率更高。但传质总量会受到疏水颗粒在界面稳定存在和气泡稳定性增强的影响,尤其是随着气泡变小,气-液界面处疏水颗粒动态覆盖的比例增加,出现弹性层特征,这时传质便很难进行,导致传质系数下降。
因此,根据流变实验得到的颗粒临界浓度,可以有针对性地在疏水颗粒的制备过程中或原位改性过程中设定改性颗粒的移除速率,即将油溶剂与气-液界面疏水颗粒适时接触,待界面处颗粒浓度降低后再进行制备、原位改性等需要强化相间传质的工艺操作。
3 结论本文提出一种研究疏水CaCO3纳米颗粒在气-液界面吸附行为的新方法,可根据吸附颗粒层的流变特性量化相应的传质过程。一方面,通过对界面处疏水碳酸钙颗粒层进行流变测量,量化不同疏水性颗粒加入的条件下界面处的表面压力;另一方面,利用膜分散微反应器进行了Ca(OH)2溶液-CaCO3疏水颗粒体系吸收CO2的传质行为表征,发现当颗粒达到临界浓度、颗粒层呈现不可压缩的流变状态时,气-液传质系数会降低约一个数量级(从10-3 m/s到10-4 m/s)。
采用流变行为测量的方法,可以通过压缩模量、表面压力等宏观特性量化微观尺度下疏水颗粒间的相互作用强度。此外,将气-液界面处表面压力与液相中碳酸钙纳米颗粒疏水性、表面浓度建立关系式,还可以进一步确定气-液体系原位合成疏水碳酸钙纳米颗粒的适宜操作范围。
| [1] |
LANDFESTER K, MUSYANOVYCH A, MAILÄNDER V. From polymeric particles to multifunctional nanocapsules for biomedical applications using the miniemulsion process[J]. Journal of Polymer Science:Part A:Polymer Chemistry, 2010, 48(3): 493-515. DOI:10.1002/pola.23786 |
| [2] |
汪伟, 谢锐, 巨晓洁, 等. 微流控法制备新型微颗粒功能材料研究新进展[J]. 化工学报, 2014, 65(7): 2555-2562. WANG W, XIE R, JU X J, et al. Recent progress of microfluidic fabrication of novel functional microparticles[J]. CIESC Journal, 2014, 65(7): 2555-2562. (in Chinese) |
| [3] |
TAYLOR D J F, THOMAS R K, PENFOLD J. Polymer/surfactant interactions at the air/water interface[J]. Advances in Colloid and Interface Science, 2007, 132(2): 69-110. DOI:10.1016/j.cis.2007.01.002 |
| [4] |
董振锋, 刘雪丹, 张建军. 超重力反溶剂沉淀法制备阿霉素纳米药物及其性能研究[J]. 北京化工大学学报(自然科学版), 2016, 43(5): 8-13. DONG Z F, LIU X D, ZHANG J J. Preparation and characterization of doxorubicin nanodrugs by using high-gravity antisolvent precipitation[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2016, 43(5): 8-13. (in Chinese) |
| [5] |
CUI Z G, CUI C F, ZHU Y, et al. Multiple phase inversion of emulsions stabilized by in situ surface activation of CaCO3 nanoparticles via adsorption of fatty acids[J]. Langmuir, 2011, 28(1): 314-320. |
| [6] |
MAINDARKAR S N, BONGERS P, HENSON M A. Predicting the effects of surfactant coverage on drop size distributions of homogenized emulsions[J]. Chemical Engineering Science, 2012, 89: 102-114. |
| [7] |
CHAN A T, LEWIS J A. Size ratio effects on interparticle interactions and phase behavior of microsphere-nanoparticle mixtures[J]. Langmuir, 2008, 24(20): 11399-11405. DOI:10.1021/la800422g |
| [8] |
张志成, 杨建军, 金泽宇, 等. 纳米SiO2修饰玻纤表面对玻纤/聚丙烯复合材料界面性能的影响[J]. 北京化工大学学报(自然科学版), 2016, 43(3): 53-59. ZHANG Z C, YANG J J, JIN Z Y, et al. The effect of nano-silica modified glass fiber on the interfacial properties of glass fiber/PP composites[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2016, 43(3): 53-59. (in Chinese) |
| [9] |
ZHOU W Z, CAO J, LIU W C, et al. How rigid rods self-assemble at curved surfaces[J]. Angewandte Chemie International Edition, 2009, 48(2): 378-381. DOI:10.1002/anie.200804194 |
| [10] |
WI H S, CINGARAPU S, KLABUNDE K J, et al. Nanoparticle adsorption at liquid-vapor surfaces:influence of nanoparticle thermodynamics, wettability, and line tension[J]. Langmuir, 2011, 27(16): 9979-9984. DOI:10.1021/la201791g |
| [11] |
DU L, WANG Y J, WANG K, et al. Preparation of calcium benzene sulfonate detergents by a microdispersion process[J]. Industrial & Engineering Chemistry Research, 2013, 52(31): 10699-10706. |
| [12] |
LUO G S, DU L, WANG Y J, et al. Controllable preparation of particles with microfluidics[J]. Particuology, 2011, 9(6): 545-558. DOI:10.1016/j.partic.2011.06.004 |
| [13] |
BINKS B P, KIRKLAND M, RODRIGUES J A. Origin of stabilisation of aqueous foams in nanoparticle-surfactant mixtures[J]. Soft Matter, 2008, 4(12): 2373-2382. DOI:10.1039/b811291f |
| [14] |
DU L, WANG Y J, LUO G S. In situ preparation of hydrophobic CaCO3 nanoparticles in a gas-liquid microdispersion process[J]. Particuology, 2013, 11(4): 421-427. DOI:10.1016/j.partic.2012.07.009 |
| [15] |
SAFOUANE M, LANGEVIN D, BINKS B P. Effect of particle hydrophobicity on the properties of silica particle layers at the air-water interface[J]. Langmuir, 2007, 23(23): 11546-11553. DOI:10.1021/la700800a |
| [16] |
WEROŃSKI P, ELIMELECH M. Novel numerical method for calculating initial flux of colloid particle adsorption through an energy barrier[J]. Journal of Colloid and Interface Science, 2008, 319(2): 406-415. DOI:10.1016/j.jcis.2007.10.042 |
| [17] |
PETER M, CAMACHO J M F, ADAMOVSKI S, et al. Trends in the binding strength of surface species on nanoparticles:how does the adsorption energy scale with the particle size?[J]. Angewandte Chemie International Edition, 2013, 52(19): 5175-5179. DOI:10.1002/anie.201209476 |
| [18] |
CHENG S F, GREST G S. Structure and diffusion of nanoparticle monolayers floating at liquid/vapor interfaces:a molecular dynamics study[J]. The Journal of Chemical Physics, 2012, 136(21): 214702. DOI:10.1063/1.4725543 |
| [19] |
CUI Z G, CUI Y Z, CUI C F, et al. Aqueous foams stabilized by in situ surface activation of CaCO3 nanoparticles via adsorption of anionic surfactant[J]. Langmuir, 2010, 26(15): 12567-12574. DOI:10.1021/la1016559 |
| [20] |
VAFAEI S, WEN D S. Bubble formation in a quiescent pool of gold nanoparticle suspension[J]. Advances in Colloid and Interface Science, 2010, 159(1): 72-93. DOI:10.1016/j.cis.2010.05.005 |
| [21] |
COMEAU K D, MELI M V. Effect of alkanethiol chain length on gold nanoparticle monolayers at the air-water interface[J]. Langmuir, 2011, 28(1): 377-381. |
| [22] |
ZANG D Y, RIO E, DELON G, et al. Influence of the contact angle of silica nanoparticles at the air-water interface on the mechanical properties of the layers composed of these particles[J]. Molecular Physics, 2011, 109(7-10): 1057-1066. DOI:10.1080/00268976.2010.542778 |








